Durchführungsverordnung (EU) 2017/2470 der Kommission vom 20. Dezember 2017 zur Erstellung der Unionsliste der neuartigen Lebensmittel gemäß der Verordnung (EU) 2015/2283 des Europäischen Parlaments und des Rates über neuartige Lebensmittel
(Text von Bedeutung für den EWR)
(ABl. Nr. L 351 vom 30.12.2017 S. 72;
VO (EU) 2018/460 - ABl. Nr. L 78 vom 21.03.2018 S. 2Inkrafttreten;
VO (EU) 2018/461 - ABl. Nr. L 78 vom 21.03.2018 S. 7Inkrafttreten;
VO (EU) 2018/462 - ABl. Nr. L 78 vom 21.03.2018 S. 11Inkrafttreten;
VO (EU) 2018/469 - ABl. Nr. L 79 vom 22.03.2018 S. 11Inkrafttreten;
VO (EU) 2018/991 - ABl. Nr. L 177 vom 13.07.2018 S. 9Inkrafttreten;
VO (EU) 2018/1011 - ABl. Nr. L 181 vom 18.07.2018 S. 4Inkrafttreten;
VO (EU) 2018/1018 - ABl. Nr. L 183 vom 19.07.2018 S. 9Inkrafttreten;
VO (EU) 2018/1032 - ABl. Nr. L 185 vom 23.07.2018 S. 9Inkrafttreten;
VO (EU) 2018/1023 - ABl. Nr. L 187 vom 24.07.2018 S. 1Inkrafttreten;
VO (EU) 2018/1122 - ABl. Nr. L 204 vom 13.08.2018 S. 36Inkrafttreten;
VO (EU) 2018/1123 - ABl. Nr. L 204 vom 13.08.2018 S. 41Inkrafttreten;
VO (EU) 2018/1132 - ABl. Nr. L 205 vom 14.08.2018 S. 15Inkrafttreten;
VO (EU) 2018/1133 - ABl. Nr. L 205 vom 14.08.2018 S. 15Inkrafttreten;
VO (EU) 2018/1293 - ABl. Nr. L 243 vom 27.09.2018 S. 2Inkrafttreten;
VO (EU) 2018/1631 - ABl. Nr. L 272 vom 31.10.2018 S. 17Inkrafttreten;
VO (EU) 2018/1632 - ABl. Nr. L 272 vom 31.10.2018 S. 23Inkrafttreten;
VO (EU) 2018/1633 - ABl. Nr. L 272 vom 31.10.2018 S. 29Inkrafttreten;
VO (EU) 2018/1647 - ABl. Nr. L 274 vom 05.11.2018 S. 51Inkrafttreten;
VO (EU) 2018/1648 - ABl. Nr. L 275 vom 06.11.2018 S. 1Inkrafttreten;
VO (EU) 2018/1991 - ABl. Nr. L 320 vom 17.12.2018 S. 22Inkrafttreten;
VO (EU) 2018/2016 - ABl. Nr. L 323 vom 19.12.2018 S. 1Inkrafttreten;
VO (EU) 2018/2017 - ABl. Nr. L 323 vom 19.12.2018 S. 4Inkrafttreten;
VO (EU) 2019/108 - ABl. L 23 vom 25.01.2019 S. 4Inkrafttreten;
VO (EU) 2019/109 - ABl. L 23 vom 25.01.2019 S. 7Inkrafttreten;
VO (EU) 2019/110 - ABl. L 23 vom 25.01.2019 S. 11Inkrafttreten;
VO (EU) 2019/387 - ABl. L 70 vom 12.03.2019 S. 17Inkrafttreten;
VO (EU) 2019/388 - ABl. L 70 vom 12.03.2019 S. 21Inkrafttreten;
VO (EU) 2019/456 - ABl. L 79 vom 21.03.2019 S. 13Inkrafttreten;
VO (EU) 2019/506 - ABl. L 85 vom 27.03.2019 S. 11Inkrafttreten;
VO (EU) 2019/760 - ABl. L 125 vom 14.05.2019 S. 13InkrafttretenA;
VO (EU) 2019/1272 - ABl. L 201 vom 30.07.2019 S. 3InkrafttretenA;
VO (EU) 2019/1294 - ABl. L 204 vom 02.08.2019 S. 16Inkrafttreten;
VO (EU) 2019/1314 - ABl. L 205 vom 05.08.2019 S. 4InkrafttretenA;
VO (EU) 2019/1686 - ABl. L 258 vom 09.10.2019 S. 13InkrafttretenA;
VO (EU) 2019/1976 - ABl. L 308 vom 29.11.2019 S. 40Inkrafttreten;
VO (EU) 2019/1979 - ABl. L 308 vom 29.11.2019 S. 62InkrafttretenA;
VO (EU) 2019/2165 - ABl. L 328 vom 18.12.2019 S. 81Inkrafttreten;
VO (EU) 2020/16 - ABl. L 7 vom 13.01.2020 S. 6Inkrafttreten;
VO (EU) 2020/24 - ABl. L 8 vom 14.01.2020 S. 12InkrafttretenA;
VO (EU) 2020/206 - ABl. L 43 vom 17.02.2020 S. 66Inkrafttreten;
VO (EU) 2020/443 - ABl. L 92 vom 26.03.2020 S. 7Inkrafttreten;
VO (EU) 2020/478 - ABl. L 102 vom 02.04.2020 S. 1 Inkrafttreten;
VO (EU) 2020/484 - ABl. L 103 vom 03.04.2020 S. 3Inkrafttreten;
VO (EU) 2020/500 - ABl. L 109 vom 07.04.2020 S. 2InkrafttretenA;
VO (EU) 2020/916 - ABl. L 209 vom 02.07.2020 S. 6Inkrafttreten;
VO (EU) 2020/917 - ABl. L 209 vom 02.07.2020 S. 10Inkrafttreten;
VO (EU) 2020/973 - ABl. L 215 vom 07.07.2020 S. 7InkrafttretenA;
VO (EU) 2020/1163 - ABl. L 258 vom 07.08.2020 S. 1InkrafttretenA;
VO (EU) 2020/1559 - ABl. L 257 vom 27.10.2020 S. 7Inkrafttreten rückwirkende Gültigkeit
A;
VO (EU) 2020/1634 - ABl. L 367 vom 05.11.2020 S. 39
InkrafttretenA;
VO (EU) 2020/1820 - ABl. L 406 vom 03.12.2020 S. 29
Inkrafttreten;
VO (EU) 2020/1821 - ABl. L 406 vom 03.12.2020 S. 34
Inkrafttreten;
VO (EU) 2020/1822 - ABl. L 406 vom 03.12.2020 S. 39
Inkrafttreten;
VO (EU) 2020/1993 - ABl. L 410 vom 07.12.2020 S. 62
InkrafttretenA;
VO (EU) 2021/50 - ABl. L 23 vom 25.01.2021 S. 7
Inkrafttreten;
VO (EU) 2021/51 - ABl. L 23 vom 25.01.2021 S. 10
Inkrafttreten;
VO (EU) 2021/82 - ABl. L 29 vom 28.01.2021 S. 16
Inkrafttreten;
VO (EU) 2021/96 - ABl. L 31 vom 29.01.2021 S. 201
InkrafttretenA;
VO (EU) 2021/120 - ABl. L 37 vom 03.02.2021 S. 1
InkrafttretenA;
VO (EU) 2021/668 - ABl. L 141 vom 26.04.2021 S. 3
Inkrafttreten;
VO (EU) 2021/670 - ABl. L 141 vom 26.04.2021 S. 14
InkrafttretenA;
VO (EU) 2021/882 - ABl. L 194 vom 02.06.2021 S. 16
Inkrafttreten;
VO (EU) 2021/900 - ABl. L 197 vom 04.06.2021 S. 71
Inkrafttreten;
VO (EU) 2021/912 - ABl. L 199 vom 07.06.2021 S. 10
InkrafttretenA;
VO (EU) 2021/1318 - ABl. L 286 vom 10.08.2021 S. 5
Inkrafttreten;
VO (EU) 2021/1319 - ABl. L 286 vom 10.08.2021 S. 12
Inkrafttreten;
VO (EU) 2021/1326 - ABl. L 288 vom 11.08.2021 S. 24
InkrafttretenA;
VO (EU) 2021/1377 - ABl. L 297 vom 20.08.2021 S. 20
Inkrafttreten Art. 2A;
VO (EU) 2021/1974 - ABl. L 402 vom 15.11.2021 S. 5
Inkrafttreten Art. 2;
VO (EU) 2021/1975 - ABl. L 402 vom 15.11.2021 S. 10
Inkrafttreten Art. 2;
VO (EU) 2021/2029 - ABl. L 415 vom 22.11.2021 S. 9
Inkrafttreten Art. 2;
VO (EU) 2021/2079 - ABl. L 426 vom 29.11.2021 S. 16
Inkrafttreten Art. 2; VO (EU) 2021/2129 - ABl. L 432 vom 03.12.2021 S. 13
Inkrafttreten Art. 2;
VO (EU) 2021/2191 - ABl. L 445 vom 13.12.2021 S. 1
Inkrafttreten
A;
VO (EU) 2022/47 - ABl. L 9 vom 14.01.2022 S. 29
InkrafttretenA, ber. L 89 S. 11;
VO (EU) 2022/168 - ABl. L 28 vom 09.02.2022 S. 5
Inkrafttreten Art 2;
VO (EU) 2022/169 - ABl. L 28 vom 09.02.2022 S. 10
Inkrafttreten Art 2;
VO (EU) 2022/187 - ABl. L 30 vom 11.02.2022 S. 102
Inkrafttreten Art 2;
VO (EU) 2022/188 - ABl. L 30 vom 11.02.2022 S. 108
Inkrafttreten Art 2A;
VO (EU) 2022/196 - ABl. L 31 vom 14.02.2022 S. 46
Inkrafttreten;
VO (EU) 2022/202 - ABl. L 33 vom 15.02.2022 S. 41
InkrafttretenA;
VO (EU) 2022/672 - ABl. L 122 vom 25.04.2022 S. 24
Inkrafttreten;
VO (EU) 2022/673 - ABl. L 122 vom 25.04.2022 S. 27
Inkrafttreten Art. 2
VO (EU) 2022/684 - ABl. L 126 vom 29.04.2022 S. 10
InkrafttretenA;
VO (EU) 2022/961 - ABl. L 165 vom 21.06.2022 S. 41
Inkrafttreten Art. 2 Art 3;
VO (EU) 2022/965 - ABl. L 166 vom 22.06.2022 S. 118
Inkrafttreten Art. 2 Art 3;
VO (EU) 2022/966 - ABl. L 166 vom 22.06.2022 S. 125
Inkrafttreten Art. 2A;
VO (EU) 2022/1160 - ABl. L 179 vom 06.07.2022 S. 25
InkrafttretenA, ber. L 210 S. 20;
VO (EU) 2022/1365 - ABl. L 205 vom 05.08.2022 S. 230
Inkrafttreten;
VO (EU) 2022/1373 - ABl. L 206 vom 08.08.2022 S. 28
Inkrafttreten Art. 2 Art. 3;
VO (EU) 2022/1381 - ABl. L 207 vom 09.08.2022 S. 12
InkrafttretenA;
VO (EU) 2022/2534 - ABl. L 328 vom 22.12.2022 S. 85
Inkrafttreten Art. 2 Art. 3;
VO (EU) 2022/2535 - ABl. L 328 vom 22.12.2022 S. 91
InkrafttretenA;
VO (EU) 2023/4 - ABl. L 2 vom 04.01.2023 S. 3
Inkrafttreten Art. 2;
VO (EU) 2023/5 - ABl. L 2 vom 04.01.2023 S. 9
Inkrafttreten Art. 2 Art. 3;
VO (EU) 2023/6 - ABl. L 2 vom 04.01.2023 S. 16
Inkrafttreten Art. 2 Art. 3;
VO (EU) 2023/7 - ABl. L 2 vom 04.01.2023 S. 21
Inkrafttreten Art. 2 Art. 3;
VO (EU) 2023/52 - ABl. L 3 vom 05.01.2023 S. 1
Inkrafttreten Art. 2 Art. 3;
VO (EU) 2023/58 - ABl. L 5 vom 06.01.2023 S. 10
Inkrafttreten Art. 2 Art. 3;
VO (EU) 2023/65 - ABl. L 6 vom 09.01.2023 S. 1
InkrafttretenA;
VO (EU) 2023/113 - ABl. L 15 vom 17.01.2023 S. 1
Inkrafttreten Art. 2 Art. 3;
VO (EU) 2023/267 - ABl. L 39 vom 09.02.2023 S. 1
Inkrafttrete;
VO (EU) 2023/463 - ABl. L 68 vom 06.03.2023 S. 32
Inkrafttreten Art.2 Art. 3;
VO (EU) 2023/652 - ABl. L 81 vom 21.03.2023 S. 23
Inkrafttreten;
VO (EU) 2023/667 - ABl. L 84 vom 23.03.2023 S. 3
InkrafttretenA;
VO (EU) 2023/859 - ABl. L 111 vom 26.04.2023 S. 17
Inkrafttreten Art. 2 Art. 3A;
VO (EU) 2023/931 - ABl. L 124 vom 10.05.2023 S. 1
Inkrafttreten;
VO (EU) 2023/937 - ABl. L 125 vom 11.05.2023 S. 12
Inkrafttreten;
VO (EU) 2023/938 - ABl. L 125 vom 11.05.2023 S. 16
Inkrafttreten;
VO (EU) 2023/943 - ABl. L 126 vom 12.05.2023 S. 41
Inkrafttreten Art.2 Art. 3A;
VO (EU) 2023/948 - ABl. L 128 vom 15.05.2023 S. 52
Inkrafttreten Art. 2 Art. 3;
VO (EU) 2023/949 - ABl. L 128 vom 15.05.2023 S. 60
Inkrafttreten Art. 2 Art.3;
VO (EU) 2023/950 - ABl. L 128 vom 15.05.2023 S. 68
Inkrafttreten;
VO (EU) 2023/951 - ABl. L 128 vom 15.05.2023 S. 73
Inkrafttreten;
VO (EU) 2023/961 - ABl. L 129 vom 15.05.2023 S. 3
InkrafttretenA;
VO (EU) 2023/972 - ABl. L 132 vom 17.05.2023 S. 46
Inkrafttreten Art. 2 Art. 3A;
VO (EU) 2023/1581 - ABl. L 194 vom 02.08.2023 S. 4
Inkrafttreten Art. 2;
VO (EU) 2023/1582 - ABl. L 194 vom 02.08.2023 S. 8
Inkrafttreten;
VO (EU) 2023/1583 - ABl. L 194 vom 02.08.2023 S. 13
Inkrafttreten;
VO (EU) 2023/2145 - ABl. L 2023/2145 vom 17.10.2023
Inkrafttreten *
A;
VO (EU) 2023/2210 - ABl. L 2023/2210 vom 23.10.2023
Inkrafttreten Art. 2 Art. 3;
VO (EU) 2023/2214 - ABl. L 2023/2214 vom 24.10.2023
Inkrafttreten Art. 2 Art. 3;
VO (EU) 2023/2215 - ABl. L 2023/2214 vom 24.10.2023
Inkrafttreten Art. 2 Art. 3)
gestützt auf die Verordnung (EU) 2015/2283 des Europäischen Parlaments und des Rates über neuartige Lebensmittel, zur Änderung der Verordnung (EU) Nr. 1169/2011 des Europäischen Parlaments und des Rates und zur Aufhebung der Verordnung (EG) Nr. 258/97 des Europäischen Parlaments und des Rates und der Verordnung (EG) Nr. 1852/2001 der Kommission 1, insbesondere auf Artikel 8,
(1) In der Verordnung (EU) 2015/2283 sind das Inverkehrbringen und die Verwendung neuartiger Lebensmittel in der Union geregelt.
(2) Gemäß Artikel 8 der Verordnung (EU) 2015/2283 ist die Kommission verpflichtet, die Unionsliste der neuartigen Lebensmittel zu erstellen, die gemäß der Verordnung (EG) Nr. 258/97 des Europäischen Parlaments und des Rates 2 genehmigt oder gemeldet worden sind.
(3) Die Unionsliste der neuartigen Lebensmittel gilt unbeschadet anderer Bestimmungen, die in branchenspezifischen Rechtsvorschriften festgelegt sind.
(4) Die in dieser Verordnung vorgesehenen Maßnahmen entsprechen der Stellungnahme des Ständigen Ausschusses für Pflanzen, Tiere, Lebensmittel und Futtermittel
Diese Verordnung ist in allen ihren Teilen verbindlich und gilt unmittelbar in jedem Mitgliedstaat.
Brüssel, den 20. Dezember 2017
| .Zugelassenes neuartiges Lebensmittel |
.Bedingungen, unter denen das neuartige Lebensmittel verwendet werden darf |
.zusätzliche spezifische Kennzeichnungsvorschriften |
sonstige Anforderungen |
Datenschutz |
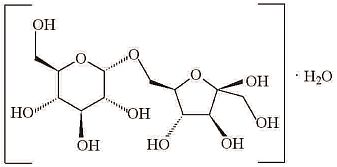
| N-Acetyl-D-Neuraminsäure |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "N-Acetyl-D-Neuraminsäure".
Nahrungsergänzungsmittel, dieN-Acetyl-D-Neuraminsäure enthalten, werden mit dem Hinweis versehen, dass das Nahrungsergänzungsmittel nicht an Säuglinge, Kleinkinder oder Kinder unter 10 Jahren verabreicht werden sollte, wenn sie innerhalb eines Zeitraums von 24 Stunden Muttermilch oder andere Lebensmittel mit zugesetzterN-Acetyl-D-Neuraminsäure verzehren. |
|
|
| Säuglingsanfangsnahrung und Folgenahrung im Sinne der Verordnung (EU) Nr. 609/2013 1 |
0,05 g/l rekonstituierte Nahrung |
| Getreidebeikost und andere Beikost für Säuglinge und Kleinkinder im Sinne der Verordnung (EU) Nr. 609/2013 |
0,05 g/kg feste Nahrung |
| Lebensmittel für besondere medizinische Zwecke für Säuglinge und Kleinkinder im Sinne der Verordnung (EU) Nr. 609/2013 |
Im Einklang mit den besonderen Ernährungsanforderungen von Säuglingen und Kleinkindern, für die die Erzeugnisse bestimmt sind, aber keinesfalls mehr als die Höchstgehalte, die für die den Erzeugnissen entsprechende Kategorie in der Tabelle festgelegt ist |
| Tagesrationen für eine gewichtskontrollierende Ernährung im Sinne der Verordnung (EU) Nr. 609/2013 |
0,2 g/l (Getränke)
1,7 g/kg (Riegel) |
| Lebensmittel mit Angaben über das Nichtvorhandensein oder das reduzierte Vorhandensein von Gluten gemäß den Anforderungen der Durchführungsverordnung (EU) Nr. 828/2014 der Kommission 2 |
1,25 g/kg |
| Nicht aromatisierte pasteurisierte und (auch durch Ultrahocherhitzung) sterilisierte Erzeugnisse auf Milchbasis |
0,05 g/l |
| Nicht aromatisierte fermentierte Milchprodukte, die nach der Fermentation wärmebehandelt wurden, sowie aromatisierte fermentierte Milchprodukte, auch wärmebehandelt |
0,05 g/l (Getränke)
0,4 g/kg (feste Nahrung) |
| Milchprodukt-Analoge, auch Getränkeweißer |
0,05 g/l (Getränke)
0,25 g/kg (feste Nahrung) |
| Getreideriegel |
0,5 g/kg |
| Tafelsüßen |
8,3 g/kg |
| Getränke auf Obst- und Gemüsebasis |
0,05 g/l |
| Aromatisierte Getränke |
0,05 g/l |
| Kaffee, Tee, Kräuter- und Früchtetee, Zichorie; Auszüge aus Tee, Kräuter- und Früchtetee und Zichorie; Tee-, Pflanzen-, Frucht- und Getreideaufgusszubereitungen |
0,2 g/kg |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG 3 |
300 mg/Tag für die allgemeine Bevölkerung über 10 Jahren
55 mg/Tag für Säuglinge
130 mg/Tag für Kleinkinder
250 mg/Tag für Kinder zwischen 3 und 10 Jahren |
| Getrocknetes Fruchtfleisch vonAdansonia digitata (Baobab) |
Keine Angabe |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Baobab-Fruchtfleisch". |
|
|
| Extrakt aus Zellkulturen vonAjuga reptans |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
|
|
|
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
Im Einklang mit der normalen Verwendung in Nahrungsergänzungsmitteln aus einem vergleichbaren Extrakt aus den blühenden oberirdischen Teilen vonAjuga reptans |
| Akkermansia muciniphila (pasteurisiert)
Stand: VO (EU) 2022/168 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
|
|
| Lebensmittel für besondere medizinische Zwecke im Sinne der Verordnung (EU) Nr. 609/2013 für Erwachsene, ausgenommen Schwangere und Stillende |
3,4 × 1010 Zellen/Tag |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "pasteurisierte Akkermansia muciniphila". |
Zugelassen am 1. März 2022. Diese Aufnahme erfolgt auf der Grundlage geschützter wissenschaftlicher Erkenntnisse und wissenschaftlicher Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen.
Antragsteller: A-Mansia Biotech S.A., rue Granbonpré, 11, Bâtiment H, 1435 Mont-Saint-Guibert. Belgien. Solange der Datenschutz gilt, darf das neuartige Lebensmittel "pasteurisierte Akkermansia muciniphila" nur von A-Mansia Biotech S.A. in der Union in Verkehr gebracht werden, es sei denn, ein späterer Antragsteller erhält die Zulassung für das neuartige Lebensmittel ohne Bezugnahme auf die geschützten wissenschaftlichen Erkenntnisse oder wissenschaftlichen Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen, oder er hat die Zustimmung von Mansia Biotech S.A.
Zeitpunkt, zu dem der Datenschutz erlischt: 1. März 2027. |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG für Erwachsene, ausgenommen Schwangere und Stillende |
3,4 × 1010 Zellen/Tag |
Die Kennzeichnung von Nahrungsergänzungsmitteln, die pasteurisierte Akkermansia muciniphila enthalten, muss mit dem Hinweis versehen sein, dass sie nur von Erwachsenen mit Ausnahme von Schwangeren und Stillenden verzehrt werden sollten. |
| L-Alanyl-L-Glutamin |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
|
|
|
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
|
| Lebensmittel für besondere medizinische Zwecke im Sinne der Verordnung (EU) Nr. 609/2013, ausgenommen Lebensmittel für Säuglinge und Kleinkinder |
| Getränke zur Deckung des Energiebedarfs bei intensiver Muskelanstrengung, vor allem für Sportler |
| Algenöl aus der MikroalgeUlkenia sp. |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte an DHA |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Öl aus der MikroalgeUlkenia sp.". |
|
|
| Backwaren (Brot, Brötchen und Kekse) |
200 mg/100 g |
| Getreideriegel |
500 mg/100 g |
| Nichtalkoholische Getränke (einschließlich Getränke auf Milchbasis) |
60 mg/100 ml |
| Allanblackia-Saatöl
Stand: VO (EU) 2019/110 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Allanblackia-Saatöl". |
|
|
| Gelbe Streichfette und Brotaufstriche auf Sahnebasis |
30 g/100 g |
| Mischungen aus pflanzlichen Ölen * und Milch (die unter die Lebensmittelkategorie "Milchprodukt-Analoge, auch Getränkeweißer" fallen) |
30 g/100 g |
| *) Ausgenommen Olivenöl und Oliventresteröl im Sinne des Anhangs VII Teil VIII der Verordnung (EU) Nr. 1308/2013. |
| Blattextrakt ausAloe macroclada Baker |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
|
|
|
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
Im Einklang mit der normalen Verwendung eines vergleichbaren Gels ausAloe vera (L.) Burm. in Nahrungsergänzungsmitteln |
| Larven von Alphitobius diaperinus (Getreideschimmelkäfer), gefroren, als Paste, getrocknet und in Pulverform
Stand: VO (EU) 2023/58 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte (g/100 g) |
- Je nach Form lautet die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, "Gefrorene Larven/Paste aus Larven von Alphitobius diaperinus (Getreideschimmelkäfer)" oder "Getrocknete Larven/Pulver aus Larven von Alphitobius diaperinus (Getreideschimmelkäfer)".
- Die Kennzeichnung von Nahrungsergänzungsmitteln, die das neuartige Lebensmittel enthalten, muss mit dem Hinweis versehen sein, dass solche Nahrungsergänzungsmittel nicht von Personen unter 18 Jahren verzehrt werden sollten.
- Die Kennzeichnung der Lebensmittel, die Larven von Alphitobius diaperinus (Getreideschimmelkäfer) in gefrorener, pastenartiger, getrockneter oder pulverisierter Form enthalten, muss mit dem Hinweis versehen sein, dass diese Zutat bei Verbrauchern, die bekanntermaßen gegen Krebstiere und Erzeugnisse daraus sowie gegen Hausstaubmilben allergisch sind, allergische Reaktionen auslösen kann.
Dieser Hinweis muss in unmittelbarer Nähe der Zutatenliste angebracht werden.
|
|
Zugelassen am 26.1.2023. Diese Aufnahme erfolgt auf der Grundlage eigentumsrechtlich geschützter wissenschaftlicher Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen.
Antragsteller: Ynsect NL B.V., Harderwijkerweg 141B, 3852 AB Ermelo, Niederlande.
Solange der Datenschutz gilt, darf das neuartige Lebensmittel nur von Ynsect NL B.V. in der Union in Verkehr gebracht werden, es sei denn, ein späterer Antragsteller erhält die Zulassung für das neuartige Lebensmittel ohne Bezugnahme auf die eigentumsrechtlich geschützten wissenschaftlichen Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen, oder er hat die Zustimmung von Ynsect NL B.V.
Zeitpunkt, zu dem der Datenschutz erlischt: 26.1.2028. |
| Getreideriegel |
25 (getrocknet)
25 (Pulver) |
| Brot und Brötchen |
20 (Pulver) |
| Verarbeitetes Getreide und Frühstückscerealien |
10 (getrocknet)
10 (Pulver) |
| Porridge |
15 (Pulver) |
| Vormischungen (trocken) für Backwaren |
10 (Pulver) |
| Getrocknete Erzeugnisse aus Teigwaren |
10 (Pulver) |
| Gefüllte Erzeugnisse aus Teigwaren |
28 (gefroren oder als Paste)
10 (Pulver) |
| Molkenpulver |
35 (Pulver) |
| Suppen |
15 (Pulver) |
| Gerichte auf Getreide-, Teigwarenbasis |
5 (Pulver) |
| Gerichte auf Pizzabasis |
5 (getrocknet)
5 (Pulver) |
| Nudeln |
10 (Pulver) |
| Snacks außer Chips |
10 (getrocknet)
10 (Pulver) |
| Chips |
10 (Pulver) |
| Cracker und Brotstangen |
10 (Pulver) |
| Erdnussbutter |
15 (Pulver) |
| Verzehrfertige herzhafte Sandwiches |
20 (Pulver) |
| Fleischzubereitungen |
14 (gefroren oder als Paste)
5 (Pulver) |
| Fleischanaloge |
40 (gefroren oder als Paste)
15 (Pulver) |
| Analoge von Milch und Milchprodukten |
10 (Pulver) |
| Schokoladenerzeugnisse |
5 (Pulver) |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG für Erwachsene |
4 g/Tag (Pulver) |
| Öl aus antarktischem Krill (Euphausia superba) |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte für die Summe aus DHa und EPA |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Lipidextrakt aus dem Krebstier antarktischer Krill (Euphausia superba)". |
|
|
| Milchprodukte, ausgenommen Getränke auf Milchbasis |
200 mg/100 g oder für Käseprodukte 600 mg/100 g |
| Milchprodukt-Analoge, ausgenommen Getränke |
200 mg/100 g oder für Käseprodukt-Analoge 600 mg/100 g |
| Nichtalkoholische Getränke
Getränke auf Milchbasis
Milchersatzgetränke |
80 mg/100 ml |
| Streichfette und Salatsoßen |
600 mg/100 g |
| Speisefette |
360 mg/100 ml |
| Frühstückscerealien |
500 mg/100 g |
| Backwaren (Brot, Brötchen und Kekse) |
200 mg/100 g |
| Getreideriegel |
500 mg/100 g |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
3.000 mg/Tag für die allgemeine Bevölkerung
450 mg/Tag für Schwangere und Stillende |
| Lebensmittel für besondere medizinische Zwecke im Sinne der Verordnung (EU) Nr. 609/2013 |
Entsprechend den besonderen Ernährungsbedürfnissen des Personenkreises, für den die Erzeugnisse bestimmt sind |
| Tagesrationen für eine gewichtskontrollierende Ernährung im Sinne der Verordnung (EU) Nr. 609/2013 und Mahlzeitersatz für eine gewichtskontrollierende Ernährung |
250 mg/Mahlzeit |
| Getreidebeikost und andere Beikost für Säuglinge und Kleinkinder im Sinne der Verordnung (EU) Nr. 609/2013 |
200 mg/100 ml |
| Lebensmittel zur Deckung des Energiebedarfs bei intensiver Muskelanstrengung, vor allem für Sportler |
| Lebensmittel mit Angaben über das Nichtvorhandensein oder das reduzierte Vorhandensein von Gluten gemäß den Anforderungen der Durchführungsverordnung (EU) Nr. 828/2014 der Kommission |
| Phospholipidreiches Öl aus antarktischem Krill (Euphausia superba) |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte für die Summe aus DHa und EPA |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Lipidextrakt aus dem Krebstier antarktischer Krill (Euphausia superba)". |
|
|
| Milchprodukte, ausgenommen Getränke auf Milchbasis |
200 mg/100 g oder für Käseprodukte 600 mg/100 g |
| Milchprodukt-Analoge, ausgenommen Getränke |
200 mg/100 g oder für Käseprodukt-Analoge 600 mg/100 g |
| Nichtalkoholische Getränke
Getränke auf Milchbasis
Milchersatzgetränke |
80 mg/100 ml |
| Streichfette und Salatsoßen |
600 mg/100 g |
| Speisefette |
360 mg/100 ml |
| Frühstückscerealien |
500 mg/100 g |
| Backwaren (Brot, Brötchen und Kekse) |
200 mg/100 g |
| Getreideriegel |
500 mg/100 g |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
3.000 mg/Tag für die allgemeine Bevölkerung
450 mg/Tag für Schwangere und Stillende |
| Lebensmittel für besondere medizinische Zwecke im Sinne der Verordnung (EU) Nr. 609/2013 |
Entsprechend den besonderen Ernährungsbedürfnissen des Personenkreises, für den die Erzeugnisse bestimmt sind |
| Tagesrationen für eine gewichtskontrollierende Ernährung im Sinne der Verordnung (EU) Nr. 609/2013 und Mahlzeitersatz für eine gewichtskontrollierende Ernährung |
250 mg/Mahlzeit |
| Getreidebeikost und andere Beikost für Säuglinge und Kleinkinder im Sinne der Verordnung (EU) Nr. 609/2013 |
200 mg/100 ml |
| Lebensmittel zur Deckung des Energiebedarfs bei intensiver Muskelanstrengung, vor allem für Sportler |
| Lebensmittel mit Angaben über das Nichtvorhandensein oder das reduzierte Vorhandensein von Gluten gemäß den Anforderungen der Durchführungsverordnung (EU) Nr. 828/2014 der Kommission |
| Arachidonsäurereiches Öl aus dem PilzMortierella alpina
Stand: VO (EU) 2021/1318 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Öl aus Mortierella alpina" oder " Mortierella-alpina-Öl. |
|
|
| Säuglingsanfangsnahrung und Folgenahrung im Sinne der Verordnung (EU) Nr. 609/2013 |
Gemäß der Verordnung (EU) Nr. 609/2013 |
| Lebensmittel für besondere medizinische Zwecke für Säuglinge im Sinne der Verordnung (EU) Nr. 609/2013 |
Gemäß der Verordnung (EU) Nr. 609/2013 |
| Arganöl ausArgania spinosa |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Arganöl", und bei Verwendung als Würzmittel ist das Etikett mit dem Hinweis "Pflanzenöl ausschließlich zur Verwendung als Würzmittel" zu versehen. |
|
|
| Als Würzmittel |
Keine Angabe |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
Im Einklang mit einer normalen Verwendung als pflanzliches Speiseöl |
|
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Astaxanthinreiches Oleoresin aus der Alge Haematococcus pluvialis".
Die Kennzeichnung von Nahrungsergänzungsmitteln, die Astaxanthinreiches Oleoresin aus der Alge Haematococcus pluvialis enthalten, muss den Hinweis tragen, dass sie nicht von Säuglingen, Kindern und Jugendlichen unter 14 Jahren verzehrt werden sollten. |
|
|
|
Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG, ausgenommen Säuglinge, Kleinkinder, Kinder und Jugendliche unter 14 Jahren |
40-80 mg Oleoresin pro Tag, was ≤ 8 mg Astaxanthin pro Tag entspricht |
|
|
|
| Astaxanthinreiches Oleoresin aus der AlgeHaematococcus pluvialis
Stand: VO"en (EU) 2023/1581; 2021/1377 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte für Astaxanthin |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Astaxanthinreiches Oleoresin aus der Alge Haematococcus pluvialis".
Die Kennzeichnung von Nahrungsergänzungsmitteln, die Astaxanthinreiches Oleoresin aus der Alge Haematococcus pluvialis enthalten, muss den Hinweis tragen, dass sie nicht verzehrt werden sollten:
- wenn andere Astaxanthin-Ester enthaltende Nahrungsergänzungsmittel am selben Tag verzehrt werden
- von Säuglingen und Kleinkindern unter 3 Jahren
- von Säuglingen und Kindern unter 10 Jahren *
- von Säuglingen, Kindern und Jugendlichen unter 14 Jahren *
_________
*) Je nach Altersgruppe, für die das Nahrungsergänzungsmittel bestimmt ist. |
|
|
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG, ausgenommen solche für Säuglinge und Kleinkinder |
2,3 mg Astaxanthin pro Tag für Kinder zwischen 3 und 10 Jahren |
| 5,7 mg Astaxanthin pro Tag für Jugendliche zwischen 10 und 14 Jahren |
| 8 mg Astaxanthin pro Tag für die allgemeine Bevölkerung über 14 Jahren |
| Basilikumsamen (Ocimum basilicum) |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
|
|
|
| Fruchtsaft und Frucht-/Gemüsesaftmischungen |
3 g/200 ml bei Zugabe von ganzen Basilikumsamen (cimum basilicum) |
| Betain |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte 7 |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Betain".
Die Kennzeichnung von Lebensmitteln, die Betain enthalten, muss mit dem Hinweis versehen sein, dass die Lebensmittel nicht verzehrt werden sollten, wenn am selben Tag auch Nahrungsergänzungsmittel konsumiert werden, die Betain enthalten. |
|
Zugelassen am 22. August 2019. Diese Aufnahme erfolgt auf der Grundlage geschützter wissenschaftlicher Erkenntnisse und wissenschaftlicher Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen.
Antragsteller: DuPont Nutrition Biosciences ApS, Langebrogade 1 Kopenhagen K, DK-1411, Dänemark. Solange der Datenschutz gilt, darf das neuartige Lebensmittel "Betain" nur von DuPont Nutrition Biosciences ApS in der Union in Verkehr gebracht werden, es sei denn, ein späterer Antragsteller erhält die Zulassung für das neuartige Lebensmittel ohne Bezugnahme auf die wissenschaftlichen Erkenntnisse oder wissenschaftlichen Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen, oder er hat die Zustimmung von DuPont Nutrition Biosciences ApS.
Zeitpunkt, zu dem der Datenschutz erlischt: 22. August 2024. |
| Getränkepulver, isotonische Getränke und Energydrinks für Sportler |
60 mg/100 g |
| Protein- und Getreideriegel für Sportler |
500 mg/100 g |
| Mahlzeitersatz für Sportler |
20 mg/100 g |
| Tagesrationen für eine gewichtskontrollierende Ernährung im Sinne der Verordnung (EU) Nr. 609/2013 |
500 mg/100 g (Riegel)
136 mg/100 g (Suppe)
188 mg/100 g (Porridge)
60 mg/100 g (Getränke) |
| Lebensmittel für besondere medizinische Zwecke im Sinne der Verordnung (EU) Nr. 609/2013, für Erwachsene |
400 mg/Tag |
| Fermentierter Extrakt aus schwarzen Bohnen |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Fermentierter Extrakt aus schwarzen Bohnen (Sojabohnen)" oder "Fermentierter Sojaextrakt". |
|
|
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
4,5 g/Tag |
| Rinder-Lactoferrin |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Lactoferrin aus Kuhmilch". |
|
|
| Säuglingsanfangsnahrung und Folgenahrung im Sinne der Verordnung (EU) Nr. 609/2013 (trinkfertig) |
100 mg/100 ml |
| Für Kleinkinder bestimmte Lebensmittel auf Milchbasis (verzehr-/trinkfertig) |
200 mg/100 g |
| Verarbeitete Getreidekost (in fester Form) |
670 mg/100 g |
| Lebensmittel für besondere medizinische Zwecke im Sinne der Verordnung (EU) Nr. 609/2013 |
Je nach den Bedürfnissen des Einzelnen bis zu 3 g/Tag |
| Getränke auf Milchbasis |
200 mg/100 g |
| Getränkemischungen in Pulverform auf Milchbasis (trinkfertig) |
330 mg/100 g |
| Getränke auf Basis von fermentierter Milch (einschließlich Joghurtgetränke) |
50 mg/100 g |
| Nichtalkoholische Getränke |
120 mg/100 g |
| Erzeugnisse auf Joghurtbasis |
80 mg/100 g |
| Erzeugnisse auf Käsebasis |
2.000 mg/100 g |
| Speiseeis |
130 mg/100 g |
| Kuchen und feine Backwaren |
1.000 mg/100 g |
| Bonbons |
750 mg/100 g |
| Kaugummi |
3.000 mg/100 g |
| Basisches Molkenprotein-Isolat aus Kuhmilch
Stand: VO"en (EU) 2023/65; 2019/1686 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Molkenprotein-Isolat aus Milch".
Nahrungsergänzungsmittel, die basisches Molkenprotein-Isolat aus Kuhmilch enthalten, sind mit folgendem Hinweis zu versehen:
"Dieses Nahrungsergänzungsmittel sollte nicht von Säuglingen/Kindern/Jugendlichen unter 1/3/18 * Jahren verzehrt werden."
____
*) Je nach Altersgruppe, für die das Nahrungsergänzungsmittel bestimmt ist. |
|
Zugelassen am 20. November 2018. Diese Aufnahme erfolgt auf der Grundlage geschützter wissenschaftlicher Erkenntnisse und wissenschaftlicher Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen. Antragsteller: Armor Protéines S.A.S., 19 bis, rue de la Libération 35460 Saint-Brice-en-Coglès, Frankreich. Solange der Datenschutz gilt, darf das neuartige Lebensmittel basisches Molkenprotein-Isolat aus Kuhmilch nur von Armor Protéines S.A.S. in der Union in Verkehr gebracht werden, es sei denn, ein späterer Antragsteller erhält die Zulassung für das neuartige Lebensmittel ohne Bezugnahme auf die wissenschaftlichen Erkenntnisse oder wissenschaftlichen Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen, oder er hat die Zustimmung von Armor Protéines S.A.S. Zeitpunkt, zu dem der Datenschutz erlischt: 20. November 2023. |
| Säuglingsanfangsnahrung im Sinne der Verordnung (EU) Nr. 609/2013 |
30 mg/100 g (Pulver) |
| 3,9 mg/100 ml (rekonstituiert) |
| Folgenahrung im Sinne der Verordnung (EU) Nr. 609/2013 |
30 mg/100 g (Pulver) |
| 4,2 mg/100 ml (rekonstituiert) |
| Tagesrationen für eine gewichtskontrollierende Ernährung im Sinne der Verordnung (EU) Nr. 609/2013 |
300 mg/Tag |
| Lebensmittel für besondere medizinische Zwecke im Sinne der Verordnung (EU) Nr. 609/2013 |
30 mg/100 g (Nahrungspulver für Säuglinge in den ersten Lebensmonaten bis zur Einführung einer angemessenen Beikost) |
| 3,9 mg/100 ml (rekonstituierte Nahrung für Säuglinge in den ersten Lebensmonaten bis zur Einführung einer angemessenen Beikost) |
| 30 mg/100 g (Nahrungspulver für Säuglinge ab Einführung einer angemessenen Beikost) |
| 4,2 mg/100 ml (rekonstituierte Nahrung für Säuglinge ab Einführung einer angemessenen Beikost) |
| 58 mg/Tag für Kleinkinder |
| 380 mg/Tag für Kinder und Jugendliche von 3 bis 18 Jahren |
| 610 mg/Tag für Erwachsene |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
25 mg/Tag für Säuglinge |
| 58 mg/Tag für Kleinkinder |
| 250 mg/Tag für Kinder und Jugendliche von 3 bis 18 Jahren |
| 610 mg/Tag für Erwachsene |
| Saatöl ausBuglossoides arvensis |
Spezifizierte Lebensmittelkategorie |
Höchstgehalt an Stearidonsäure (STA) |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Raffiniertes Öl aus Buglossoides". |
|
|
| Milchprodukte und Milchprodukt-Analoge |
250 mg/100 g |
| 75 mg/100 g bei Getränken |
| Käse und Käseprodukte |
750 mg/100 g |
| Butter sowie andere Fett- und Ölemulsionen einschließlich Streichfetten (nicht zum Kochen oder Braten) |
750 mg/100 g |
| Frühstückscerealien |
625 mg/100 g |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG, ausgenommen solche für Säuglinge und Kleinkinder |
500 mg/Tag |
| Lebensmittel für besondere medizinische Zwecke im Sinne der Verordnung (EU) Nr. 609/2013, ausgenommen Lebensmittel für besondere medizinische Zwecke für Säuglinge und Kleinkinder |
Entsprechend den besonderen Ernährungsbedürfnissen des Personenkreises, für den die Erzeugnisse bestimmt sind |
| Tagesrationen für eine gewichtskontrollierende Ernährung im Sinne der Verordnung (EU) Nr. 609/2013 und Mahlzeitersatz für eine gewichtskontrollierende Ernährung |
250 mg/Mahlzeit |
| Öl ausCalanus finmarchicus
Stand: VO (EU) 2022/966 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
- Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Öl aus Calanus finmarchicus (Krebstier)".
- Die Kennzeichnung vonÖl aus Calanus finmarchicus enthaltenden Nahrungsergänzungsmitteln muss mit dem Hinweis versehen sein, dass diese Nahrungsergänzungsmittel nicht verzehrt werden sollten:
- wenn andere Astaxanthin-Ester enthaltende Nahrungsergänzungsmittel am selben Tag verzehrt werden;
- von Säuglingen und Kindern unter 3 Jahren;
- von Kindern unter 14 Jahren, wenn die Zutat ≥ 0,1 % Astaxanthin enthält.
|
|
|
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG, ausgenommen solche für Säuglinge und Kleinkinder |
1,0 g/Tag (< 0,1 % Astaxanthinester, was < 1,0 mg Astaxanthin pro Tag entspricht) für die allgemeine Bevölkerung, ausgenommen Säuglinge und Kleinkinder
2,3 g/Tag (von 0,1 % auf ≤ 0,25 % Astaxanthin-Ester, was ≤ 5,75 mg Astaxanthin pro Tag entspricht) für die allgemeine Bevölkerung im Alter von über 14 Jahren |
| Calcium-L-Methylfolat
Stand: VO"en (EU) 2022/202; 2021/1318 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte (ausgedrückt als Folsäure) |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Calcium-L-Methylfolat". |
|
|
|
Lebensmittel für besondere medizinische Zwecke und Tagesration für gewichtskontrollierende Ernährung im Sinne der Verordnung (EU) Nr. 609/2013 |
Gemäß der Verordnung (EU) Nr. 609/2013 |
|
Säuglingsanfangsnahrung und Folgenahrung im Sinne der Verordnung (EU) Nr. 609/2013 |
Gemäß der Verordnung (EU) Nr. 609/2013 |
|
Getreidebeikost und andere Beikost für Säuglinge und Kleinkinder im Sinne der Verordnung (EU) Nr. 609/2013 |
Gemäß der Verordnung (EU) Nr. 609/2013 |
|
Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
Gemäß der Richtlinie 2002/46/EG |
|
Gemäß der Verordnung (EG) Nr. 1925/2006 angereicherte Lebensmittel |
Gemäß der Verordnung (EG) Nr. 1925/2006 |
| Calciumfructoborat
Stand: VO (EU) 2021/2129 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
- Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Calciumfructoborat".
- Die Kennzeichnung von Nahrungsergänzungsmitteln, die Calciumfructoborat enthalten, muss den Hinweis enthalten, dass diese Nahrungsergänzungsmittel nicht von Personen unter 18 Jahren und nicht von Schwangeren und Stillenden verzehrt werden sollten.
|
|
Zugelassen am 23. Dezember 2021. Diese Aufnahme erfolgt auf der Grundlage geschützter wissenschaftlicher Erkenntnisse und wissenschaftlicher Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen.
Antragsteller: VDF FutureCeuticals, Inc., 300 West 6th Street Momence, Illinois 60954, Vereinigte Staaten.
Solange der Datenschutz gilt, darf das neuartige Lebensmittel "Calciumfructoborat" nur von VDF FutureCeuticals, Inc. in der Union in Verkehr gebracht werden, es sei denn, ein späterer Antragsteller erhält die Zulassung für das neuartige Lebensmittel ohne Bezugnahme auf die wissenschaftlichen Erkenntnisse oder wissenschaftlichen Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen, oder er hat die Zustimmung von VDF FutureCeuticals, Inc.
Zeitpunkt, zu dem der Datenschutz erlischt: 23. Dezember 2026 |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG für die erwachsene Bevölkerung, ausgenommen Nahrungsergänzungsmittel für Schwangere und Stillende |
220 mg/Tag |
| Kaubase (Monomethoxypolyethylenglycol) |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Kaubase (einschließlich 1,3-Butadien-2-Methylhomopolymer, umgesetzt mit Maleinsäureanhydrid, Ester mit Polyethylenglycolmonomethylether)" oder "Kaubase (einschließlich CAS-Nr. 1246080-53-4)". |
|
|
| Kaugummi |
8 % |
| Kaubase (Methylvinylether/Maleinsäureanhydrid-Copolymer) |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Kaubase (einschließlich Methylvinylether/Maleinsäureanhydrid-Copolymer)" oder "Kaubase (einschließlich CAS-Nr. 9011-16-9)". |
|
|
| Kaugummi |
2 % |
| Getrocknete Nüsse von Canarium indicum L. ("Kanaribaum") (Traditionelles Lebensmittel aus einem Drittland)
Stand: VO (EU) 2023/667 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte (g/100 g) |
- Die Bezeichnung des traditionellen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "getrocknete Kanarinüsse (Canarium indicum)".
- Die Kennzeichnung der Lebensmittel, die getrocknete Nüsse von Canarium indicum L. enthalten, muss mit dem Hinweis versehen sein, dass die Nüsse bei Verbrauchern, die bekanntermaßen gegen Haselnüsse, Kaschunüsse und Pistazien allergisch sind, allergische Reaktionen auslösen können. Dieser Hinweis muss in unmittelbarer Nähe der Zutatenliste oder, falls keine Zutatenliste vorgesehen ist, in unmittelbarer Nähe der Bezeichnung des Lebensmittels angebracht werden.
|
|
|
| Keine Angabe |
|
| Getrocknete Nüsse von Canarium ovatum Engl.
Stand: VO (EU) 2023/267 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
- Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Nüsse von Canarium ovatum" und/oder "Pilinüsse" und/oder "Pili ( Canarium ovatum) -Nüsse".
- Die Kennzeichnung der Lebensmittel, die getrocknete Nüsse von Canarium ovatum Engl. enthalten, muss mit dem Hinweis versehen sein, dass getrocknete Nüsse von Canarium ovatum Engl. bei Verbrauchern, die bekanntermaßen gegen Kaschu- und Walnüsse allergisch sind, allergische Reaktionen auslösen können. Dieser Hinweis muss in unmittelbarer Nähe der Zutatenliste oder, falls keine Zutatenliste vorgesehen ist, in unmittelbarer Nähe der Bezeichnung des Lebensmittels angebracht werden.
|
|
|
| Keine Angabe |
|
| Cellobiose
Stand: VO (EU) 2023/943 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
- Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Cellobiose".
- Die Kennzeichnung von Nahrungsergänzungsmitteln, die Cellobiose enthalten, muss mit dem Hinweis versehen sein, dass diese Nahrungsergänzungsmittel nicht von Säuglingen und Kleinkindern verzehrt werden sollten.
|
|
Zugelassen am 1. Juni 2023. Diese Aufnahme erfolgt auf der Grundlage geschützter wissenschaftlicher Erkenntnisse und wissenschaftlicher Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen.
Antragsteller: SAVANNa Ingredients GmbH, Dürener Straße 67, 50189 Elsdorf, Deutschland. Solange der Datenschutz gilt, darf das neuartige Lebensmittel Cellobiose nur von der SAVANNa Ingredients GmbH in der Union in Verkehr gebracht werden, es sei denn, ein späterer Antragsteller erhält die Zulassung für das neuartige Lebensmittel ohne Bezugnahme auf die geschützten wissenschaftlichen Erkenntnisse oder wissenschaftlichen Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen, oder mit Zustimmung der SAVANNa Ingredients GmbH.
Zeitpunkt, zu dem der Datenschutz erlischt: 1. Juni 2028. |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG für die allgemeine Bevölkerung mit Ausnahme von Säuglingen und Kleinkindern |
3 g/Tag |
| Trockenfleisch, Dosenfleisch, rohes gepökeltes (oder gewürztes) Fleisch oder gegartes gepökeltes (oder gewürztes) Fleisch |
2 g/100 g |
| Frische Rohwurst oder Wurst(teil)konserven |
2 g/100 g |
| Streichfähige Spezialitäten auf Fleischbasis |
2 g/100 g |
| Streichfähige Spezialitäten auf Leberbasis |
2 g/100 g |
| Trockenzubereitungen für Gewürzsoßen |
40 g/100 g |
| Tafelsüßen in Pulverform |
60 g/100 g |
| Tafelsüßen in tablettenform |
60 g/100 g |
| Cetylierte Fettsäuren
Stand: VO (EU) 2022/187 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
- Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Nahrungsergänzungsmittels anzugeben ist, lautet "Zubereitung aus cetylierten Fettsäuren".
- Die Kennzeichnung von Nahrungsergänzungsmitteln, die das neuartige Lebensmittel enthalten, muss den Hinweis tragen, dass diese Nahrungsergänzungsmittel nicht von Personen unter 18 Jahren verzehrt werden sollten.
|
|
Zugelassen am 3. März 2022. Diese Aufnahme erfolgt auf der Grundlage geschützter wissenschaftlicher Erkenntnisse und wissenschaftlicher Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen.
Antragsteller: Pharmanutra S.p.A., Via Delle Lenze 216/b, 56122 Pisa, Italien. Solange der Datenschutz gilt, darf das neuartige Lebensmittel cetylierte Fettsäuren in der Union nur von Pharmanutra S.p.A. in Verkehr gebracht werden, es sei denn, ein späterer Antragsteller erhält die Zulassung für das neuartige Lebensmittel ohne Bezugnahme auf die wissenschaftlichen Erkenntnisse oder wissenschaftlichen Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen, oder er hat die Zustimmung von Pharmanutra S.p.A.
Zeitpunkt, zu dem der Datenschutz erlischt: 3. März 2027. |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG für Erwachsene |
1,6 g/Tag |
| Chiaöl ausSalvia hispanica |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Chiaöl (Salvia hispanica)". |
|
|
| Fette und Öle |
10 % |
| Reines Chiaöl |
2 g/Tag |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
2 g/Tag |
| Chiasamen (Salvia hispanica)
Stand: VO"en (EU) 2021/668; 2020/24 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Chiasamen (Salvia hispanica)". |
|
|
| Broterzeugnisse |
5 % (ganzer oder gemahlener Chiasamen) |
| Backwaren |
10 % ganzer Chiasamen |
| Frühstückscerealien |
10 % ganzer Chiasamen |
| Sterilisierte Fertiggerichte auf der Basis von Getreidekörnern, Pseudogetreidekörnern und/oder Hülsenfrüchten |
5 % ganzer Chiasamen |
| Mischungen aus Früchten, Nüssen und Samen |
|
| Chiasamen als solcher |
|
| Süßwaren (einschließlich Schokolade und Schokoladeerzeugnisse), ausgenommen Kaugummi |
|
| Milchprodukte (einschließlich Joghurt) und Milchprodukt-Analoge |
|
| Speiseeis |
|
| Obst- und Gemüseerzeugnisse (einschließlich Fruchtaufstriche, Kompott mit/ohne Getreide, Fruchtzubereitungen unter Milchprodukten oder zum Vermischen mit Milchprodukten, Fruchtdesserts, gemischte Früchte mit Kokosmilch im Doppelbecher) |
|
| Nichtalkoholische Getränke (einschließlich Fruchtsaft und Frucht-/Gemüsesaftmischungen) |
|
| Puddings, die während der Herstellung, Verarbeitung oder Zubereitung keiner Hitzebehandlung bei oder über 120 °C unterzogen werden müssen |
|
| Chitin-Glucan ausAspergillus niger |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Chitin-Glucan ausAspergillus niger". |
|
|
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
5 g/Tag |
| Chitin-Glucan-Komplex ausFomes fomentarius |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Chitin-Glucan-Komplex ausFomes fomentarius". |
|
|
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
5 g/Tag |
| Chitosanextrakt aus Pilzen (Agaricus bisporus; Aspergillus niger) |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Chitosanextrakt ausAgaricus bisporus" oder "Chitosanextrakt ausAspergillus niger". |
|
|
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
Im Einklang mit der normalen Verwendung von Chitosan aus Krebstieren in Nahrungsergänzungsmitteln |
| Zugelassenes neuartiges Lebensmittel |
Bedingungen, unter denen das neuartige Lebensmittel verwendet werden darf |
zusätzliche spezifische Kennzeichnungsvorschriften |
sonstige Anforderungen |
Datenschutz |
| Chondroitinsulfat |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Chondroitinsulfat, gewonnen durch mikrobielle Fermentation und Sulfatierung". |
|
|
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG für Erwachsene, ausgenommen Schwangere und Stillende |
1.200 mg/Tag |
| Chromhaltige Biomasse der Hefe Yarrowia lipolytica
Stand: VO (EU) 2020/1822 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Chromhaltige Biomasse der Hefe Yarrowia lipolytica".
Die Kennzeichnung von Nahrungsergänzungsmitteln, die chromhaltige Biomasse der Hefe Yarrowia lipolytica enthalten, muss den Hinweis enthalten, dass die Nahrungsergänzungsmittel nicht von Säuglingen und Kleinkindern (Kindern unter 3 Jahren)/Kindern von 3 bis 9 Jahren verzehrt werden sollten1.
____
1) Je nach Altersgruppe, für die das Nahrungsergänzungsmittel bestimmt ist. |
|
|
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG, ausgenommen solche für Säuglinge und Kleinkinder |
2 g/Tag für Kinder von 3 bis 9 Jahren, was 46μg Chrom pro Tag entspricht
4 g/Tag für Kinder ab 10 Jahren, Jugendliche und Erwachsene, was 92μg Chrom pro Tag entspricht |
| Chrompicolinat |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte an Gesamtchrom |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Chrompicolinat". |
|
|
| Lebensmittel im Sinne der Verordnung (EU) Nr. 609/2013 |
250 µg/Tag |
| Gemäß der Verordnung (EG) Nr. 1925/2006 4 angereicherte Lebensmittel |
| Cistus incanus L. Pandalis (Kraut) |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Cistus incanus L. Pandalis (Kraut)". |
|
|
| Kräutertees |
Vorgesehene tägliche Aufnahme: 3 g Kraut/Tag (2 Tassen/Tag) |
| Citicolin |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
1. Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Citicolin".
2. Die Kennzeichnung von Citicolin enthaltenden Lebensmitteln muss den Hinweis tragen, dass das Erzeugnis nicht für den Verzehr durch Kinder bestimmt ist. |
|
|
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
500 mg/Tag |
| Lebensmittel für besondere medizinische Zwecke im Sinne der Verordnung (EU) Nr. 609/2013 |
250 mg pro Portion sowie ein maximaler Verzehr von 1.000 mg pro Tag |
| Clostridium butyricum |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Clostridium butyricum MIYAIRI 588 (CBM 588)" oder "Clostridium butyricum (CBM 588)". |
|
|
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
1,35 × 108 KBE/Tag |
| D-Ribose
Stand: VO (EU) 2019/506 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "D-Ribose".
Die Kennzeichnung von Lebensmitteln, die D-Ribose enthalten, muss mit dem Hinweis versehen sein, dass die Lebensmittel nicht verzehrt werden sollten, wenn am selben Tag auch Nahrungsergänzungsmittel verzehrt werden, die D-Ribose enthalten. |
|
Zugelassen am 16. April 2019. Diese Aufnahme erfolgt auf der Grundlage geschützter wissenschaftlicher Erkenntnisse und wissenschaftlicher Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen.
Antragsteller: Bioenergy Life Science, Inc., 13840 Johnson St. NE, Minneapolis, Minnesota, 55304, Vereinigte Staaten. Solange der Datenschutz gilt, darf das neuartige Lebensmittel "D-Ribose" nur von Bioenergy Life Science, Inc. in der Union in Verkehr gebracht werden, es sei denn, ein späterer Antragsteller erhält die Zulassung für das neuartige Lebensmittel ohne Bezugnahme auf die wissenschaftlichen Erkenntnisse oder wissenschaftlichen Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen, oder er hat die Zustimmung von Bioenergy Life Science, Inc.
Zeitpunkt, zu dem der Datenschutz erlischt: 16. April 2024. |
| Getreideriegel |
0,20 g/100 g |
| Feine Backwaren |
0,31 g/100 g |
| Schokoladenerzeugnisse (ausgenommen Schokoriegel) |
0,17 g/100 g |
| Getränke auf Milchbasis (ausgenommen Malzgetränke und Shakes) |
0,08 g/100 g |
| Getränke zur Deckung des Energiebedarfs bei intensiver Muskelanstrengung, vor allem für Sportler, isotonische Getränke und Energydrinks |
0,80 g/100 g |
| Riegel zur Deckung des Energiebedarfs bei intensiver Muskelanstrengung, vor allem für Sportler |
3,3 g/100 g |
| Mahlzeitersatz für eine gewichtskontrollierende Ernährung (in Getränkeform) |
0,13 g/100 g |
| Mahlzeitersatz für eine gewichtskontrollierende Ernährung (in Riegelform) |
3,30 g/100 g |
| Süßwaren |
0,20 g/100 g |
| Tees und Kräutertees (als Pulver zur Zubereitung) |
0,23 g/100 g |
| Extrakt aus entfettetem Kakaopulver |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Verbraucher sind dazu anzuhalten, nicht mehr als 600 mg Polyphenole pro Tag zu verzehren, was 1,1 g Extrakt aus fettfreiem Kakaopulver entspricht. |
|
|
| Getreideriegel |
1 g/Tag und 300 mg Polyphenole, was höchstens 550 mg Extrakt aus fettfreiem Kakaopulver in einer Portion Lebensmittel (oder Nahrungsergänzungsmittel) entspricht. |
| Getränke auf Milchbasis |
| Sonstige Lebensmittel (einschließlich Nahrungsergänzungsmitteln im Sinne der Richtlinie 2002/46/EG), die sich als Träger für funktionale Inhaltsstoffe bewährt haben und typischerweise für den Verzehr durch gesundheitsbewusste Erwachsene angeboten werden. |
| Kakaoextrakt mit geringem Fettanteil |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Verbraucher sind dazu anzuhalten, nicht mehr als 600 mg Kakaoflavanole pro Tag zu verzehren. |
|
|
| Lebensmittel einschließlich Nahrungsergänzungsmitteln im Sinne der Richtlinie 2002/46/EG |
730 mg pro Portion und ca. 1,2 g/Tag |
| Koriandersamenöl ausCoriandrum sativum |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Koriandersamenöl". |
|
|
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
600 mg/Tag |
| Pulver aus Cranberry-Extrakt |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Pulver aus Cranberry-Extrakt". |
|
Zugelassen am 20. November 2018. Diese Aufnahme erfolgt auf der Grundlage geschützter wissenschaftlicher Erkenntnisse und wissenschaftlicher Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen.
Antragsteller: Ocean Spray Cranberries Inc., One Ocean Spray Drive Lakeville-middleboro, MA, 02349, USA.
Solange der Datenschutz gilt, darf das neuartige Lebensmittel "Pulver aus Cranberry-Extrakt" nur von Ocean Spray Cranberries Inc. in der Union in Verkehr gebracht werden, es sei denn, ein späterer Antragsteller erhält die Zulassung für das neuartige Lebensmittel ohne Bezugnahme auf die wissenschaftlichen Erkenntnisse oder wissenschaftlichen Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen, oder er hat die Zustimmung von Ocean Spray Cranberries Inc.
Zeitpunkt, zu dem der Datenschutz erlischt: 20. November 2023. |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG für die erwachsene Bevölkerung |
350 mg/Tag |
| Getrocknete Früchte vonCrataegus pinnatifida |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Getrocknete Früchte vonCrataegus pinnatifida". |
|
|
| Kräutertees |
Im Einklang mit der normalen Verwendung vonCrataegus laevigata als Lebensmittel |
| Konfitüren und Gelees im Sinne der Richtlinie 2001/113/EG 5 |
| Kompott |
| α-Cyclodextrin |
Keine Angabe |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Alpha-Cyclodextrin" oder "α-Cyclodextrin". |
|
|
| γ-Cyclodextrin |
Keine Angabe |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Gamma-Cyclodextrin" oder "γ-Cyclodextrin". |
|
|
| Geschälte Körner vonDigitaria exilis(Kippist) Stapf
(Traditionelles Lebensmittel aus einem Drittland)
Stand: VO (EU) 2018/2016 |
Keine Angabe |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Geschälte Fonio-Körner (Digitaria exilis)" |
|
|
|
| Dextranzubereitung, hergestellt mithilfe vonLeuconostoc mesenteroides |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Dextran". |
|
|
| Backwaren |
5 % |
| Diacylglyceridöl pflanzlichen Ursprungs |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Diacylglyceridöl pflanzlichen Ursprungs (mindestens 80 % Diacylglyceride)". |
|
|
| Bratöle |
|
| Streichfette |
| Salatsoßen |
| Mayonnaise |
| Mahlzeitersatz für eine gewichtskontrollierende Ernährung (in Getränkeform) |
| Backwaren |
| Joghurtartige Erzeugnisse |
| Dihydrocapsiat (DHC) |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
- Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Dihydrocapsiat".
- Nahrungsergänzungsmittel, die synthetisches Dihydrocapsiat enthalten, werden auf dem Etikett als "nicht für Kinder unter viereinhalb Jahren geeignet" ausgewiesen.
|
|
|
| Getreideriegel |
9 mg/100 g |
| Kekse und Kräcker |
9 mg/100 g |
| Knabberartikel auf Reisbasis |
12 mg/100 g |
| Kohlensäurehaltige Getränke, verdünnbare Getränke, Getränke auf Fruchtsaftbasis |
1,5 mg/100 ml |
| Gemüsegetränke |
2 mg/100 ml |
| Getränke auf Kaffeebasis, Getränke auf Teebasis |
1,5 mg/100 ml |
| Aromatisiertes Wasser - ohne Kohlensäure |
1 mg/100 ml |
| Wärmebehandelte Haferflocken-Cerealien |
2,5 mg/100 g |
| Andere Cerealien |
4,5 mg/100 g |
| Speiseeis und gefrorene Desserts auf Milchbasis |
4 mg/100 g |
| Puddingmischungen (verzehrfertig) |
2 mg/100 g |
| Erzeugnisse auf Joghurtbasis |
2 mg/100 g |
| Schokoladenerzeugnisse |
7,5 mg/100 g |
| Bonbons |
27 mg/100 g |
| Zuckerfreie Kaugummis |
115 mg/100 g |
| Kaffeeweißer |
40 mg/100 g |
| Süßungsmittel |
200 mg/100 g |
| Suppe (verzehrfertig) |
1,1 mg/100 g |
| Salatsoßen |
16 mg/100 g |
| Pflanzliches Protein |
5 mg/100 g |
| Genussfertige Mahlzeiten |
3 mg/Mahlzeit |
| Mahlzeitersatz für eine gewichtskontrollierende Ernährung |
3 mg/Mahlzeit |
| Mahlzeitersatz für eine gewichtskontrollierende Ernährung (in Getränkeform) |
1 mg/100 ml |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
3 mg/Einzelaufnahme
9 mg/Tag |
| Nichtalkoholische Getränkemischungen in Pulverform |
14,5 mg/kg äquivalent mit 1,5 mg/100 ml |
| Getrocknete oberirdische Teile vonHoodia parviflora |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Getrocknete oberirdische Teile vonHoodia parviflora". |
|
Zugelassen am 3. September 2018. Diese Aufnahme erfolgt auf der Grundlage geschützter wissenschaftlicher Erkenntnisse und wissenschaftlicher Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen.
Antragsteller: Desert Labs Ltd. Kibbutz Yotvata, 88820 Israel.
Solange der Datenschutz gilt, darf das neuartige Lebensmittel "Getrocknete oberirdische Teile vonHoodia parviflora" nur von Desert Labs, Ltd. in der Union in Verkehr gebracht werden, es sei denn, ein späterer Antragsteller erhält die Zulassung für das neuartige Lebensmittel ohne Bezugnahme auf die wissenschaftlichen Erkenntnisse oder wissenschaftlichen Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen, oder er hat die Zustimmung von Desert Labs, Ltd.
Zeitpunkt, zu dem der Datenschutz erlischt: 3. September 2023. |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG für die erwachsene Bevölkerung |
9,4 mg/Tag |
| Getrockneter Extrakt vonLippia citriodora aus Zellkulturen |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Getrockneter Extrakt vonLippia citriodora aus HTN®Vb-Zellkulturen". |
|
|
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
Im Einklang mit der normalen Verwendung eines vergleichbaren Extrakts aus den Blättern vonLippia citriodora in Nahrungsergänzungsmitteln |
| Extrakt vonEchinacea angustifolia aus Zellkulturen |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
|
|
|
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
Im Einklang mit der normalen Verwendung eines vergleichbaren Extrakts aus der Wurzel vonEchinacea angustifolia in Nahrungsergänzungsmitteln |
| Extrakt vonEchinacea purpurea aus Zellkulturen |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Getrockneter Extrakt von Echinacea purpurea aus EchiPure-PC™-Zellkulturen" |
|
|
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
Im Einklang mit der normalen Verwendung eines vergleichbaren Extrakts aus den Einzelblüten des Blütenkopfes von Echinacea purpurea in Nahrungsergänzungsmitteln |
| Öl ausEchium plantagineum |
Spezifizierte Lebensmittelkategorie |
Höchstgehalt an Stearidonsäure (STA) |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Raffiniertes Echium-Öl". |
|
|
| Erzeugnisse auf Milchbasis und Trinkjoghurts, angeboten in Einzelportionen |
250 mg/100 g; 75 mg/100 g für Getränke |
| Käsezubereitungen |
750 mg/100 g |
| Streichfette und Salatsoßen |
750 mg/100 g |
| Frühstückscerealien |
625 mg/100 g |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
500 mg/Tag |
| Lebensmittel für besondere medizinische Zwecke im Sinne der Verordnung (EU) Nr. 609/2013 |
Entsprechend den besonderen Ernährungsbedürfnissen des Personenkreises, für den die Produkte bestimmt sind |
| Tagesrationen für eine gewichtskontrollierende Ernährung im Sinne der Verordnung (EU) Nr. 609/2013 und Mahlzeitersatz für eine gewichtskontrollierende Ernährung |
250 mg/Mahlzeit |
| Phlorotannine ausEcklonia cava
Stand: VO (EU) 2020/1559 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Phlorotannine ausEcklonia cava".
Auf Nahrungsergänzungsmitteln, die Phlorotannine ausEcklonia cava enthalten, sind folgende Angaben zu machen:
- Dieses Nahrungsergänzungsmittel sollte nicht von Kindern/Jugendlichen unter 12/14/18 * Jahren verzehrt werden.
- Dieses Nahrungsergänzungsmittel sollte nicht von Personen mit einer Schilddrüsenerkrankung oder von Personen verzehrt werden, bei denen das Risiko einer Schilddrüsenerkrankung bekannt ist oder festgestellt wurde.
- Dieses Nahrungsergänzungsmittel sollte nicht verzehrt werden, wenn gleichzeitig andere jodhaltige Nahrungsergänzungsmittel verzehrt werden.
___
*) Je nach Altersgruppe, für die das Nahrungsergänzungsmittel bestimmt ist. |
|
|
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG für die allgemeine Bevölkerung, ausgenommen Kinder unter 12 Jahren |
163 mg/Tag für Jugendliche von 12 bis 14 Jahren;
230 mg/Tag für Jugendliche über 14 Jahren;
263 mg/Tag für Erwachsene |
| Eimembran-Hydrolysat |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Eimembran-Hydrolysat" |
|
Zugelassen am 25. November 2018. Diese Aufnahme erfolgt auf der Grundlage geschützter wissenschaftlicher Erkenntnisse und wissenschaftlicher Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen.
Antragsteller: Biova, LLC., 5800 Merle Hay Rd, Suite 14 PO Box 394 Johnston 50131, Iowa USA. Solange der Datenschutz gilt, darf das neuartige Lebensmittel "Eimembran-Hydrolysat" nur von Biova, LLC in der Union in Verkehr gebracht werden, es sei denn, ein späterer Antragsteller erhält die Zulassung für das neuartige Lebensmittel ohne Bezugnahme auf die wissenschaftlichen Erkenntnisse oder wissenschaftlichen Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen, oder er hat die Zustimmung von Biova, LLC.
Zeitpunkt, zu dem der Datenschutz erlischt: 25. November 2023. |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG für die allgemeine erwachsene Bevölkerung |
450 mg/Tag |
| Epigallocatechingallat als gereinigter Extrakt aus Blättern von grünem Tee (Camellia sinensis) |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Kennzeichnung muss den Hinweis tragen, dass die Verbraucher nicht mehr als 300 mg Extrakt pro Tag verzehren sollten. |
|
|
| Lebensmittel einschließlich Nahrungsergänzungsmitteln im Sinne der Richtlinie 2002/46/EG |
150 mg Extrakt in einer Portion Lebensmittel oder Nahrungsergänzungsmittel |
| L-Ergothionein
Stand: VO (EU) 2020/1559 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "L-Ergothionein". |
|
|
| Alkoholfreie Getränke |
0,025 g/kg |
| Getränke auf Milchbasis |
0,025 g/kg |
| Frischmilcherzeugnisse * |
0,040 g/kg |
| Getreideriegel |
0,2 g/kg |
| Schokoladenerzeugnisse |
0,25 g/kg |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
30 mg/Tag für die allgemeine Bevölkerung (ausgenommen Schwangere und Stillende)
20 mg/Tag für Kinder über 3 Jahren |
| *) Bei Verwendung in Milcherzeugnissen darf L-Ergothionein keinen der Milchbestandteile vollständig oder teilweise ersetzen. |
| Getrocknete Zellen von Euglena gracilis
Stand: VO (EU) 2020/1820 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Getrocknete Biomasse der Alge Euglena gracilis".
Die Kennzeichnung von Nahrungsergänzungsmitteln, die getrocknete Biomasse von Euglena gracilis enthalten, muss mit dem Hinweis versehen sein, dass solche Nahrungsergänzungsmittel nicht von Säuglingen/Kindern unter 3 Jahren/Kindern unter 10 Jahren/Kindern und Jugendlichen unter 18 Jahren verzehrt werden sollten1.
___
1) Je nach Altersgruppe, für die das Nahrungsergänzungsmittel bestimmt ist. |
|
Zugelassen am 23. Dezember 2020. Diese Aufnahme erfolgt auf der Grundlage geschützter wissenschaftlicher Erkenntnisse und wissenschaftlicher Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen.
Antragsteller: Kemin Foods L.C., 2100 Maury Street Des Moines, Ia 50317, USA.
Solange der Datenschutz gilt, darf das neuartige Lebensmittel nur von Kemin Foods L.C. in der Union in Verkehr gebracht werden, es sei denn, ein späterer Antragsteller erhält die Zulassung für das neuartige Lebensmittel ohne Bezugnahme auf die wissenschaftlichen Erkenntnisse oder wissenschaftlichen Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen, oder er hat die Zustimmung von Kemin Foods L.C.
Zeitpunkt, zu dem der Datenschutz erlischt: 23. Dezember 2025. |
| Frühstücksgetreideriegel, Müsliriegel und Proteinriegel |
630 mg/100 g |
| Joghurt |
150 mg/100 g |
| Joghurtgetränke |
95 mg/100 g |
| Frucht- und Gemüsesäfte, Frucht- und Gemüsenektare, Frucht-/Gemüsesaftmischungen |
120 mg/100 g |
| Getränke mit Fruchtgeschmack |
40 mg/100 g |
| Getränke als Mahlzeitersatz |
75 mg/100 g |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG, ausgenommen Nahrungsergänzungsmittel für Säuglinge |
100 mg/Tag für Kleinkinder
150 mg/Tag für Kinder im Alter von 3 bis 9 Jahren
225 mg/Tag für Kinder ab 10 Jahren und für Jugendliche (bis 17 Jahre)
375 mg/Tag für Erwachsene |
| Tagesrationen für gewichtskontrollierende Ernährung im Sinne der Verordnung (EU) Nr. 609/2013 |
190 mg/Mahlzeit |
| Extrakt aus drei pflanzlichen Wurzeln (Cynanchum wilfordiiHemsley,Phlomis umbrosaTurcz. undAngelica gigas Nakai)
Stand: VO (EU) 2020/1559 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Extrakt aus drei pflanzlichen Wurzeln (Cynanchum wilfordii Hemsley,Phlomis umbrosaTurcz. undAngelica gigasNakai)".
Die Kennzeichnung von Nahrungsergänzungsmitteln, die den Extrakt aus einer Mischung der drei pflanzlichen Wurzeln enthalten, muss eine in unmittelbarer Nähe der Zutatenliste angebrachte Erklärung enthalten, aus der hervorgeht, dass die betreffenden Nahrungsergänzungsmittel nicht von Personen mit bekannter Sellerieallergie verzehrt werden sollten. |
|
|
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG für die erwachsene Bevölkerung |
175 mg/Tag |
| Eisen(III)-Natrium-EDTA |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte (ausgedrückt als wasserfreies EDTA) |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Eisen(III)-Natrium-EDTA". |
|
|
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
18 mg/Tag für Kinder
75 mg/Tag für Erwachsene |
| Lebensmittel im Sinne der Verordnung (EU) Nr. 609/2013 |
12 mg/100 g |
| Gemäß der Verordnung (EG) Nr. 1925/2006 angereicherte Lebensmittel |
| Eisen(II)-Ammoniumphosphat |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Eisen(II)-Ammoniumphosphat". |
|
|
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
Im Einklang mit der Richtlinie 2002/46/EG, der Verordnung (EU) Nr. 609/2013 und/oder der Verordnung (EG) Nr. 1925/2006 zu verwenden |
| Lebensmittel im Sinne der Verordnung (EU) Nr. 609/2013 |
| Gemäß der Verordnung (EG) Nr. 1925/2006 angereicherte Lebensmittel |
| Eisenhydroxid-Adipat-Tartrat
Stand: VO (EU) 2022/1373 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Eisenhydroxid-Adipat-Tartrat (Nano)".
Die Kennzeichnung von Nahrungsergänzungsmitteln, die Eisenhydroxid-Adipat-Tartrat enthalten, muss mit dem Hinweis versehen sein, dass diese nicht von Kindern und Jugendlichen unter 18 Jahren/Kindern unter 4 Jahren * verzehrt werden sollten.
____
*) Je nach der Altersgruppe, für die das Nahrungsergänzungsmittel bestimmt ist.
|
|
Zugelassen am 28.8.2022. Diese Aufnahme erfolgt auf der Grundlage geschützter wissenschaftlicher Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen.
Antragsteller: Nemysis Limited, Suite 4.01 Ormond Building, 31-36 Ormond Quay Upper, Arran Quay, Dublin 7, D07 F6DC, Dublin, Irland. Solange der Datenschutz gilt, darf das neuartige Lebensmittel "Eisenhydroxid-Adipat-Tartrat" nur von Nemysis Limited in der Union in Verkehr gebracht werden, es sei denn, ein späterer Antragsteller erhält die Zulassung für das neuartige Lebensmittel ohne Bezugnahme auf die wissenschaftlichen Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen, oder er hat die Zustimmung von Nemysis Limited.Zeitpunkt, zu dem der Datenschutz erlischt: 28.8.2027 |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG für Erwachsene |
≤ 100 mg/Tag (≤ 30 mg Fe/Tag) |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG für Kinder und Jugendliche unter 18 Jahren, ausgenommen Kinder unter 4 Jahren |
≤ 50 mg/Tag (≤ 14 mg Fe/Tag) |
| Zugelassenes neuartiges Lebensmittel |
Bedingungen, unter denen das neuartige Lebensmittel verwendet werden darf |
zusätzliche spezifische Kennzeichnungsvorschriften |
sonstige Anforderungen |
Datenschutz |
| Glucosamin HCl |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
|
|
|
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
Im Einklang mit der normalen Verwendung von Glucosamin aus Schalentieren |
| Lebensmittel im Sinne der Verordnung (EU) Nr. 609/2013 |
|
| Mahlzeitersatz für eine gewichtskontrollierende Ernährung |
| Lebensmittel zur Deckung des Energiebedarfs bei intensiver Muskelanstrengung, vor allem für Sportler |
| Lebensmittel mit Angaben über das Nichtvorhandensein oder das reduzierte Vorhandensein von Gluten gemäß den Anforderungen der Durchführungsverordnung (EU) Nr. 828/2014 der Kommission |
| Glucosaminsulfat KCl |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
|
|
|
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
Im Einklang mit der normalen Verwendung von Glucosamin aus Schalentieren |
| Glucosaminsulfat NaCl |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
|
|
|
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
Im Einklang mit der normalen Verwendung von Glucosamin aus Schalentieren |
| Guarkernmehl |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
- Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Guarkernmehl".
- Auf den Etiketten von Lebensmitteln, die Guarkernmehl enthalten, ist ein sichtbarer Hinweis auf das mögliche Risiko von Verdauungsbeschwerden in Verbindung mit der Exposition von Kindern unter 8 Jahren anzubringen.
Beispiel: "Ein übermäßiger Verzehr dieser Produkte kann zu Verdauungsbeschwerden führen, insbesondere bei Kindern unter 8 Jahren."
- Bei Milchprodukten mit Cerealien in Zweikammer-Verpackung muss die Gebrauchsanleitung einen sichtbaren Hinweis darauf enthalten, dass die Getreideflocken vor dem Verzehr mit dem Milchprodukt zu mischen sind, um dem eventuellen Risiko einer Magen-Darm-Obstruktion Rechnung zu tragen.
|
|
|
| Frische Milchprodukte wie Joghurt, fermentierte Milch, Frischkäse und andere Dessertspeisen auf Milchbasis |
1,5 g/100 g |
| Flüssige Lebensmittel aus Obst oder Gemüse (wie Smoothies) |
1,8 g/100 g |
| Kompott aus Obst oder Gemüse |
3,25 g/100 g |
| Cerealien in Verbindung mit Milchprodukten in Zweikammer-Verpackung |
10 g/100 g in den Getreideflocken
Nichts im Milchprodukt
1 g/100 g im verzehrfertigen Produkt |
| MitBacteroides xylanisolvensfermentierte wärmebehandelte Milchprodukte |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
|
|
|
| Fermentierte Milchprodukte (in flüssiger, halbflüssiger und sprühgetrockneter Form). |
|
| Hydroxytyrosol |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittelprodukts anzugeben ist, lautet "Hydroxytyrosol".
In der Kennzeichnung der Hydroxytyrosol enthaltenden Lebensmittelprodukte sind folgende Angaben zu machen:
- "Dieses Lebensmittelprodukt sollte nicht von Kindern unter drei Jahren, Schwangeren und Stillenden verzehrt werden.
- Dieses Lebensmittelprodukt sollte nicht zum Kochen, Backen oder Braten verwendet werden".
|
|
|
| Fisch- und Pflanzenöle (ausgenommen Olivenöl und Oliventresteröl im Sinne des Anhangs VII Teil VIII der Verordnung (EU) Nr. 1308/2013 6), die als solche in Verkehr gebracht werden |
0,215 g/kg |
| Streichfette im Sinne des Anhangs VII Teil VII der Verordnung (EU) Nr. 1308/2013, die als solche in Verkehr gebracht werden |
0,175 g/kg |
| Eis-strukturierendes Protein Typ III HPLC 12 (ISP) |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Eis-strukturierendes Protein". |
|
|
| Speiseeis |
0,01 % |
| Wässrige Auszüge aus getrockneten Blättern vonIlex guayusa |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Auszüge aus getrockneten Blättern vonIlex guayusa". |
|
|
| Kräutertees |
Im Einklang mit der normalen Verwendung eines vergleichbaren wässrigen Extrakts aus den getrockneten Blättern von Ilex paraguariensis in Kräutertees und Nahrungsergänzungsmitteln |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
Aufguss aus Kaffeeblättern der Arten Coffea arabica L. und/oder Coffea canephora Pierre ex A. Froehner
(Traditionelles Lebensmittel aus einem Drittland)
Stand: VO "en (EU) 2023/931; 2020/917 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Aufguss aus Kaffeeblättern" oder "Getrockneter Aufguss aus Kaffeeblättern", je nach der Form, in der das Erzeugnis in Verkehr gebracht wird. |
|
|
| Aufguss aus Kaffeeblättern der Arten Coffea arabica L. und/oder Coffea canephora Pierre ex A. Froehner, als solcher in Verkehr gebracht |
|
| Aromatisierte und nicht aromatisierte nichtalkoholische trinkfertige Getränke 11 |
|
| Kaffee, Kaffee- und Zichorienextrakte, Instant-Kaffee, Tee, Kräuter- und Früchtetees, Kaffeemittel, Kaffeemischungen und Instant-Mischungen für Getränke (und ihre aromatisierten Entsprechungen) 11 |
|
| Getrocknete Pulpe der Kaffeekirsche der Arten Coffea arabica L. und/oder Coffea canephora Pierre ex A. Froehner sowie der Aufguss daraus (traditionelles Lebensmittel aus einem Drittland) |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Pulpe der Kaffeekirsche" und/oder "Cascara (Pulpe der Kaffeekirsche)", und/oder "Aufguss aus der Pulpe der Kaffeekirsche" und/oder "getrockneter Aufguss aus der Pulpe der Kaffeekirsche".
Übersteigt der Koffeingehalt des Erzeugnisses, welches das neuartige Lebensmittel enthält, 150 mg/l (an sich oder nach Rekonstitution), so ist die Kennzeichnung mit folgendem Hinweis zu versehen: "Hoher Koffeingehalt. Nicht empfohlen für Kinder, Schwangere und Stillende" im selben Sichtfeld wie die Bezeichnung des Lebensmittels, gefolgt vom Koffeingehalt, ausgedrückt in mg je 100 ml.
Typische Aufgusszubereitungen werden mit bis zu 6 g Pulpe der Kaffeekirsche je 100 ml heißes Wasser (> 75 °C) zubereitet. Für die Pulpe der Kaffeekirsche, die als solche zur Zubereitung von Aufgüssen in Verkehr gebracht wird, ist den Verbrauchern eine Anleitung zur Zubereitung zu geben. |
|
|
| Pulpe der Kaffeekirsche der Arten Coffea arabica L. und/oder Coffea canephora Pierre ex A. Froehner zur Zubereitung von Aufgüssen |
|
| Kaffee, Kaffee- und Zichorienextrakte, Instant-Kaffee, Tee, Kräuter- und Früchtetees, Kaffeemittel, Kaffeemischungen und Instant-Mischungen für heiße Getränke (und ihre aromatisierten Entsprechungen). |
|
| Aromatisierte und nicht aromatisierte nichtalkoholische trinkfertige Getränke |
|
| Isomalto-Oligosaccharid |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
- Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Isomalto-Oligosaccharid".
- Lebensmittel, die die neuartige Lebensmittelzutat enthalten, müssen als "Quelle von Glucose" ausgewiesen werden.
|
|
|
| Brennwertverminderte alkoholfreie Getränke |
6,5 % |
| Energydrinks |
5,0 % |
| Lebensmittel zur Deckung des Energiebedarfs bei intensiver Muskelanstrengung, vor allem für Sportler (einschließlich isotonischer Getränke) |
6,5 % |
| Fruchtsäfte |
5 % |
| Verarbeitetes Gemüse und Gemüsesäfte |
5 % |
| Andere alkoholfreie Getränke |
5 % |
| Getreideriegel |
10 % |
| Kekse und ähnliches Kleingebäck |
20 % |
| Frühstücksgetreideriegel |
25 % |
| Bonbons |
97 % |
| Kaubonbons/Schokoriegel |
25 % |
| Mahlzeitersatz für eine gewichtskontrollierende Ernährung (als Riegel oder auf Milchbasis) |
20 % |
| Isomaltulose |
Keine Angabe |
- Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Isomaltulose".
- Zusätzlich zu der Bezeichnung des neuartigen Lebensmittels ist in der Kennzeichnung der Hinweis anzubringen "Isomaltulose ist eine Glucose- und Fructosequelle".
|
|
|
| Kerne von Jatropha curcas L. (essbare Art)
Stand: VO (EU) 2022/965 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte (g/100 g) |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Kerne von essbarer Jatropha curcas L." |
|
Zugelassen am 12. Juli 2022. Diese Aufnahme erfolgt auf der Grundlage geschützter wissenschaftlicher Erkenntnisse und wissenschaftlicher Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen.
Antragsteller: "JatroSolutions GmbH", Echterdinger Straße 30, 70599 Stuttgart, Deutschland. Solange der Datenschutz gilt, darf das neuartige Lebensmittel, Kerne der essbaren Art von Jatropha curcas L., nur von der JatroSolutions GmbH in der Union in Verkehr gebracht werden, es sei denn, ein späterer Antragsteller erhält die Zulassung für das neuartige Lebensmittel ohne Bezugnahme auf die wissenschaftlichen Erkenntnisse oder wissenschaftlichen Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen, oder er hat die Zustimmung von der JatroSolutions GmbH.
Zeitpunkt, zu dem der Datenschutz erlischt: 12. Juli 2027 |
| Unbehandelte Kerne, kandiert oder durch Zucker haltbar gemacht und als verarbeitete Nüsse |
|
| Getreideriegel |
5 |
| Frühstückscerealien |
5 |
| Getrocknete Früchte |
5 |
|
| Wässriger ethanolischer Extrakt aus Labisia pumila
Stand: VO (EU) 2023/972 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
- Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "wässriger ethanolischer Extrakt aus Labisia pumila".
- Die Kennzeichnung von Nahrungsergänzungsmitteln, die das neuartige Lebensmittel enthalten, muss mit dem Hinweis versehen sein, dass sie nur von Personen über 18 Jahren mit Ausnahme schwangerer und stillender Frauen verzehrt werden sollten.
|
|
Zugelassen am 6. Juni 2023. Diese Aufnahme erfolgt auf der Grundlage geschützter wissenschaftlicher Erkenntnisse und wissenschaftlicher Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen.
Antragsteller: Medika Natura Sdn. Bhd., No. 44B Jalan Bola Tampar, 13/14, Section 13, 40100 Shah Alam, Selangor, Malaysia. Solange der Datenschutz gilt, darf das neuartige Lebensmittel "wässriger ethanolischer Extrakt aus Labisia pumila" nur von Medika Natura Sdn. Bhd. in der Union in Verkehr gebracht werden, es sei denn, ein späterer Antragsteller erhält die Zulassung für das neuartige Lebensmittel ohne Bezugnahme auf die geschützten wissenschaftlichen Erkenntnisse oder wissenschaftlichen Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen, oder mit Zustimmung von Medika Natura Sdn. Bhd.
Zeitpunkt, zu dem der Datenschutz erlischt: 6. Juni 2028. |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG für Erwachsene, ausgenommen Schwangere und Stillende |
350 mg/Tag |
| Lactit
Stand: VO (EU) 2018/1293 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Nahrungsergänzungsmittels anzugeben ist, lautet "Lactit". |
|
|
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG (Kapseln, tabletten oder Pulver) für Erwachsene |
20 g/Tag |
| Beta-Lactoglobulin (ß-Lactoglobulin) aus Kuhmilch
Stand: VO (EU) 2022/2534 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte (g neuartiges Lebensmittel/100 ml) |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Beta-Lactoglobulin aus Kuhmilch" oder "ß-Lactoglobulin aus Kuhmilch". |
|
Zugelassen am 11. Januar 2023. Diese Aufnahme erfolgt auf der Grundlage geschützter wissenschaftlicher Erkenntnisse und wissenschaftlicher Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen.
Antragsteller: Arla Foods Ingredients Group P/S, Sønderhøj 10-12, 8260 Viby J, Dänemark. Solange der Datenschutz gilt, darf das neuartige Lebensmittel Beta-Lactoglobulin (ß-Lactoglobulin) aus Kuhmilch nur von Arla Foods Ingredients Group P/S in der Union in Verkehr gebracht werden, es sei denn, ein späterer Antragsteller erhält die Zulassung für das neuartige Lebensmittel ohne Bezugnahme auf die wissenschaftlichen Erkenntnisse oder wissenschaftlichen Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen, oder er hat die Zustimmung von Arla Foods Ingredients Group P/S.
Zeitpunkt, zu dem der Datenschutz erlischt: 11. Januar 2028. |
| Erfrischungsgetränke, die im Zusammenhang mit körperlicher Betätigung vermarktet werden |
25 |
| Molkenpulver (rekonstituiert) |
8 |
| Getränke auf Milchbasis und ähnliche Erzeugnisse |
12 |
| Lebensmittel für besondere medizinische Zwecke im Sinne der Verordnung (EU) Nr. 609/2013, die für die allgemeine Bevölkerung über drei Jahren, ausgenommen Schwangere und Stillende, bestimmt sind |
Entsprechend den besonderen Ernährungsbedürfnissen des Personenkreises, für den die Produkte bestimmt sind |
| Zugelassenes neuartiges Lebensmittel |
Bedingungen, unter denen das neuartige Lebensmittel verwendet werden darf |
Zusätzliche spezifische Kennzeichnungsvorschriften |
Sonstige Anforderungen |
Datenschutz |
| Beeren vonLonicera caerulea L. (Haskap) (Traditionelles Lebensmittel aus einem Drittland)
Stand: VO (EU) 2018/1991 |
Keine Angabe |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Haskap-Beeren" (Lonicera caerulea). |
|
|
| Extrakt aus den Blättern der Luzerne (Medicago sativa) |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Eiweiß aus der Luzerne (Medicago sativa)" oder "Eiweiß aus Alfalfa (Medicago sativa)". |
|
|
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
10 g/Tag |
| Lycopin |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Lycopin". |
|
|
| Getränke auf Frucht-/Gemüsesaftbasis (einschließlich Konzentraten) |
2,5 mg/100 g |
| Getränke zur Deckung des Energiebedarfs bei intensiver Muskelanstrengung, vor allem für Sportler |
2,5 mg/100 g |
| Tagesrationen für eine gewichtskontrollierende Ernährung im Sinne der Verordnung (EU) Nr. 609/2013 und Mahlzeitersatz für eine gewichtskontrollierende Ernährung |
8 mg/Mahlzeit |
| Frühstückscerealien |
5 mg/100 g |
| Fette und Salatsoßen |
10 mg/100 g |
| Suppen außer Tomatensuppen |
1 mg/100 g |
| Brot (einschließlich Knäckebrot) |
3 mg/100 g |
| Lebensmittel für besondere medizinische Zwecke im Sinne der Verordnung (EU) Nr. 609/2013 |
Entsprechend den besonderen Ernährungsbedürfnissen des Personenkreises, für den die Erzeugnisse bestimmt sind |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
15 mg/Tag |
| Lycopin ausBlakeslea trispora |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Lycopin". |
|
|
| Getränke auf Frucht-/Gemüsesaftbasis (einschließlich Konzentraten) |
2,5 mg/100 g |
| Getränke zur Deckung des Energiebedarfs bei intensiver Muskelanstrengung, vor allem für Sportler |
2.5 mg/100 g |
| Tagesrationen für eine gewichtskontrollierende Ernährung im Sinne der Verordnung (EU) Nr. 609/2013 und Mahlzeitersatz für eine gewichtskontrollierende Ernährung |
8 mg/Mahlzeit |
| Frühstückscerealien |
5 mg/100 g |
| Fette und Salatsoßen |
10 mg/100 g |
| Suppen außer Tomatensuppen |
1 mg/100 g |
| Brot (einschließlich Knäckebrot) |
3 mg/100 g |
| Lebensmittel für besondere medizinische Zwecke im Sinne der Verordnung (EU) Nr. 609/2013 |
Entsprechend den besonderen Ernährungsbedürfnissen des Personenkreises, für den die Erzeugnisse bestimmt sind |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
15 mg/Tag |
| Lycopin aus Tomaten |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Lycopin". |
|
|
| Getränke auf Frucht-/Gemüsesaftbasis (einschließlich Konzentraten) |
2,5 mg/100 g |
| Getränke zur Deckung des Energiebedarfs bei intensiver Muskelanstrengung, vor allem für Sportler |
2,5 mg/100 g |
| Tagesrationen für eine gewichtskontrollierende Ernährung im Sinne der Verordnung (EU) Nr. 609/2013 und Mahlzeitersatz für eine gewichtskontrollierende Ernährung |
8 mg/Mahlzeit |
| Frühstückscerealien |
5 mg/100 g |
| Fette und Salatsoßen |
10 mg/100 g |
| Suppen außer Tomatensuppen |
1 mg/100 g |
| Brot (einschließlich Knäckebrot) |
3 mg/100 g |
| Lebensmittel für besondere medizinische Zwecke im Sinne der Verordnung (EU) Nr. 609/2013 |
Entsprechend den besonderen Ernährungsbedürfnissen des Personenkreises, für den die Erzeugnisse bestimmt sind |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
15 mg/Tag |
| Lycopin-Oleoresin aus Tomaten |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte an Lycopin |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Lycopin-Oleoresin aus Tomaten". |
|
|
| Getränke auf Frucht-/Gemüsesaftbasis (einschließlich Konzentraten) |
2,5 mg/100 g |
| Getränke zur Deckung des Energiebedarfs bei intensiver Muskelanstrengung, vor allem für Sportler |
2,5 mg/100 g |
| Tagesrationen für eine gewichtskontrollierende Ernährung im Sinne der Verordnung (EU) Nr. 609/2013 und Mahlzeitersatz für eine gewichtskontrollierende Ernährung |
8 mg/Mahlzeit |
| Frühstückscerealien |
5 mg/100 g |
| Fette und Salatsoßen |
10 mg/100 g |
| Suppen außer Tomatensuppen |
1 mg/100 g |
| Brot (einschließlich Knäckebrot) |
3 mg/100 g |
| Lebensmittel für besondere medizinische Zwecke im Sinne der Verordnung (EU) Nr. 609/2013 |
Entsprechend den besonderen Ernährungsbedürfnissen des Personenkreises, für den die Erzeugnisse bestimmt sind |
| Lysozymhydrolysat aus Hühnereiweiß
2020/1559 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Nahrungsergänzungsmittels anzugeben ist, lautet "Lysozymhydrolysat aus Hühnereiweiß". |
|
|
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG für Erwachsene |
1000 mg/Ta |
| Magnesiumcitratmalat |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Magnesiumcitratmalat". |
|
|
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
|
| Magnolienrindenextrakt |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Magnolienrindenextrakt". |
|
|
| Pfefferminz (Süßwaren) |
0,2 % zur Atemerfrischung. Bei Zusatz von maximal 0,2 % und einem Kaugummi-/Pfefferminz-Stückgewicht von maximal 1,5 g enthält jede verabreichte Kaugummi-/Pfefferminz-Dosis höchstens 3 mg Magnolienrindenextrakt. |
| Kaugummi |
| Maiskeimöl mit hohem Anteil an unverseifbaren Bestandteilen |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Maiskeimölauszug". |
|
|
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
2 g/Tag |
| Kaugummi |
2 % |
| Methylcellulose |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Methylcellulose". |
Methylcellulose darf nicht in spezieller Kleinkindnahrung verwendet werden. |
|
| Speiseeis |
2 % |
| Aromatisierte Getränke |
| Aromatisierte oder nicht aromatisierte fermentierte Milchprodukte |
| Kalte Nachspeisen (Milch-, Fett-, Obst- und Getreideprodukte und Produkte auf Eibasis) |
| Obstzubereitungen (in Form von Fruchtfleisch, Püree oder Kompott) |
| Suppen und Brühen |
| 1-Methylnicotinamidchlorid |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "1-Methylnicotinamidchlorid".
Auf Nahrungsergänzungsmitteln, die 1-Methylnicotinamidchlorid enthalten, sind folgende Angaben zu machen:
"Dieses Nahrungsergänzungsmittel sollte nur von Erwachsenen, mit Ausnahme von Schwangeren und Stillenden, verzehrt werden. |
|
Zugelassen am 2. September 2018. Diese Aufnahme erfolgt auf der Grundlage geschützter wissenschaftlicher Erkenntnisse und wissenschaftlicher Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen.
Antragsteller: Pharmena S.A., Wolczanska 178, 90.530 Lodz, Polen. Solange der Datenschutz gilt, darf das neuartige Lebensmittel 1-Methylnicotinamidchlorid nur von Pharmena S.A. in der Union in Verkehr gebracht werden, es sei denn, ein späterer Antragsteller erhält die Zulassung für das neuartige Lebensmittel ohne Bezugnahme auf die wissenschaftlichen Erkenntnisse oder wissenschaftlichen Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen, oder er hat die Zustimmung von Pharmena S.A.
Zeitpunkt, zu dem der Datenschutz erlischt: 2. September 2023. |
| Nahrungsergänzungsmittel für Erwachsene im Sinne der Richtlinie 2002/46/EG, ausgenommen solche für Schwangere und Stillende |
58 mg/Tag |
| (6S)-5-Methyltetrahydrofolsäure, Glucosaminsalz |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "(6S)-5-Methyltetrahydrofolsäure, Glucosaminsalz" oder "5MTHF-Glucosamin". |
|
|
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG als Folatquelle |
|
|
|
|
| Monomethylsilantriol (Organisches Silicium) |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte an Silicium |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Nahrungsergänzungsmittels anzugeben ist, lautet "Organisches Silicium (Monomethylsilantriol)". |
|
|
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG für Erwachsene (in flüssiger Form) |
10,40 mg/Tag |
| Mycelauszug aus dem Shiitake-Pilz (Lentinula edodes) |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Auszug aus dem PilzLentinula edodes" oder "Auszug aus dem Shiitake-Pilz". |
|
|
| Brotprodukte |
2 ml/100 g |
| Erfrischungsgetränke |
0,5 ml/100 ml |
| Fertiggerichte |
2,5 ml je Mahlzeit |
| Lebensmittel auf Joghurtbasis |
1,5 ml/100 ml |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
2,5 ml je Tagesdosis |
| Myzelien von Antrodia camphorata in Pulverform
Stand: VO (EU) 2022/2535 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
- Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Nahrungsergänzungsmittels anzugeben ist, lautet "Myzelien von Antrodia camphorata in Pulverform".
- Die Kennzeichnung der Nahrungsergänzungsmittel, die Myzelien von Antrodia camphorata in Pulverform enthalten, muss mit dem Hinweis versehen sein, dass das Nahrungsergänzungsmittel nicht von Säuglingen, Kindern und Jugendlichen unter 14 Jahren verzehrt werden sollte.
|
|
|
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG, ausgenommen solche für Säuglinge, Kinder und Jugendliche unter 14 Jahren |
990 mg/Tag |
| Mit Myzelien von Lentinula edodes (Shiitake-Pilz) fermentiertes Erbsen- und Reisprotein
Stand: VO (EU) 2023/6 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "mit Myzelien des Shiitake-Pilzes fermentiertes Erbsen- und Reisprotein". |
|
Zugelassen am 24.1.2023. Diese Aufnahme erfolgt auf der Grundlage geschützter wissenschaftlicher Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen.
Antragsteller: MycoTechnology, Inc., 18250 E. 40th Avenue, Suite 50, Aurora, 80011 colorado, Vereinigte Staaten. Solange der Datenschutz gilt, darf das neuartige Lebensmittel "mit Myzelien von Lentinula edodes (Shiitake-Pilz) fermentiertes Erbsen- und Reisprotein" nur von MycoTechnology, Inc. in der Union in Verkehr gebracht werden, es sei denn, ein späterer Antragsteller erhält die Zulassung für das neuartige Lebensmittel ohne Bezugnahme auf die wissenschaftlichen Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen, oder er hat die Zustimmung von MycoTechnology, Inc.
Zeitpunkt, zu dem der Datenschutz erlischt: 24.1.2028. |
| Backwaren, Brote, Brötchen, Croutons, Pizza |
5 g/100 g |
| Frühstückscerealien und Getreideriegel |
33 g/100 g |
| Frucht- und Gemüsegetränke |
20 g/100 ml |
| Instant-Getränkepulver |
93 g/100 g |
| Kakao- und Schokoladenerzeugnisse |
7 g/100 g |
| Milchprodukt-Analoge und milchfreier Mahlzeitersatz für eine gewichtskontrollierende Ernährung |
11 g/100 g |
| Fermentierte Erzeugnisse auf Milchbasis |
5 g/100 g |
| Erzeugnisse aus Teigwaren |
15 g/100 g |
| Fleischzubereitungen und Fleischerzeugnisse |
14 g/100 g |
| Suppen (verzehrfertig) sowie Suppenkonzentrate oder -pulver |
3 g/100 g |
| Salate |
26 g/100 g |
| Fleisch-Analoge |
40 g/100 g |
| Milchgetränke |
1 g/100 g |
| Mahlzeitersatz für eine gewichtskontrollierende Ernährung |
1 g/100 g |
| Zugelassenes neuartiges Lebensmittel |
Bedingungen, unter denen das neuartige Lebensmittel verwendet werden darf |
zusätzliche spezifische Kennzeichnungsvorschriften |
sonstige Anforderungen |
Datenschutz |
| Nicotinamid-Ribosidchlorid
Stand: VO"en (EU) 2022/1160; 2020/16 |
Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
300 mg/Tag für die erwachsene Bevölkerung, ausgenommen Schwangere und Stillende
230 mg/Tag für Schwangere und Stillende |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Nicotinamid-Ribosidchlorid". |
|
Zugelassen am 20. Februar 2020. Diese Aufnahme erfolgt auf der Grundlage geschützter wissenschaftlicher Erkenntnisse und wissenschaftlicher Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen.
Antragsteller: ChromaDex Inc., 10900 Wilshire Boulevard Suite 600, Los Angeles, Ca 90024 USA. Solange der Datenschutz gilt, darf das neuartige Lebensmittel nur von ChromaDex Inc. in der Union in Verkehr gebracht werden, es sei denn, ein späterer Antragsteller erhält die Zulassung für das neuartige Lebensmittel ohne Bezugnahme auf die wissenschaftlichen Erkenntnisse oder wissenschaftlichen Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen, oder er hat die Zustimmung von ChromaDex Inc.
Zeitpunkt, zu dem der Datenschutz erlischt: 20. Februar 2025 |
| Lebensmittel für besondere medizinische Zwecke im Sinne der Verordnung (EU) Nr. 609/2013 für die erwachsene Bevölkerung, ausgenommen Schwangere und Stillende |
Entsprechend den besonderen Ernährungsbedürfnissen des Personenkreises, für den die Erzeugnisse bestimmt sind |
(1) Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Nicotinamid-Ribosidchlorid".
(2) Die Kennzeichnung von Lebensmitteln, die das neuartige Lebensmittel enthalten, enthält einen Hinweis darauf, dass diese Lebensmittel nur von Personen über 18 Jahre und ausgenommen Schwangere und Stillende verzehrt werden sollte. |
|
|
| Tagesrationen für gewichtskontrollierende Ernährung im Sinne der Verordnung (EU) Nr. 609/2013 für die erwachsene Bevölkerung, ausgenommen Schwangere und Stillende |
500 mg/Tag |
| Mahlzeitersatz für die erwachsene Bevölkerung, ausgenommen Schwangere und Stillende |
150 mg/Mahlzeit (maximal 2 Mahlzeiten/Tag bis zu einer Höchstmenge von 300 mg/Tag) |
| Noni-Fruchtsaft (Morinda citrifolia) |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Noni-Saft" oder "Morinda-citrifolia-Saft". |
|
|
| Getränke auf Basis von pasteurisierten Früchten und pasteurisiertem Fruchtnektar |
30 ml pro Anwendung (bis zu 100 % Noni-Saft) oder
20 ml zweimal täglich, höchstens 40 ml pro Tag |
| Noni-Fruchtsaftpulver (Morinda citrifolia) |
Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
6,6 g/Tag (entspricht 30 ml Noni-Saft) |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Noni-Saftpulver" oder "Morinda-citrifolia-Saftpulver". |
|
|
| Noni-Fruchtpüree und -konzentrat (Morinda citrifolia) |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet
bei Fruchtpüree:
"Morinda-citrifolia-Fruchtpüree" oder "Noni-Fruchtpüree",
bei Fruchtkonzentrat:
"Morinda-citrifolia-Fruchtkonzentrat" oder "Noni-Fruchtkonzentrat". |
|
|
|
Fruchtpüree |
| Bonbons/Süßwaren |
45 g/100 g |
| Getreideriegel |
53 g/100 g |
| Nährstoffgetränkmischungen in Pulverform (Trockengewicht) |
53 g/100 g |
| Mit Kohlensäure versetzte Getränke |
11 g/100 g |
| Eiscreme und Sorbet |
31 g/100 g |
| Joghurt |
12 g/100 g |
| Kekse |
53 g/100 g |
| Brötchen, Kuchen und Gebäck |
53 g/100 g |
| Frühstückscerealien (ganzes Korn) |
88 g/100 g |
| Konfitüren und Gelees im Sinne der Richtlinie 2001/113/EG |
133 g/100 g
Menge vor der Verarbeitung, die ein Endgewicht des Produkts von 100 g ergibt. |
| Süße Aufstriche, Füllungen und Glasuren |
31 g/100 g |
| Gewürzsoßen, Pickles, Bratensoßen und Würzmittel |
88 g/100 g |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
26 g/Tag |
|
Fruchtkonzentrat |
| Bonbons/Süßwaren |
10 g/100 g |
| Getreideriegel |
12 g/100 g |
| Nährstoffgetränkmischungen in Pulverform (Trockengewicht) |
12 g/100 g |
| Mit Kohlensäure versetzte Getränke |
3 g/100 g |
| Eiscreme und Sorbet |
7 g/100 g |
| Joghurt |
3 g/100 g |
| Kekse |
12 g/100 g |
| Brötchen, Kuchen und Gebäck |
12 g/100 g |
| Frühstückscerealien (ganzes Korn) |
20 g/100 g |
| Konfitüren und Gelees im Sinne der Richtlinie 2001/113/EG |
30 g/100 g |
| Süße Aufstriche, Füllungen und Glasuren |
7 g/100 g |
| Gewürzsoßen, Pickles, Bratensoßen und Würzmittel |
20 g/100 g |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
6 g/Tag |
| Noni-Blätter (Morinda citrifolia) |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
- Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Noni-Blätter" oder "Blätter vonMorinda citrifolia".
- Die Verbraucher sollten darauf hingewiesen werden, dass bei der Zubereitung einer Tasse Aufguss nicht mehr als 1 g getrocknete und geröstete Blätter vonMorinda citrifolia verwendet werden sollten.
|
|
|
| Für die Zubereitung von Aufgüssen |
Für die Zubereitung einer Tasse Aufguss darf höchstens 1 g getrocknete und geröstete Blätter vonMorinda citrifolia verwendet werden. |
| Noni-Fruchtpulver (Morinda citrifolia) |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Morinda-citrifolia-Fruchtpulver" oder "Noni-Fruchtpulver". |
|
|
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
2,4 g/Tag |
| MikroalgeOdontella aurita |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "MikroalgeOdontella aurita". |
|
|
| Aromatisierte Teigwaren |
1,5 % |
| Fischsuppen |
1 % |
| Schüssel-Pasteten mit Meeresfrüchten |
0,5 % |
| Brühe-Zubereitungen |
1 % |
| Kräcker |
1,5 % |
| Panierter Tiefkühlfisch |
1,5 % |
| Osteopontin aus Kuhmilch
Stand: VO (EU) 2023/463 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Osteopontin aus Kuhmilch". |
|
Zugelassen am 26. März 2023. Diese Aufnahme erfolgt auf der Grundlage geschützter wissenschaftlicher Erkenntnisse und wissenschaftlicher Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen.
Antragsteller: Arla Foods Ingredients Group P/S, Sønderhøj 10-12, 8260 Viby J, Dänemark. Solange der Datenschutz gilt, darf das neuartige Lebensmittel Osteopontin aus Kuhmilch in der Union nur von Arla Foods Ingredients Group P/S in Verkehr gebracht werden, es sei denn, ein späterer Antragsteller erhält die Zulassung für das neuartige Lebensmittel ohne Bezugnahme auf die wissenschaftlichen Erkenntnisse oder wissenschaftlichen Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen, oder er hat die Zustimmung von Arla Foods Ingredients Group P/S.
Zeitpunkt, zu dem der Datenschutz erlischt: 26. März 2028. |
| Säuglingsanfangsnahrung im Sinne der Verordnung (EU) Nr. 609/2013 10 |
151 mg/l im verzehrfertigen Enderzeugnis,
das als solches in Verkehr gebracht oder nach Anweisung
des Herstellers rekonstituiert wird |
| Folgenahrung im Sinne der Verordnung (EU) Nr. 609/2013 10 |
151 mg/l im verzehrfertigen Enderzeugnis,
das als solches in Verkehr gebracht oder nach Anweisung
des Herstellers rekonstituiert wird |
| Getränke auf Milchbasis, die für Kleinkinder bestimmt sind |
151 mg/l im verzehrfertigen Enderzeugnis,
das als solches in Verkehr gebracht oder nach Anweisung des Herstellers rekonstituiert wird |
| Mit Phytosterinen/Phytostanolen angereichertes Öl |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte an Phytosterinen/Phytostanolen |
Gemäß Anhang III Nummer 5 der Verordnung (EU) Nr. 1169/2011 |
|
|
| Streichfette gemäß Anhang VII Teil VII sowie Anlage II Buchstaben B und C der Verordnung (EU) Nr. 1308/2013 mit Ausnahme von aus Butter oder sonstigem tierischem Fett hergestellten Koch- und Bratfetten oder Streichfetten |
- Die Erzeugnisse, die die neuartige Lebensmittelzutat enthalten, sind in einer Form anzubieten, in der sie leicht in Portionen aufgeteilt werden können, die höchstens 3 g (bei einer Portion/Tag) oder höchstens 1 g (bei drei Portionen/Tag) an zugesetzten Phytosterinen/Phytostanolen enthalten.
- Die Menge an zugesetzten Phytosterinen/Phytostanolen je Behälter mit Getränken beträgt höchstens 3 g.
- Salatsoßen, Mayonnaise und Gewürzsoßen sind in Einzelportionen abzupacken.
|
| Produkte auf Milchbasis, wie zum Beispiel teilentrahmte und entrahmte Milchprodukte, möglicherweise mit Frucht- und/oder Getreidezusatz, Produkte auf Basis fermentierter Milch, wie z.B. Joghurt und Produkte auf Käsebasis (Fettgehalt ≤12 g je 100 g), bei denen möglicherweise das Milchfett reduziert und das Fett oder Protein teilweise oder vollständig durch pflanzliches Fett oder Protein ersetzt wurde |
| Sojagetränke |
| Salatsoßen, Mayonnaise und Gewürzsoßen |
| Aus Kalmaren gewonnenes Öl |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte für die Summe aus DHa und EPA |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Kalmarenöl". |
|
|
| Milchprodukte, ausgenommen Getränke auf Milchbasis |
200 mg/100 g oder für Käseprodukte 600 mg/100 g |
| Milchprodukt-Analoge, ausgenommen Getränke |
200 mg/100 g oder für Käseprodukt-Analoge 600 mg/100 g |
| Streichfette und Salatsoßen |
600 mg/100 g |
| Frühstückscerealien |
500 mg/100 g |
| Backwaren (Brot und Brötchen) |
200 mg/100 g |
| Getreideriegel |
500 mg/100 g |
| Nichtalkoholische Getränke (einschließlich Getränke auf Milchbasis) |
60 mg/100 ml |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
3.000 mg/Tag für die allgemeine Bevölkerung
450 mg/Tag für Schwangere und Stillende |
| Lebensmittel für besondere medizinische Zwecke im Sinne der Verordnung (EU) Nr. 609/2013 |
Entsprechend den besonderen Ernährungsbedürfnissen des Personenkreises, für den die Produkte bestimmt sind |
| Tagesrationen für eine gewichtskontrollierende Ernährung im Sinne der Verordnung (EU) Nr. 609/2013 und Mahlzeitersatz für eine gewichtskontrollierende Ernährung |
200 mg/Mahlzeit |
| Zugelassenes neuartiges Lebensmittel |
Bedingungen, unter denen das neuartige Lebensmittel verwendet werden darf |
zusätzliche spezifische Kennzeichnungsvorschriften |
sonstige Anforderungen |
Datenschutz |
| Hochdruck-pasteurisierte Fruchtzubereitungen |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Neben der Bezeichnung der Fruchtzubereitungen als solche sowie auf den Produkten, bei denen das Verfahren angewandt wird, ist das Wort "hochdruckpasteurisiert" anzugeben. |
|
|
| Art der Früchte:
Apfel, Aprikose, Banane, Brombeere, Blaubeere, Kirsche, Kokosnuss, Feige, Traube, Pampelmuse, Mandarine, Mango, Melone, Pfirsich, Birne, Ananas, Pflaume, Himbeere, Rhabarber, Erdbeere |
|
| Extrakt aus Panaxnotoginseng undAstragalus membranaceus
Stand: VO (EU) 2020/1821 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Extrakt aus Panax notoginseng und Astragalus membranaceus"
Die Kennzeichnung von Nahrungsergänzungsmitteln, die einen Extrakt aus Panax notoginseng und Astragalus membranaceus enthalten, muss den Hinweis enthalten, dass diese Nahrungsergänzungsmittel nicht von Personen unter 18 Jahren und nicht von Schwangeren verzehrt werden sollten. |
|
Zugelassen am 23. Dezember 2020. Diese Aufnahme erfolgt auf der Grundlage geschützter wissenschaftlicher Erkenntnisse und wissenschaftlicher Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen.
Antragsteller: NuLiv Science, 1050 W. Central Ave., Building C, Brea, Ca 92821, USA.
Solange der Datenschutz gilt, darf das neuartige Lebensmittel nur von NuLiv Science in der Union in Verkehr gebracht werden, es sei denn, ein späterer Antragsteller erhält die Zulassung für das neuartige Lebensmittel ohne Bezugnahme auf die wissenschaftlichen Erkenntnisse oder wissenschaftlichen Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen, oder er hat die Zustimmung von NuLiv Science.
Zeitpunkt, zu dem der Datenschutz erlischt: 23. Dezember 2025. |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG für die allgemeine erwachsene Bevölkerung, ausgenommen Nahrungsergänzungsmittel für Schwangere |
35 mg/Tag |
| Phenylcapsaicin
Stand: VO (EU) 2019/1976 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Phenylcapsaicin". |
|
Zugelassen am 19. Dezember 2019. Diese Aufnahme erfolgt auf der Grundlage geschützter wissenschaftlicher Erkenntnisse und wissenschaftlicher Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen.
Antragsteller: aXichem AB, Södergatan 26, 211 34 Malmö, Schweden. Solange der Datenschutz gilt, darf das neuartige Lebensmittel "Phenylcapsaicin" nur von aXichem AB in der Union in Verkehr gebracht werden, es sei denn, ein späterer Antragsteller erhält die Zulassung für das neuartige Lebensmittel ohne Bezugnahme auf die wissenschaftlichen Erkenntnisse oder wissenschaftlichen Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen, oder er hat die Zustimmung von aXichem AB. |
| Lebensmittel für besondere medizinische Zwecke im Sinne der Verordnung (EU) Nr. 609/2013, ausgenommen Lebensmittel für Säuglinge, Kleinkinder und Kinder unter 11 Jahren |
2,5 mg/Tag |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG für die allgemeine Bevölkerung, ausgenommen Kinder unter 11 Jahren |
2,5 mg/Tag |
| Phosphatierte Maisstärke |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Phosphatierte Maisstärke". |
|
|
| Backwaren |
15 % |
| Teigwaren |
| Frühstückscerealien |
| Getreideriegel |
| Phosphatierte Weizenstärke
Stand: VO (EU) 2023/937 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Phosphatierte Weizenstärke". |
|
|
| Backwaren |
15 % |
| Teigwaren |
| Frühstückscerealien |
| Getreideriegel |
| Phosphatidylserin aus Fisch-Phospholipiden |
Spezifizierte Lebensmittelkategorie |
Höchstgehalt an Phosphatidylserin |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Fisch-Phosphatidylserin". |
|
|
| Getränke auf Joghurtbasis |
50 mg/100 ml |
| Pulver auf Milchpulverbasis |
3.500 mg/100 g (entspricht 40 mg/100 ml trinkfertig) |
| Lebensmittel auf Joghurtbasis |
80 mg/100 g |
| Getreideriegel |
350 mg/100 g |
| Süßwaren auf Schokoladebasis |
200 mg/100 g |
| Lebensmittel für besondere medizinische Zwecke im Sinne der Verordnung (EU) Nr. 609/2013 |
Gemäß der Verordnung (EU) Nr. 609/2013 |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
300 mg/Tag |
| Phosphatidylserin aus Soja-Phospholipiden |
Spezifizierte Lebensmittelkategorie |
Höchstgehalt an Phosphatidylserin |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Soja-Phosphatidylserin". |
|
|
| Getränke auf Joghurtbasis |
50 mg/100 ml |
| Pulver auf Milchpulverbasis |
3,5 g/100 g (entspricht 40 mg/100 ml trinkfertig) |
| Lebensmittel auf Joghurtbasis |
80 mg/100 g |
| Getreideriegel |
350 mg/100 g |
| Süßwaren auf Schokoladebasis |
200 mg/100 g |
| Lebensmittel für besondere medizinische Zwecke im Sinne der Verordnung (EU) Nr. 609/2013 |
Gemäß der Verordnung (EU) Nr. 609/2013 |
| Phospholipidprodukt mit gleichen Anteilen an Phosphatidylserin und Phosphatidsäure |
Spezifizierte Lebensmittelkategorie |
Höchstgehalt an Phosphatidylserin |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Soja-Phosphatidylserin und -Phosphatidsäure". |
Das Produkt ist nicht zur Vermarktung an Schwangere oder Stillende bestimmt. |
|
| Frühstückscerealien |
80 mg/100 g |
| Getreideriegel |
350 mg/100 g |
| Lebensmittel auf Joghurtbasis |
80 mg/100 g |
| Joghurtähnliche Produkte auf Sojabasis |
80 mg/100 g |
| Joghurtdrinks |
50 mg/100 g |
| Joghurtähnliche Sojadrinks |
50 mg/100 g |
| Pulver auf Milchpulverbasis |
3,5 g/100 g (entspricht 40 mg/100 ml trinkfertig) |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
800 mg/Tag |
| Lebensmittel für besondere medizinische Zwecke im Sinne der Verordnung (EU) Nr. 609/2013 |
Gemäß der Verordnung (EU) Nr. 609/2013 |
| Phospholipide aus Eigelb |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
|
|
|
| Keine Angabe |
| Phytoglycogen |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Phytoglycogen". |
|
|
| Verarbeitete Lebensmittel |
25 % |
| Phytosterine/Phytostanole |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Gemäß Anhang III Nummer 5 der Verordnung (EU) Nr. 1169/2011 |
|
|
| Reisgetränke |
- Sie sind in einer Form anzubieten, in der sie leicht in Portionen aufgeteilt werden können, die höchstens 3 g (bei einer Portion je Tag) oder höchstens 1 g (bei drei Portionen je Tag) zugesetzte Phytosterine/Phytostanole enthalten.
Die Menge an zugesetzten Phytosterinen/Phytostanolen je Behälter mit Getränken beträgt höchstens 3 g.
Salatsoßen, Mayonnaise und Gewürzsoßen sind in Einzelportionen abzupacken.
|
| Roggenbrot mit Mehl, das ≥ 50 % Roggen (Vollkornroggenmehl, ganze oder grob geschrotete Roggenkörner und Roggenflocken) und ≤30 % Weizen enthält; und mit ≤ 4 % Zuckerzusatz, kein Fettzusatz |
| Salatsoßen, Mayonnaise und Gewürzsoßen |
| Sojagetränke |
| Milchartige Produkte wie teilentrahmte und entrahmte milchartige Produkte, möglicherweise mit Frucht- und/oder Getreidezusatz, bei denen möglicherweise das Milchfett reduziert oder das Milchfett und/oder -protein teilweise oder vollständig durch pflanzliches Fett und/oder Protein ersetzt wurde |
| Produkte auf Basis fermentierter Milch wie Joghurt und käseartige Produkte (Fettgehalt < 12 % je 100 g), bei denen möglicherweise das Milchfett reduziert oder das Milchfett und/oder -protein teilweise oder vollständig durch pflanzliches Fett und/oder Protein ersetzt wurde |
| Streichfette gemäß Anhang VII Teil VII sowie Anlage II Buchstaben B und C der Verordnung (EU) Nr. 1308/2013 mit Ausnahme von aus Butter oder sonstigem tierischem Fett hergestellten Koch- und Bratfetten oder Streichfetten |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
3 g/Tag |
| Pflaumenkernöl |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
|
|
|
| Zum Braten und als Würzmittel |
Im Einklang mit der normalen Verwendung als pflanzliches Speiseöl |
| Kartoffelproteine (koaguliert) und daraus hergestellte Hydrolysate |
Keine Angabe |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Kartoffelprotein". |
|
|
| Prolyloligopeptidase (Enzymzubereitung) |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Prolyloligopeptidase". |
|
|
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG für die allgemeine erwachsene Bevölkerung |
120 PPU/Tag (2,7 g Enzymzubereitung/Tag) (2 × 106 PPI/Tag) PPU - Prolyl Peptidase Units oder Proline Protease Units
PPI - Protease Picomole International |
| Protein aus Mungbohnen (Vigna radiata)
Stand: VO (EU) 2022/673 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Protein aus Mungbohnen (Vigna radiata)". |
|
Zugelassen am 15. Mai 2022. Diese Aufnahme erfolgt auf der Grundlage geschützter wissenschaftlicher Erkenntnisse und wissenschaftlicher Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen.
Antragsteller: Eat Just, Inc., 2000 Folsom Street San Francisco, Ca 94110 USA. Solange der Datenschutz gilt, darf das neuartige Lebensmittel Mungbohnen-Protein nur von Eat Just, Inc. in der Union in Verkehr gebracht werden, es sei denn, ein späterer Antragsteller erhält die Zulassung für das neuartige Lebensmittel ohne Bezugnahme auf die wissenschaftlichen Erkenntnisse oder wissenschaftlichen Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen, oder er hat die Zustimmung von Eat Just, Inc.
Zeitpunkt, zu dem der Datenschutz erlischt: 15. Mai 2027. |
| Proteinerzeugnisse |
20 g/100 g |
| Proteinextrakt aus der Schweineniere |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
|
|
|
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
3 Kapseln oder 3 tabletten/Tag; entspricht 12,6 mg Konzentrat aus der Schweineniere/Tag Gehalt an Diaminoxidase (DAO): 0,9 mg/Tag (3 Kapseln oder 3 tabletten mit einem Gehalt an DAO von 0,3 mg/Kapsel oder 0,3 mg/tablette) |
| Lebensmittel für besondere medizinische Zwecke im Sinne der Verordnung (EU) Nr. 609/2013 |
| Pulver aus teilweise entfetteten Samen von Brassica rapa L. und Brassica napus L. |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Pulver aus teilweise entfetteten Samen".
Lebensmittel, die "Pulver aus teilweise entfetteten Samen von Brassica rapa L. und Brassica napus L." enthalten, müssen mit dem Hinweis versehen sein, dass diese Zutat bei Verbrauchern, die gegen Senf und Senferzeugnisse allergisch sind, allergische Reaktionen auslösen kann. Dieser Hinweis muss in unmittelbarer Nähe der Zutatenliste angebracht werden." |
|
|
| Riegel aus Mischgetreide |
20 g/100 g |
| Müsli und ähnliche Frühstückscerealien |
20 g/100 g |
| Extrudierte Frühstücksgetreideprodukte |
20 g/100 g |
| Snacks (außer Kartoffelchips) |
15 g/100 g |
| Brot und Brötchen mit besonderen Zutaten (z.B. Samen, Rosinen, Kräuter) |
7 g/100 g |
| Schwarzbrot mit Angaben über das Nichtvorhandensein oder das reduzierte Vorhandensein von Gluten gemäß den Anforderungen der Durchführungsverordnung (EU) Nr. 828/2014 der Kommission |
7 g/100 g |
| Mehrkornbrot und -brötchen |
7 g/100 g |
| Fleischersatz |
10 g/100 g |
| Fleischklöße |
10 g/100 g |
| Pyrrolochinolinchinon-Dinatriumsalz |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Pyrrolochinolinchinon-Dinatriumsalz".
Auf Nahrungsergänzungsmitteln, die Pyrrolochinolinchinon-Dinatriumsalz enthalten, sind folgende Angaben zu machen:
Dieses Nahrungsergänzungsmittel sollte nur von Erwachsenen, mit Ausnahme von Schwangeren und Stillenden, verzehrt werden. |
|
Zugelassen am 2. September 2018. Diese Aufnahme erfolgt auf der Grundlage geschützter wissenschaftlicher Erkenntnisse und wissenschaftlicher Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen.
Antragsteller: Mitsubishi Gas Chemical Company, Inc., Mitsubishi Building 5-2 Marunouchi 2-chome, Chiyodaku, Tokyo 100-8324, Japan Solange der Datenschutz gilt, darf das neuartige Lebensmittel Pyrrolochinolinchinon-Dinatriumsalz nur von Mitsubishi Gas Chemical Company, Inc. in der Union in Verkehr gebracht werden, es sei denn, ein späterer Antragsteller erhält die Zulassung für das neuartige Lebensmittel ohne Bezugnahme auf die wissenschaftlichen Erkenntnisse oder wissenschaftlichen Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen, oder er hat die Zustimmung der Mitsubishi Gas Chemical Company, Inc.
Zeitpunkt, zu dem der Datenschutz erlischt: 2. September 2023. |
| Nahrungsergänzungsmittel für Erwachsene im Sinne der Richtlinie 2002/46/EG, ausgenommen solche für Schwangere und Stillende |
20 mg/Tag |
| Rapsöl mit hohem Anteil an unverseifbaren Bestandteilen |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Rapsölauszug". |
|
|
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
1,5 g je Portion als Tagesdosis empfohlen |
| Rapssamenprotein |
Als pflanzliche Proteinquelle in Lebensmitteln, außer in Säuglingsanfangs- und Folgenahrung |
|
- Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Rapssamenprotein".
- Jedes Rapssamenprotein enthaltende Lebensmittel muss den Hinweis tragen, dass diese Lebensmittelzutat bei Verbrauchern mit Allergie gegen Senf und daraus gewonnene Erzeugnisse allergische Reaktionen auslösen kann. Dieser Hinweis ist gegebenenfalls in unmittelbarer Nähe der Zutatenliste anzubringen.
|
|
|
| Raffiniertes Shrimps-Peptid-Konzentrat |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "raffiniertes Shrimps-Peptid-Konzentrat". |
|
Zugelassen am 20. November 2018. Diese Aufnahme erfolgt auf der Grundlage geschützter wissenschaftlicher Erkenntnisse und wissenschaftlicher Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen.
Antragsteller: Marealis AS, Stortorget 1, Kystens Hus, 2. Stock, N-9008 Tromsø, Postanschrift: P.O. Box 1065, 9261 Tromsø, Norwegen. Solange der Datenschutz gilt, darf das neuartige Lebensmittel "raffiniertes Shrimps-Peptid-Konzentrat" nur von Marealis AS in der Union in Verkehr gebracht werden, es sei denn, ein späterer Antragsteller erhält die Zulassung für das neuartige Lebensmittel ohne Bezugnahme auf die geschützten wissenschaftlichen Erkenntnisse oder wissenschaftlichen Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen, oder er hat die Zustimmung von Marealis AS.
Zeitpunkt, zu dem der Datenschutz erlischt: 20. November 2023. |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG für die erwachsene Bevölkerung |
1.200 mg/Tag |
| trans-Resveratrol
Stand: VO (EU) 2021/51 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
- Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Nahrungsergänzungsmittels anzugeben ist, lautet "trans-Resveratrol".
- Die Kennzeichnung von Nahrungsergänzungsmitteln, dietrans-Resveratrol enthalten, muss einen Hinweis enthalten, dass das Erzeugnis bei der Einnahme von Arzneimitteln nur unter ärztlicher Aufsicht verzehrt werden sollte.
|
|
|
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG für Erwachsene |
150 mg/Tag |
| trans-Resveratrol (mikrobielle Quelle) |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
- Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Nahrungsergänzungsmittels anzugeben ist, lautet "trans-Resveratrol".
- Die Kennzeichnung von Nahrungsergänzungsmitteln, dietrans-Resveratrol enthalten, muss einen Hinweis enthalten, dass das Erzeugnis bei der Einnahme von Arzneimitteln nur unter ärztlicher Aufsicht verzehrt werden sollte.
|
|
|
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
Im Einklang mit der normalen Verwendung eines Extrakts von Resveratrol aus Spiess-Knöterich (Fallopia japonica) in Nahrungsergänzungsmitteln |
| Hahnenkammextrakt |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Hahnenkammextrakt" oder "Junghahnenkammextrakt". |
|
|
| Getränke auf Milchbasis |
40 mg/100 g oder mg/100 ml |
| Fermentierte Getränke auf Milchbasis |
80 mg/100 g oder mg/100 ml |
| Joghurtartige Erzeugnisse |
65 mg/100 g oder mg/100 ml |
| Fromage frais |
110 mg/100 g oder mg/100 ml |
| Sacha-Inchi-Öl ausPlukenetia volubilis |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Sacha-Inchi-Öl (Plukenetia volubilis)". |
|
|
| Wie Leinöl |
Im Einklang mit der normalen Verwendung von Leinöl |
| Salatrims |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
- Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Brennwertreduziertes Fett (Salatrims)".
- Dabei ist anzugeben, dass übermäßiger Verzehr zu Magen-Darm-Störungen führen kann.
- Anzugeben ist ferner, dass die betreffenden Erzeugnisse nicht für Kinder bestimmt sind.
|
|
|
| Back- und Süßwaren |
|
| Zugelassenes neuartiges Lebensmittel |
Bedingungen, unter denen das neuartige Lebensmittel verwendet werden darf |
zusätzliche spezifische Kennzeichnungsvorschriften |
sonstige Anforderungen |
Datenschutz |
| Schizochytrium sp. (ATCC PTA-9695)-Öl
Stand: VO (EU) 2019/387 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte an DHA |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Öl aus der Mikroalge Schizochytrium sp.". |
|
|
| Milchprodukte, ausgenommen Getränke auf Milchbasis |
200 mg/100 g oder für Käseprodukte 600 mg/100 g |
| Milchprodukt-Analoge, ausgenommen Getränke |
200 mg/100 g oder für Käseprodukt-Analoge 600 mg/100 g |
| Streichfette und Salatsoßen |
600 mg/100 g |
| Frühstückscerealien |
500 mg/100 g |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
250 mg DHA/Tag für die allgemeine Bevölkerung |
| 450 mg DHA/Tag für Schwangere und Stillende |
| Tagesrationen für eine gewichtskontrollierende Ernährung im Sinne der Verordnung (EU) Nr. 609/2013 und Mahlzeitersatz für eine gewichtskontrollierende Ernährung |
250 mg/Mahlzeit |
| Getränke auf Milchbasis und gleichartige Erzeugnisse, die für Kleinkinder bestimmt sind |
200 mg/100 g |
| Lebensmittel zur Deckung des Energiebedarfs bei intensiver Muskelanstrengung, vor allem für Sportler |
| Lebensmittel mit Angaben über das Nichtvorhandensein oder das reduzierte Vorhandensein von Gluten gemäß den Anforderungen der Durchführungsverordnung (EU) Nr. 828/2014 der Kommission |
| Lebensmittel für besondere medizinische Zwecke im Sinne der Verordnung (EU) Nr. 609/2013 |
Entsprechend den besonderen Ernährungsbedürfnissen des Personenkreises, für den die Produkte bestimmt sind |
| Backwaren (Brot, Brötchen und Kekse) |
200 mg/100 g |
| Getreideriegel |
500 mg/100 g |
| Speisefette |
360 mg/100 g |
| Nichtalkoholische Getränke (einschließlich Milchersatzgetränke und Getränke auf Milchbasis) |
80 mg/100 ml |
| Säuglingsanfangsnahrung und Folgenahrung im Sinne der Verordnung (EU) Nr. 609/2013 |
Gemäß der Verordnung (EU) Nr. 609/2013 |
| Getreidebeikost und andere Beikost für Säuglinge und Kleinkinder im Sinne der Verordnung (EU) Nr. 609/2013 |
200 mg/100 g |
| Obst-/Gemüsepüree |
100 mg/100 g |
| Schizochytrium sp. (FCC-3204)-Öl
Stand: VO (EU) 2021/1326 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte an DHA |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Öl aus der Mikroalge Schizochytrium sp.".
Die Kennzeichnung von Nahrungsergänzungsmitteln, die Schizochytrium sp. (FCC-3204)-Öl enthalten, muss mit dem Hinweis versehen sein, dass sie nicht von Säuglingen und Kindern unter 3 Jahren verzehrt werden sollten. |
|
|
| Säuglingsanfangsnahrung und Folgenahrung im Sinne der Verordnung (EU) Nr. 609/2013 |
Gemäß der Verordnung (EU) Nr. 609/2013 |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG für die allgemeine Bevölkerung über 3 Jahren |
1 g/Tag |
| Schizochytrium sp. (WZU477)-Öl
Stand: VO (EU) 2021/670 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte an DHA |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Öl aus der Mikroalge Schizochytrium sp.". |
|
Zugelassen am 16. Mai 2021. Diese Aufnahme erfolgt auf der Grundlage geschützter wissenschaftlicher Erkenntnisse und wissenschaftlicher Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen.
Antragsteller: Progress Biotech bv, Canaalstaete, Kanaalweg 33, 2903LR Capelle aan den Ijssel, Niederlande.
Solange der Datenschutz gilt, darf das neuartige Lebensmittel nur von Progress Biotech bv in der Union in Verkehr gebracht werden, es sei denn, ein späterer Antragsteller erhält die Zulassung für das neuartige Lebensmittel ohne Bezugnahme auf die wissenschaftlichen Erkenntnisse oder wissenschaftlichen Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen, oder er hat die Zustimmung von Progress Biotech bv.
Zeitpunkt, zu dem der Datenschutz erlischt: 16. Mai 2026 (5 Jahre). |
| Säuglingsanfangsnahrung und Folgenahrung im Sinne der Verordnung (EU) Nr. 609/2013 |
Gemäß der Verordnung (EU) Nr. 609/2013 |
| Schizochytrium sp.-Öl
Stand: VO (EU) 2019/109 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte an DHA |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Öl aus der Mikroalge Schizochytrium sp.". |
|
|
| Milchprodukte, ausgenommen Getränke auf Milchbasis |
200 mg/100 g oder für Käseprodukte 600 mg/100 g |
| Milchprodukt-Analoge, ausgenommen Getränke |
200 mg/100 g oder für Käseprodukt-Analoge 600 mg/100 g |
| Streichfette und Salatsoßen |
600 mg/100 g |
| Frühstückscerealien |
500 mg/100 g |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
250 mg DHA/Tag für die allgemeine Bevölkerung |
| 450 mg DHA/Tag für Schwangere und Stillende |
| Tagesrationen für eine gewichtskontrollierende Ernährung im Sinne der Verordnung (EU) Nr. 609/2013 und Mahlzeitersatz für eine gewichtskontrollierende Ernährung |
250 mg/Mahlzeit |
| Getränke auf Milchbasis und gleichartige Erzeugnisse, die für Kleinkinder bestimmt sind |
200 mg/100 g |
| Getreidebeikost und andere Beikost für Säuglinge und Kleinkinder im Sinne der Verordnung (EU) Nr. 609/2013 |
| Lebensmittel zur Deckung des Energiebedarfs bei intensiver Muskelanstrengung, vor allem für Sportler |
| Lebensmittel mit Angaben über das Nichtvorhandensein oder das reduzierte Vorhandensein von Gluten gemäß den Anforderungen der Durchführungsverordnung (EU) Nr. 828/2014 der Kommission |
| Lebensmittel für besondere medizinische Zwecke im Sinne der Verordnung (EU) Nr. 609/2013 |
Entsprechend den besonderen Ernährungsbedürfnissen des Personenkreises, für den die Produkte bestimmt sind |
| Backwaren (Brot, Brötchen und Kekse) |
200 mg/100 g |
| Getreideriegel |
500 mg/100 g |
| Speisefette |
360 mg/100 g |
| Nichtalkoholische Getränke (einschließlich Milchersatzgetränke und Getränke auf Milchbasis) |
80 mg/100 ml |
| Obst-/Gemüsepüree |
100 mg/100 g |
| Schizochytrium sp. (T18)-Öl
Stand: VO (EU) 2020/1559 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Öl aus der MikroalgeSchizochytrium sp.". |
|
|
| Milcherzeugnisse, ausgenommen Getränke auf Milchbasis |
200 mg/100 g oder für Käseerzeugnisse 600 mg/100 g |
| Milcherzeugnis-Analoge, ausgenommen Getränke |
200 mg/100 g oder für Käseerzeugnis-Analoge 600 mg/100 g |
| Streichfette und Salatsoßen |
600 mg/100 g |
| Frühstückscerealien |
500 mg/100 g |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
250 mg DHA/Tag für die allgemeine Bevölkerung |
| 450 mg DHA/Tag für Schwangere und Stillende |
| Tagesrationen für eine gewichtskontrollierende Ernährung im Sinne der Verordnung (EU) Nr. 609/2013 und Mahlzeitersatz für eine gewichtskontrollierende Ernährung |
250 mg/Mahlzeit |
| Getränke auf Milchbasis und gleichartige Erzeugnisse, die für Kleinkinder bestimmt sind |
200 mg/100 g |
| Lebensmittel zur Deckung des Energiebedarfs bei intensiver Muskelanstrengung, vor allem für Sportler |
| Lebensmittel mit Angaben über das Nichtvorhandensein oder das reduzierte Vorhandensein von Gluten gemäß den Anforderungen der Durchführungsverordnung (EU) Nr. 828/2014 der Kommission |
| Lebensmittel für besondere medizinische Zwecke im Sinne der Verordnung (EU) Nr. 609/2013 |
Entsprechend den besonderen Ernährungsbedürfnissen des Personenkreises, für den die Produkte bestimmt sind |
| Backwaren (Brot, Brötchen und Kekse) |
200 mg/100 g |
| Getreideriegel |
500 mg/100 g |
| Speisefette |
360 mg/100 g |
| Nichtalkoholische Getränke (einschließlich Milchanaloggetränke und Getränke auf Milchbasis) |
80 mg/100 ml |
| Säuglingsanfangsnahrung und Folgenahrung im Sinne der Verordnung (EU) Nr. 609/2013 |
Gemäß der Verordnung (EU) Nr. 609/2013 |
| Getreidebeikost und andere Beikost für Säuglinge und Kleinkinder im Sinne der Verordnung (EU) Nr. 609/2013 |
200 mg/100 g |
| Obst-/Gemüsepüree |
100 mg/100 g |
3"-Sialyllactose (3"-SL) -Natriumsalz
(mikrobiell)
Stand: VO"en (EU) 2023/65; 2021/96 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte (ausgedrückt als 3"-Sialyllactose) |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "3"-Sialyllactose-Natriumsalz".
Die Kennzeichnung von Nahrungsergänzungsmitteln, die 3"-Sialyllactose-Natriumsalz enthalten, muss mit dem Hinweis versehen sein, dass diese nicht verzehrt werden sollten
- bei Verzehr von Lebensmitteln mit zugesetztem 3"-Sialyllactose-Natriumsalz am selben Tag;
- von Säuglingen und Kleinkindern
|
|
Zugelassen am 18. Februar 2021. Diese Aufnahme erfolgt auf der Grundlage geschützter wissenschaftlicher Erkenntnisse und wissenschaftlicher Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen.
Antragsteller: Glycom A/S, Kogle Allé 4, 2970 Hørsholm, Dänemark. Solange der Datenschutz gilt, darf das neuartige Lebensmittel 3"-Sialyllactose-Natriumsalz nur von Glycom A/S in der Union in Verkehr gebracht werden, es sei denn, ein späterer Antragsteller erhält die Zulassung für das neuartige Lebensmittel ohne Bezugnahme auf die wissenschaftlichen Erkenntnisse oder wissenschaftlichen Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen, oder er hat die Zustimmung von Glycom A/S.
Zeitpunkt, zu dem der Datenschutz erlischt: 18. Februar 2026. |
| Nicht aromatisierte pasteurisierte und nicht aromatisierte (auch durch Ultrahocherhitzung) sterilisierte Milcherzeugnisse |
0,25 g/l |
| Nicht aromatisierte fermentierte Erzeugnisse auf Milchbasis |
0,25 g/l (Getränke) |
| 0,5 g/kg (andere Erzeugnisse als Getränke) |
| Aromatisierte fermentierte Erzeugnisse auf Milchbasis, auch wärmebehandelt |
0,25 g/l (Getränke) |
| 2,5 g/kg (andere Erzeugnisse als Getränke) |
| Getränke (aromatisierte Getränke außer Getränken mit einem pH-Wert unter 5) |
0,25 g/l |
| Getreideriegel |
2,5 g/kg |
| Säuglingsanfangsnahrung im Sinne der Verordnung (EU) Nr. 609/2013 |
0,2 g/l im verzehrfertigen Enderzeugnis, das als solches in Verkehr gebracht oder nach Anweisung des Herstellers rekonstituiert wird |
| Folgenahrung im Sinne der Verordnung (EU) Nr. 609/2013 |
0,15 g/l im verzehrfertigen Enderzeugnis, das als solches in Verkehr gebracht oder nach Anweisung des Herstellers rekonstituiert wird |
| Getreidebeikost und andere Beikost für Säuglinge und Kleinkinder im Sinne der Verordnung (EU) Nr. 609/2013 |
0,15 g/l (Getränke) im verzehrfertigen Enderzeugnis, das als solches in Verkehr gebracht oder nach Anweisung des Herstellers rekonstituiert wird |
| 1,25 g/kg für andere Erzeugnisse als Getränke |
| Getränke auf Milchbasis und gleichartige Erzeugnisse, die für Kleinkinder bestimmt sind |
0,15 g/l im verzehrfertigen Enderzeugnis, das als solches in Verkehr gebracht oder nach Anweisung des Herstellers rekonstituiert wird |
| Tagesrationen für eine gewichtskontrollierende Ernährung im Sinne der Verordnung (EU) Nr. 609/2013 |
0,5 g/l (Getränke) |
| 5 g/kg (andere Erzeugnisse als Getränke) |
| Lebensmittel für besondere medizinische Zwecke im Sinne der Verordnung (EU) Nr. 609/2013 |
Entsprechend den besonderen Ernährungsbedürfnissen des Personenkreises, für den die Erzeugnisse bestimmt sind |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG, ausgenommen solche für Säuglinge und Kleinkinder |
0,5 g/Tag |
3"-Sialyllactose-Natriumsalz ("3"SL")
(erzeugt durch abgeleitete Stämme von E. coli BL21(DE3))
Stand: VO"en (EU) 2023/1582; 2023/113 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "3"-Sialyllactose-Natriumsalz".
Die Kennzeichnung von Nahrungsergänzungsmitteln, die 3"-Sialyllactose-Natriumsalz (3"-SL) enthalten, muss den Hinweis tragen, dass
- sie nicht von Kindern unter 3 Jahren verzehrt werden sollten;
- sie nicht verwendet werden sollten, wenn am selben Tag andere Lebensmittel, die 3"-Sialyllactose-Natriumsalz enthalten, verzehrt werden.
|
|
Zugelassen am 6. Februar 2023. Diese Aufnahme erfolgt auf der Grundlage geschützter wissenschaftlicher Erkenntnisse und wissenschaftlicher Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen.
Antragsteller: "Chr. Hansen A/S", Boege Allé 10-12, 2970 Hoersholm, Dänemark. Solange der Datenschutz gilt, darf das neuartige Lebensmittel 3"-Sialyllactose-Natriumsalz in der Union nur von Chr. Hansen A/S in Verkehr gebracht werden, es sei denn, ein späterer Antragsteller erhält die Zulassung für das neuartige Lebensmittel ohne Bezugnahme auf die geschützten wissenschaftlichen Erkenntnisse oder wissenschaftlichen Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen, oder er hat die Zustimmung von Chr. Hansen A/S.
Zeitpunkt, zu dem der Datenschutz erlischt: 6. Februar 2028. |
| Säuglingsanfangsnahrung im Sinne der Verordnung (EU) Nr. 609/2013 |
0,28 g/l im verzehrfertigen Enderzeugnis, das als solches in Verkehr gebracht oder nach Anweisung des Herstellers rekonstituiert wird |
| Folgenahrung im Sinne der Verordnung (EU) Nr. 609/2013 |
0,28 g/l im verzehrfertigen Enderzeugnis, das als solches in Verkehr gebracht oder nach Anweisung des Herstellers rekonstituiert wird |
| Getreidebeikost für Säuglinge und Kleinkinder und andere Beikost für Säuglinge und Kleinkinder im Sinne der Verordnung (EU) Nr. 609/2013 |
0,28 g/l oder 0,28 g/kg im verzehrfertigen Enderzeugnis, das als solches in Verkehr gebracht oder nach Anweisung des Herstellers rekonstituiert wird |
| Getränke auf Milchbasis und gleichartige Erzeugnisse, die für Kleinkinder bestimmt sind |
0,28 g/l im verzehrfertigen Enderzeugnis, das als solches in Verkehr gebracht oder nach Anweisung des Herstellers rekonstituiert wird |
| Lebensmittel für besondere medizinische Zwecke für Säuglinge und Kleinkinder im Sinne der Verordnung (EU) Nr. 609/2013 |
Entsprechend den besonderen Ernährungsbedürfnissen der Säuglinge und Kleinkinder, für die die Erzeugnisse bestimmt sind, jedoch keinesfalls mehr als 0,28 g/l oder 0,28 g/kg im gebrauchsfertigen Enderzeugnis, das als solches in Verkehr gebracht oder nach Anweisung des Herstellers rekonstituiert wird. |
| Lebensmittel für besondere medizinische Zwecke im Sinne der Verordnung (EU) Nr. 609/2013, ausgenommen Lebensmittel für Säuglinge und Kleinkinder |
Entsprechend den besonderen Ernährungsbedürfnissen des Personenkreises, für den die Erzeugnisse bestimmt sind |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG für die allgemeine Bevölkerung, ausgenommen Säuglinge und Kleinkinder |
0,7 g/Tag |
6"-Sialyllactose (6"-SL) -Natriumsalz
(mikrobiell)
Stand: VO (EU) 2021/82 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte (ausgedrückt als 6"-Sialyllactose) |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "6"-Sialyllactose-Natriumsalz".
Die Kennzeichnung von Nahrungsergänzungsmitteln, die 6"-Sialyllactose (6"-SL) -Natriumsalz enthalten, muss mit dem Hinweis versehen sein, dass diese nicht verzehrt werden sollten
- bei Verzehr von Lebensmitteln mit zugesetztem 6"-Sialyllactose-Natriumsalz am selben Tag;
- von Säuglingen und Kleinkindern
|
|
Zugelassen am 17. Februar 2021. Diese Aufnahme erfolgt auf der Grundlage geschützter wissenschaftlicher Erkenntnisse und wissenschaftlicher Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen.
Antragsteller: Glycom A/S, Kogle Allé 4, 2970 Hørsholm, Dänemark. Solange der Datenschutz gilt, darf das neuartige Lebensmittel 6"-Sialyllactose-Natriumsalz nur von Glycom A/S in der Union in Verkehr gebracht werden, es sei denn, ein späterer Antragsteller erhält die Zulassung für das neuartige Lebensmittel ohne Bezugnahme auf die wissenschaftlichen Erkenntnisse oder wissenschaftlichen Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen, oder er hat die Zustimmung von Glycom A/S.
Zeitpunkt, zu dem der Datenschutz erlischt: 17. Februar 2026. |
| Nicht aromatisierte pasteurisierte und nicht aromatisierte (auch durch Ultrahocherhitzung) sterilisierte Milcherzeugnisse |
0,5 g/l |
| Nicht aromatisierte fermentierte Erzeugnisse auf Milchbasis |
0,5 g/l (Getränke) |
| 2,5 g/kg (andere Erzeugnisse als Getränke) |
| Aromatisierte fermentierte Erzeugnisse auf Milchbasis, auch wärmebehandelt |
0,5 g/l (Getränke) |
| 5,0 g/kg (andere Erzeugnisse als Getränke) |
| Getränke (aromatisierte Getränke außer Getränken mit einem pH-Wert unter 5) |
0,5 g/l |
| Getreideriegel |
5,0 g/kg |
| Säuglingsanfangsnahrung im Sinne der Verordnung (EU) Nr. 609/2013 |
0,4 g/l im verzehrfertigen Enderzeugnis, das als solches in Verkehr gebracht oder nach Anweisung des Herstellers rekonstituiert wird |
| Folgenahrung im Sinne der Verordnung (EU) Nr. 609/2013 |
0,3 g/l im verzehrfertigen Enderzeugnis, das als solches in Verkehr gebracht oder nach Anweisung des Herstellers rekonstituiert wird |
| Getreidebeikost und andere Beikost für Säuglinge und Kleinkinder im Sinne der Verordnung (EU) Nr. 609/2013 |
0,3 g/l (Getränke) im verzehrfertigen Enderzeugnis, das als solches in Verkehr gebracht oder nach Anweisung des Herstellers rekonstituiert wird |
| 2,5 g/kg für andere Erzeugnisse als Getränke |
| Getränke auf Milchbasis und gleichartige Erzeugnisse, die für Kleinkinder bestimmt sind |
0,3 g/l (Getränke) im verzehrfertigen Enderzeugnis, das als solches in Verkehr gebracht oder nach Anweisung des Herstellers rekonstituiert wird |
| Tagesrationen für eine gewichtskontrollierende Ernährung im Sinne der Verordnung (EU) Nr. 609/2013 |
1,0 g/l (Getränke) |
| 10,0 g/kg (andere Erzeugnisse als Getränke) |
| Lebensmittel für besondere medizinische Zwecke im Sinne der Verordnung (EU) Nr. 609/2013 |
Entsprechend den besonderen Ernährungsbedürfnissen des Personenkreises, für den die Erzeugnisse bestimmt sind |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG, ausgenommen solche für Säuglinge und Kleinkinder |
1,0 g/Tag |
| Zugelassenes neuartiges Lebensmittel |
Bedingungen, unter denen das neuartige Lebensmittel verwendet werden darf |
zusätzliche spezifische Kennzeichnungsvorschriften |
sonstige Anforderungen |
Datenschutz |
| Getrocknete Larven von Tenebrio molitor (Mehlkäfer)
Stand: VO (EU) 2021/882 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
- Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Getrocknete Larven von Tenebrio molitor (Mehlkäfer)".
- Die Kennzeichnung der Lebensmittel, die getrocknete Larven von Tenebrio molitor (Mehlkäfer) enthalten, muss mit dem Hinweis versehen sein, dass diese Zutat bei Verbrauchern mit bekannten Allergien gegen Krebstiere und ihre Erzeugnisse sowie gegen Hausstaubmilben allergische Reaktionen hervorrufen kann. Dieser Hinweis muss in unmittelbarer Nähe der Zutatenliste angebracht werden.
|
|
Zugelassen am 22. Juni 2021. Diese Aufnahme erfolgt auf der Grundlage geschützter wissenschaftlicher Erkenntnisse und wissenschaftlicher Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen.
Antragsteller: SAS EAP Group, 35 Boulevard du Libre Échange, 31650 Saint-Orens-de-Gameville, Frankreich.
Solange der Datenschutz gilt, darf das neuartige Lebensmittel nur von SAS EAP Group in der Union in Verkehr gebracht werden, es sei denn, ein späterer Antragsteller erhält die Zulassung für das neuartige Lebensmittel ohne Bezugnahme auf die wissenschaftlichen Erkenntnisse oder wissenschaftlichen Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen, oder er hat die Zustimmung von SAS EAP Group.
Zeitpunkt, zu dem der Datenschutz erlischt: 22. Juni 2026. |
| Getrocknete Larven von Tenebrio molitor (Mehlkäfer), ganz oder in Pulverform |
|
| Proteinerzeugnisse |
10 g/100 g |
| Kekse |
10 g/100 g |
| Gerichte aus Leguminosen |
10 g/100 g |
| Erzeugnisse aus Teigwaren |
10 g/100 g |
| Tetrahydrocurcuminoide
Stand: VO (EU) 2022/961 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Tetrahydrocurcuminoide".
Die Kennzeichnung von Nahrungsergänzungsmitteln, die Tetrahydrocurcuminoide enthalten, muss mit dem Hinweis versehen sein, dass
- sie nur von Erwachsenen, ausgenommen Schwangere und Stillende, verzehrt werden sollten;
- sie nicht verzehrt werden sollten, wenn am selben Tag andere Nahrungsergänzungsmittel verzehrt werden, die Curcumin und/oder Curcuminoide enthalten.
|
|
Zugelassen am 11. Juli 2022. Diese Aufnahme erfolgt auf der Grundlage geschützter wissenschaftlicher Erkenntnisse und wissenschaftlicher Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen.
Antragsteller: Sabinsa Europe GmbH, Monzastraße 4, 63225 Langen, Deutschland. Solange der Datenschutz gilt, darf das neuartige Lebensmittel Tetrahydrocurcuminoide nur von Sabinsa Europe GmbH in der Union in Verkehr gebracht werden, es sei denn, ein späterer Antragsteller erhält die Zulassung für das neuartige Lebensmittel ohne Bezugnahme auf die wissenschaftlichen Erkenntnisse oder wissenschaftlichen Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen, oder er hat die Zustimmung von Sabinsa Europe GmbH.
Zeitpunkt, zu dem der Datenschutz erlischt: 11. Juli 2027. |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG für Erwachsene, ausgenommen Schwangere und Stillende |
140 mg/Tag |
| Getrocknete MikroalgenTetraselmis chuii |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Getrocknete MikroalgenTetraselmis chuii" oder "Getrocknete MikroalgenT. chuii".
Auf Nahrungsergänzungsmitteln, die getrocknete MikroalgenTetraselmis chuii enthalten, ist folgende Angabe zu machen: "Enthält geringfügige Mengen an Iod.". |
|
|
| Soßen |
20 % oder 250 mg/Tag |
| Spezialsalze |
1 % |
| Würzmittel |
250 mg/Tag |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
250 mg/Tag |
| Therapon barcoo/Omega-Barsch |
Wird verwendet wie Lachs, also für die Zubereitung kulinarischer Fischgerichte und -erzeugnisse (gekocht, roh, geräuchert und gebraten) |
|
|
|
| D-Tagatose |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
- Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "D-Tagatose".
- Alle Produkte, deren Gehalt an D-Tagatose 15 g pro Portion übersteigt und alle Getränke mit mehr als 1 % D-Tagatose (wie verzehrt) müssen den Hinweis tragen: "kann bei übermäßigem Verzehr abführend wirken.
|
|
|
| Keine Angabe |
| Stark taxifolinhaltiger Extrakt
Stand: VO (EU) 2020/1559 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Stark taxifolinhaltiger Extrakt". |
|
|
| Naturjoghurt/Joghurt mit Obst * |
0,020 g/kg |
| Kefir * |
0,008 g/kg |
| Buttermilch * |
0,005 g/kg |
| Milchpulver * |
0,052 g/kg |
| Sahne * |
0,070 g/kg |
| Sauerrahm * |
0,050 g/kg |
| Käse * |
0,090 g/kg |
| Butter * |
0,164 g/kg |
| Schokoladenerzeugnisse |
0,070 g/kg |
| Nichtalkoholische Getränke |
0,020 g/L |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG für die allgemeine Bevölkerung, ausgenommen Säuglinge, Kleinkinder, Kinder und Jugendliche unter 14 Jahren |
100 mg/Tag |
| *) Bei Verwendung in Milcherzeugnissen darf stark taxifolinhaltiger Extrakt keinen der Milchbestandteile vollständig oder teilweise ersetzen. |
| Trehalose |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
- Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Trehalose", was in der Kennzeichnung des Produkts als solches sowie in der Zutatenliste der das Produkt enthaltenden Lebensmittel erscheinen muss.
- Zusätzlich zu der Bezeichnung des neuartigen Lebensmittels ist in der Kennzeichnung der Hinweis anzubringen: "Trehalose ist eine Glucosequelle".
|
|
|
| Keine Angabe |
| UV-behandelte Pilze (Agaricus bisporus)
Stand: VO (EU) 2020/1559 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalt an Vitamin D2 |
- Die Bezeichnung, die in der Kennzeichnung des neuartigen Lebensmittels oder des jeweiligen Lebensmittels anzugeben ist, lautet "UV-behandelte Pilze (Agaricus bisporus)".
- Zusätzlich zu der Bezeichnung ist in der Kennzeichnung des neuartigen Lebensmittels als solches bzw. des jeweiligen Lebensmittels der Hinweis anzubringen "der Vitamin-D-Gehalt wurde durch kontrollierte Exposition gegenüber UV-Licht erhöht" oder "der Vitamin-D2-Gehalt wurde durch UV-Behandlung erhöht".
|
|
|
| Pilze (Agaricus bisporus) |
20 µg Vitamin D2/100 g Frischgewicht |
| UV-behandelte Bäckerhefe (Saccharomyces cerevisiae)
Stand: VO"en (EU) 2022/196; 2020/1559 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte an Vitamin D2 |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Vitamin-D-Hefe" oder "Vitamin-D2-Hefe". |
|
|
| Hefe-getriebenes Brot und Hefegetriebene Brötchen |
5 μg/100 g |
| Hefe-getriebene Feinbackwaren |
5 μg/100 g |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
Gemäß der Richtlinie 2002/46/EG |
| Vorverpackte frische oder getrocknete Hefe für das Backen zu Hause |
45 μg/100 g für frische Hefe
200 μg/100 g für getrocknete Hefe |
- Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Vitamin-D-Hefe" oder "Vitamin-D2-Hefe".
- Die Kennzeichnung des neuartigen Lebensmittels enthält einen Hinweis darauf, dass das Lebensmittel ausschließlich zum Backen bestimmt ist und nicht roh verzehrt werden sollte.
- Die Kennzeichnung des neuartigen Lebensmittels enthält Gebrauchsanweisungen für den Endverbraucher, sodass die maximale Konzentration von 5 μg/100 g Vitamin D2 in selbstgebackenen Endprodukten nicht überschritten wird.
|
| Gerichte, einschl. Fertiggerichte (ausgenommen Suppen und Salate) |
3 μg/100 g |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Vitamin-D-Hefe" oder "Vitamin-D2-Hefe"." |
| Suppen und Salate |
5 μg/100 g |
| Frittierte oder extrudierte Erzeugnisse auf der Basis von Getreide, Samen oder Wurzeln |
5 μg/100 g |
| Säuglingsanfangsnahrung und Folgenahrung im Sinne der Verordnung (EU) Nr. 609/2013 |
Gemäß der Verordnung (EU) Nr. 609/2013 |
| Getreidebeikost im Sinne der Verordnung (EU) Nr. 609/2013 |
Gemäß der Verordnung (EU) Nr. 609/2013 |
| Verarbeitungserzeugnisse aus Obst |
1,5 μg/100 g |
| Verarbeitetes Gemüse |
2 μg/100 g |
| Brot und ähnliche Produkte |
5 μg/100 g |
| Frühstückscerealien |
4 μg/100 g |
| Teigwaren, Teige und gleichartige Erzeugnisse |
5 μg/100 g |
| Andere Erzeugnisse auf des Basis von Getreide |
3 μg/100 g |
| Gewürze, Würzmittel, Soßenzutaten, Dessertsoßen/toppings |
10 μg/100 g |
| Proteinerzeugnisse |
10 μg/100 g |
| Käse |
2 μg/100 g |
| Dessertspeisen und ähnliche Erzeugnisse auf Milchbasis |
2 μg/100 g |
| Fermentierte Milch oder fermentierter Rahm |
1,5 μg/100 g |
| Milchpulver und -konzentrate |
25 μg/100 g |
| Erzeugnisse auf Milchbasis, Molke und Rahm |
0,5 μg/100 g |
| Analoge von Fleisch und Milchprodukten |
2,5 μg/100 g |
| Tagesrationen für gewichtskontrollierende Ernährung im Sinne der Verordnung (EU) Nr. 609/2013 |
5 μg/100 g |
| Mahlzeitersatz für eine gewichtskontrollierende Ernährung |
5 μg/100 g |
| Lebensmittel für besondere medizinische Zwecke im Sinne der Verordnung (EU) Nr. 609/2013 |
Entsprechend den besonderen Ernährungsbedürfnissen des Personenkreises, für den die Erzeugnisse bestimmt sind |
| UV-behandeltes Brot |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte an Vitamin D2 |
Die Bezeichnung, die in der Kennzeichnung des neuartigen Lebensmittels enthalten ist, ist durch den Hinweis "enthält durch UV-Behandlung erzeugtes Vitamin D" zu ergänzen. |
|
|
| Hefe-getriebenes Brot und Hefe-getriebenes Kleingebäck (ohne Auflage) |
3 µg Vitamin D2/100 g |
| UV-behandelte Milch |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte an Vitamin D3 |
- Die Bezeichnung, die in der Kennzeichnung des neuartigen Lebensmittels anzugeben ist, lautet "UV-behandelt".
- Enthält UV-behandelte Milch eine Menge von Vitamin D, die gemäß Anhang XIII Teil a Nummer 2 der Verordnung (EU) Nr. 1169/2011 des Europäischen Parlaments und des Rates als signifikant erachtet wird, so wird der in der Kennzeichnung anzugebenden Bezeichnung der Hinweis "enthält durch UV-Behandlung erzeugtes Vitamin D" oder "Milch mit durch UV-Behandlung erzeugtem Vitamin D" beigefügt.
|
|
|
| Pasteurisierte Vollmilch im Sinne der Verordnung (EU) Nr. 1308/2013, die als solche verzehrt wird |
5-32 µg/kg für die allgemeine Bevölkerung, ausgenommen Säuglinge |
| Pasteurisierte teilentrahmte Milch im Sinne der Verordnung (EU) Nr. 1308/2013, die als solche verzehrt wird |
1-15 µg/kg für die allgemeine Bevölkerung, ausgenommen Säuglinge |
| Vitamin D2-Pilzpulver
Stand: VO (EU) 2020/1163 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte an Vitamin D2 9 |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Vitamin D enthaltendes, UV-behandeltes Pilzpulver" oder "Vitamin D2 enthaltendes, UV-behandeltes Pilzpulver".
Die Kennzeichnung von Nahrungsergänzungsmitteln, die Vitamin D2-Pilzpulver enthalten, muss mit dem Hinweis versehen sein, dass sie nicht von Säuglingen verzehrt werden sollten. |
|
Zugelassen am 27. August 2020. Diese Aufnahme erfolgt auf der Grundlage geschützter wissenschaftlicher Erkenntnisse und wissenschaftlicher Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen.
Antragsteller: Oakshire Naturals, LP., PO Box 388 Kennett Square, Pennsylvania 19348, Vereinigte Staaten. Solange der Datenschutz gilt, darf das neuartige Lebensmittel "Vitamin D2-Pilzpulver" nur von Oakshire Naturals, LP. in der Union in Verkehr gebracht werden, es sei denn, ein späterer Antragsteller erhält die Zulassung für das neuartige Lebensmittel ohne Bezugnahme auf die wissenschaftlichen Erkenntnisse oder wissenschaftlichen Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen, oder er hat die Zustimmung von Oakshire Naturals, LP.
Zeitpunkt, zu dem der Datenschutz erlischt: 27. August 2025. |
| Frühstückscerealien |
2,25 μg Vitamin D2/100 g |
| Hefe-getriebenes Brot und Gebäck |
2,25 μg Vitamin D2/100 g |
| Getreideerzeugnisse und Teigwaren |
2,25 μg Vitamin D2/100 g |
| Fruchtsaft und Frucht-/Gemüsesaftmischungen |
1,125 μg Vitamin D2/100 ml |
| Milch und Milchprodukte (ausgenommen Flüssigmilch) |
2,25 μg Vitamin D2/100 g/1,125 μg Vitamin D2/100 ml (Getränke) |
| Käse (ausgenommen Hüttenkäse, Ricottakäse und Hartkäse) |
2,25 μg Vitamin D2/100 g |
| Mahlzeitenersatzriegel und Getränke |
2,25 μg Vitamin D2/100 g/1,125 μg Vitamin D2/100 ml (Getränke) |
| Milchprodukt-Analoge |
2,25 μg Vitamin D2/100 g/1,125 μg Vitamin D2/100 ml (Getränke) |
| Fleisch-Analoge |
2,25 μg Vitamin D2/100 g |
| Suppen und Brühen |
2,25 μg Vitamin D2/100 g |
| Extrudierte Gemüsesnacks |
2,25 μg Vitamin D2/100 g |
| Lebensmittel für besondere medizinische Zwecke im Sinne der Verordnung (EU) Nr. 609/2013, ausgenommen Lebensmittel für Säuglinge |
15 μg/Tag |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG für die allgemeine Bevölkerung, ausgenommen Säuglinge |
15 μg/Tag |
| Vitamin D2-Pilzpulver
Stand: VO (EU) 2021/2079 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte an Vitamin D2 |
- Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Vitamin D2 enthaltendes, UV-behandeltes Pilzpulver".
- Die Kennzeichnung von Nahrungsergänzungsmitteln, die Vitamin D2-Pilzpulver enthalten, muss mit dem Hinweis versehen sein, dass sie nicht von Säuglingen und Kindern unter 3 Jahren verzehrt werden sollten.
|
|
Zugelassen am 19. Dezember 2021. Diese Aufnahme erfolgt auf der Grundlage geschützter wissenschaftlicher Erkenntnisse und wissenschaftlicher Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen.
Antragsteller: MBio, Monaghan Mushrooms, Tullygony, Tyholland, Co. Monaghan, Irland. Solange der Datenschutz gilt, darf das neuartige Lebensmittel "Vitamin D2-Pilzpulver" innerhalb der Union nur von MBio, Monaghan Mushrooms in Verkehr gebracht werden, es sei denn, ein späterer Antragsteller erhält die Zulassung für das neuartige Lebensmittel ohne Bezugnahme auf die wissenschaftlichen Erkenntnisse oder wissenschaftlichen Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen, oder er hat die Zustimmung von MBio, Monaghan Mushrooms.
Zeitpunkt, zu dem der Datenschutz erlischt: 19. Dezember 2026; |
| Frühstückscerealien |
2,1 μg/100 g |
| Hefegetriebenes Brot und gleichartiges Gebäck |
2,1 μg/100 g |
| Getreideerzeugnisse und Teigwaren und gleichartige Erzeugnisse |
2,1 μg/100 g |
| Frucht- und Gemüsesäfte und Frucht- und Gemüsenektare |
1,1 μg/100 ml (als solches in Verkehr gebracht oder nach Anweisung des Herstellers rekonstituiert) |
| Milchprodukte und Milchprodukt-Analoge für andere Erzeugnisse als Getränke |
2,1 μg/100 g (als solches in Verkehr gebracht oder nach Anweisung des Herstellers rekonstituiert) |
| Milchprodukte und Milchprodukt-Analoge als Getränke |
1,1 μg/100 ml (als solches in Verkehr gebracht oder nach Anweisung des Herstellers rekonstituiert) |
| Milch und Milchpulver |
21,3 μg/100 g (als solches in Verkehr gebracht oder nach Anweisung des Herstellers rekonstituiert) |
| Fleisch-Analoge |
2,1 μg/100 g |
| Suppen |
2,1 μg/100 ml (als solches in Verkehr gebracht oder nach Anweisung des Herstellers rekonstituiert) |
| Extrudierte Gemüsesnacks |
2,1 μg/100 g |
| Mahlzeitersatz für eine gewichtskontrollierende Ernährung |
2,1 μg/100 g |
| Lebensmittel für besondere medizinische Zwecke im Sinne der Verordnung (EU) Nr. 609/2013, ausgenommen Lebensmittel für Säuglinge |
Entsprechend den besonderen Ernährungsbedürfnissen des Personenkreises, für den die Produkte bestimmt sind |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG, ausgenommen solche für Säuglinge und Kleinkinder |
15 μg Vitamin D2/Tag |
| Vitamin-D2-Pilzpulver
Stand: VO (EU) 2023/4 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte an Vitamin D2 (μg/100 g oder 100 ml) |
- Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Vitamin D2 enthaltendes, UV-behandeltes Pilzpulver".
- Die Kennzeichnung von Nahrungsergänzungsmitteln, die das Vitamin-D2-Pilzpulver enthalten, muss mit dem Hinweis versehen sein, dass sie nicht von Säuglingen und Kindern unter drei Jahren verzehrt werden sollten.
|
|
Zugelassen am 24. Januar 2023. Diese Aufnahme erfolgt auf der Grundlage geschützter wissenschaftlicher Erkenntnisse und wissenschaftlicher Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen.
Antragsteller: Monterey Mushrooms Inc, 260 Westgate Drive Watsonville, Ca 95076, Vereinigte Staaten.
Solange der Datenschutz gilt, darf das neuartige Lebensmittel "Vitamin-D2-Pilzpulver" nur von Monterey Mushrooms Inc in der Union in Verkehr gebracht werden, es sei denn, ein späterer Antragsteller erhält die Zulassung für das neuartige Lebensmittel ohne Bezugnahme auf die geschützten wissenschaftlichen Erkenntnisse oder wissenschaftlichen Daten, die dem Datenschutz gemäß Artikel 26 der Verordnung (EU) 2015/2283 unterliegen, oder er hat die Zustimmung von Monterey Mushrooms Inc.
Zeitpunkt, zu dem der Datenschutz erlischt: 24. Januar 2028. |
| Milch-Analoge |
1,1 |
| Andere Milchprodukt-Analoge als Milch |
2,2 |
| Frühstückscerealien und Getreideriegel |
2,2 |
| Suppen |
2,2 |
| Trockensuppen |
22,5 |
| Molkepulver |
14,1 |
| Frucht- und Gemüsesäfte und Frucht- und Gemüsenektare |
1,1 |
| Frucht-/Gemüsesaftpulver |
12,4 |
| Frucht-/Gemüsesaftkonzentrat (flüssig) |
3,4 |
| Erfrischungsgetränke, die im Zusammenhang mit körperlicher Betätigung vermarktet werden, und fermentierte nichtalkoholische Getränke (außer fermentierten Getränken auf Milchbasis) |
1,1 |
| Lebensmittel für besondere medizinische Zwecke im Sinne der Verordnung (EU) Nr. 609/2013, ausgenommen Lebensmittel für Säuglinge |
Entsprechend den besonderen Ernährungsbedürfnissen des Personenkreises, für den die Erzeugnisse bestimmt sind, aber höchstens 15 μg/Tag |
Tagesrationen für gewichtskontrollierende Ernährung im Sinne der
Verordnung (EU) Nr. 609/2013 |
15 μg/Tag |
| Mahlzeitersatz für eine gewichtskontrollierende Ernährung |
5 μg/Mahlzeit |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG, ausgenommen solche für Säuglinge und Kleinkinder |
15 μg/Tag |
| Vitamin K2 (Menachinon) |
Im Einklang mit der Richtlinie 2002/46/EG, der Verordnung (EU) Nr. 609/2013 und/oder der Verordnung (EG) Nr. 1925/2006 zu verwenden |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Menachinon" oder "Vitamin K2". |
|
|
| Extrakt aus Weizenkleie |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Extrakt aus Weizenkleie". |
"Extrakt aus Weizenkleie" darf nicht als Nahrungsergänzungsmittel oder als Zutat in Nahrungsergänzungsmitteln in Verkehr gebracht werden. Er darf auch nicht Säuglingsnahrung zugesetzt werden. |
|
| Bier und verwandte Produkte |
0,4 g/100 g |
| Fertiggetreideprodukte |
9 g/100 g |
| Milchprodukte |
2,4 g/100 g |
| Obst- und Gemüsesäfte |
0,6 g/100 g |
| Erfrischungsgetränke |
0,6 g/100 g |
| Fleischzubereitungen |
2 g/100 g |
| Xylo-Oligosaccharide
Stand: VO (EU) 2020/916 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte ** |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Xylo-Oligosaccharide". |
|
|
| Weißbrot |
14 g/kg |
| Vollkornbrot |
14 g/kg |
| Frühstückscerealien |
14 g/kg |
| Kekse |
14 g/kg |
| Sojagetränke |
3,5 g/kg |
| Joghurt * |
3,5 g/kg |
| Fruchtaufstriche |
30 g/kg |
| Schokoladenerzeugnisse |
30 g/kg |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG für die allgemeine erwachsene Bevölkerung |
2 g/Tag |
*) Bei Verwendung in Milcherzeugnissen dürfen Xylo-Oligosaccharide keinen der Milchbestandteile vollständig oder teilweise ersetzen.
**) Höchstgehalte berechnet auf der Grundlage der Spezifikationen der Pulverform 1. |
| Biomasse der Hefe Yarrowia lipolytica
Stand: VO (EU) 2023/938 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
- Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Biomasse der Hefe Yarrowia lipolytica".
- Die Kennzeichnung von Mahlzeitersatz für eine gewichtskontrollierende Ernährung, die Biomasse der Hefe Yarrowia lipolytica enthalten, muss den Hinweis tragen, dass dieser nur von Personen über 18 Jahren verwendet und nicht verwendet werden sollte, wenn bereits am selben Tag Nahrungsergänzungsmittel, die Biomasse der Hefe Yarrowia lipolytica enthalten, eingenommen worden waren.
|
|
|
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG, ausgenommen solche für Säuglinge und Kleinkinder |
6 g/Tag für Kinder ab 10 Jahren, Jugendliche und die allgemeine erwachsene Bevölkerung
3 g/Tag für Kinder im Alter von 3 bis 9 Jahren |
| Mahlzeitersatz zur Gewichtskontrolle für die erwachsene Bevölkerung |
3 g/Mahlzeit (maximal 2 Mahlzeiten/Tag bis zu einer Höchstmenge von 6 g/Tag) |
| Selenhaltige Biomasse der Hefe Yarrowia lipolytica
Stand: VO (EU) 2020/1993 |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Selenhaltige Biomasse der Hefe Yarrowia lipolytica".
Die Kennzeichnung von Nahrungsergänzungsmitteln, die selenhaltige Biomasse der Hefe Yarrowia lipolytica enthalten, muss den Hinweis enthalten, dass die Nahrungsergänzungsmittel nicht von Säuglingen und Kindern unter 4 Jahren/Kindern unter 7 Jahren/Kindern unter 11 Jahren/Kindern und Jugendlichen unter 18 Jahren verzehrt werden sollten *. |
|
|
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG 1, ausgenommen Nahrungsergänzungsmittel für Säuglinge und Kleinkinder unter 4 Jahren |
50 mg/Tag für Kinder von 4 bis 6 Jahren, was 10μg Selen pro Tag entspricht
100 mg/Tag für Kinder von 7 bis 10 Jahren, was 20μg Selen pro Tag entspricht
500 mg/Tag für Jugendliche von 11 bis 17 Jahren, was 100μg Selen pro Tag entspricht
800 mg/Tag für Erwachsene, was 160μg Selen pro Tag entspricht |
| 1) Richtlinie 2002/46/EG des Europäischen Parlaments und des Rates vom 10. Juni 2002 zur Angleichung der Rechtsvorschriften der Mitgliedstaaten über Nahrungsergänzungsmittel (ABl. L 183 vom 12.07.2002 S. 51).
__
*) Je nach Altersgruppe, für die das Nahrungsergänzungsmittel bestimmt ist. |
| Hefe-Beta-Glucane |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte an reinen Beta-Glucanen aus Hefe (Saccharomyces cervisiae) |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Beta-Glucane aus Hefe (Saccharomyces cerevisiae)". |
|
|
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG, ausgenommen solche für Säuglinge und Kleinkinder |
1,275 g/Tag für Kinder über 12 Jahren und die allgemeine erwachsene Bevölkerung
0,675 g/Tag für Kinder unter 12 Jahren |
| Tagesrationen für eine gewichtskontrollierende Ernährung im Sinne der Verordnung (EU) Nr. 609/2013 |
1,275 g/Tag |
| Lebensmittel für besondere medizinische Zwecke gemäß der Verordnung (EU) Nr. 609/2013, ausgenommen Lebensmittel für besondere medizinische Zwecke für Säuglinge und Kleinkinder |
1,275 g/Tag |
| Getränke auf Frucht- und/oder Gemüsesaftbasis, einschließlich Konzentrat und dehydrierte Säfte |
1,3 g/kg |
| Getränke mit Fruchtgeschmack |
0,8 g/kg |
| Pulver für die Zubereitung von Kakaogetränken |
38,3 g/kg (Pulver) |
| Sonstige Getränke |
0,8 g/kg (trinkfertig) |
| 7 g/kg (Pulver) |
| Getreideriegel |
6 g/kg |
| Frühstückscerealien |
15,3 g/kg |
| Ballaststoffreiche warm zuzubereitende Instant-Vollkorn-Frühstückscerealien |
1,5 g/kg |
| Kekse |
6,7 g/kg |
| Kräcker |
6,7 g/kg |
| Getränke auf Milchbasis |
3,8 g/kg |
| Fermentierte Milchprodukte |
3,8 g/kg |
| Milchprodukt-Analoge |
3,8 g/kg |
| Trockenmilch/Milchpulver |
25,5 g/kg |
| Suppen und Suppenmischungen |
0,9 g/kg (verzehrfertig) |
| 1,8 g/kg (kondensiert) |
| 6,3 g/kg (Pulver) |
| Schokolade und Süßwaren |
4 g/kg |
| Proteinriegel und -pulver |
19,1 g/kg |
| Konfitüren, Marmeladen und andere Fruchtaufstriche |
11,3 g/kg |
| Zeaxanthin |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Zeaxanthin". |
|
|
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
2 mg/Tag |
| Zink-L-pidolat |
Spezifizierte Lebensmittelkategorie |
Höchstgehalte |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Zink-L-pidolat". |
|
|
| Lebensmittel im Sinne der Verordnung (EU) Nr. 609/2013 |
3 g/Tag |
| Getränke auf Milchbasis und gleichartige Erzeugnisse, die für Kleinkinder bestimmt sind |
| Mahlzeitersatz für eine gewichtskontrollierende Ernährung |
| Lebensmittel zur Deckung des Energiebedarfs bei intensiver Muskelanstrengung, vor allem für Sportler |
| Lebensmittel mit Angaben über das Nichtvorhandensein oder das reduzierte Vorhandensein von Gluten gemäß den Anforderungen der Durchführungsverordnung (EU) Nr. 828/2014 der Kommission |
| Nahrungsergänzungsmittel im Sinne der Richtlinie 2002/46/EG |
| Zucker aus dem Fruchtfleisch der Kakaopflanze (Theobroma cacao L.)
Stand: VO (EU) 2020/1634 |
Keine Angabe |
Die Bezeichnung des neuartigen Lebensmittels, die in der Kennzeichnung des jeweiligen Lebensmittels anzugeben ist, lautet "Zucker aus dem Fruchtfleisch der Kakaopflanze (Theobroma cacao L.)", "Glucose aus dem Fruchtfleisch der Kakaopflanze (Theobroma cacao L.)" oder "Fructose aus dem Fruchtfleisch der Kakaopflanze (Theobroma cacao L.)", je nach der verwendeten Form. |
|
|
| 1) Verordnung (EU) Nr. 609/2013 des Europäischen Parlaments und des Rates vom 12. Juni 2013 über Lebensmittel für Säuglinge und Kleinkinder, Lebensmittel für besondere medizinische Zwecke und Tagesrationen für gewichtskontrollierende Ernährung und zur Aufhebung der Richtlinie 92/52/EWG des Rates, der Richtlinien 96/8/EG, 1999/21/EG, 2006/125/EG und 2006/141/EG der Kommission, der Richtlinie 2009/39/EG des Europäischen Parlaments und des Rates sowie der Verordnungen (EG) Nr. 41/2009 und (EG) Nr. 953/2009 der Kommission (ABl. Nr. L 181 vom 29.06.2013 S. 35).
2) Durchführungsverordnung (EU) Nr. 828/2014 der Kommission vom 30. Juli 2014 über die Anforderungen an die Bereitstellung von Informationen für Verbraucher über das Nichtvorhandensein oder das reduzierte Vorhandensein von Gluten in Lebensmitteln (ABl. Nr. L 228 vom 31.07.2014 S. 5).
3) Richtlinie 2002/46/EG des Europäischen Parlaments und des Rates vom 10. Juni 2002 zur Angleichung der Rechtsvorschriften der Mitgliedstaaten über Nahrungsergänzungsmittel (ABl. Nr. L 183 vom 12.07.2002 S. 51).
4) Verordnung (EG) Nr. 1925/2006 des Europäischen Parlaments und des Rates vom 20. Dezember 2006 über den Zusatz von Vitaminen und Mineralstoffen sowie bestimmten anderen Stoffen zu Lebensmitteln (ABl. Nr. L 404 vom 30.12.2006 S. 26).
5) 2001/113/EG des Rates vom 20. Dezember 2001 über Konfitüren, Gelees, Marmeladen und Maronenkrem für die menschliche Ernährung (ABl. Nr. L 10 vom 12.01.2002 S. 67).
6) Verordnung (EU) Nr. 1308/2013 des Europäischen Parlaments und des Rates vom 17. Dezember 2013 über eine gemeinsame Marktorganisation für landwirtschaftliche Erzeugnisse und zur Aufhebung der Verordnungen (EWG) Nr. 922/72, (EWG) Nr. 234/79, (EG) Nr. 1037/2001 und (EG) Nr. 1234/2007 (ABl. Nr. L 347 vom 20.12.2013 S. 671).
7) Verwendungshöchstmengen im verzehrfertigen Enderzeugnis, das als solches in Verkehr gebracht oder nach Anweisung des Herstellers rekonstituiert wird
8) Richtlinie 2001/112/EG des Rates vom 20. Dezember 2001 über Fruchtsäfte und bestimmte gleichartige Erzeugnisse für die menschliche Ernährung (ABl. L 10 vom 12.01.2002 S. 58).
9) Die Mindestspezifikation für den Vitamin-D-Gehalt in Vitamin D2-Pilzpulver von 1.000 μg Vitamin D2/Gramm Pilzpulver wird verwendet.
10) Unbeschadet der Bestimmungen der Verordnung (EU) Nr. 609/2013 und der Verordnung (EU) 2016/127.
11) keine traditionelle Verwendung des Lebensmittels. |
| .Zugelassenes neuartiges Lebensmittel |
.Spezifikation |
| N-Acetyl-D-Neuraminsäure |
Beschreibung:
N-Acetyl-D-Neuraminsäure ist ein weißes bis cremefarbenes, kristallines Pulver.
Definition:
Chemische Bezeichnung:
IUPAC-Bezeichnungen:
N-Acetyl-D-Neuraminsäure (Dihydrat)
5-Acetamido-3,5-didesoxy-D-glycero-D-galacto-non-2-ulopyranosonsäure (Dihydrat)
Synonyme:
Sialinsäure (Dihydrat)
Chemische Formel:
C11H19NO9 (Säure)
C11H23NO11 (C11H19NO9 * 2H2O) (Dihydrat)
Molmasse:
309,3 Da (Säure) 345,3 (309,3 + 36,0) (Dihydrat)
CAS-Nr.:
131-48-6 (freie Säure) 50795-27-2 (Dihydrat)
Spezifikation:
Beschreibung: weißes bis cremefarbenes, kristallines Pulver
pH (20 °C, 5%ige Lösung): 1,7-2,5
N-Acetyl-D-Neuraminsäure (Dihydrat): > 97,0 %
Wasser (Dihydrat: 10,4 %): ≤ 12,5 % (w/w)
Sulfatasche: < 0,2 % (w/w)
Essigsäure (als freie Säure und/oder Natriumacetat): < 0,5 % (w/w)
Schwermetalle:
Eisen: < 20,0 mg/kg
Blei: < 0,1 mg/kg
Restproteingehalt: < 0,01 % (w/w)
Lösungsmittelreste:
2-Propanol: < 0,1 % (w/w)
Aceton: < 0,1 % (w/w)
Ethylacetat: < 0,1 % (w/w)
Mikrobiologische Kriterien:
Salmonellen: in 25 g nicht nachweisbar
Aerobe mesophile Gesamtkeimzahl: < 500 KBE/g
Enterobakterien: in 10 g nicht nachweisbar
Cronobacter (Enterobacter) sakazakii: in 10 g nicht nachweisbar
Listeria monocytogenes: in 25 g nicht nachweisbar
Bacillus cereus: < 50 KBE/g
Hefen: < 10 KBE/g
Schimmelpilze: < 10 KBE/g
Restgehalt an Endotoxinen: < 10 EU/mg
KBE: koloniebildende Einheiten; EU: Endotoxineinheiten (Endotoxin Units). |
| Getrocknetes Fruchtfleisch vonAdansonia digitata(Baobab) |
Beschreibung/Definition:
Die Früchte werden von Baobab-Bäumen (Adansonia digitata) geerntet. Die harten Schalen werden aufgebrochen und das Fruchtfleisch wird von den Samen und der Schale getrennt. Anschließend wird das Fruchtfleisch gemahlen, in grobe und feine Partikel getrennt (3 bis 600 µ groß) und verpackt.
Typische Nahrungsbestandteile:
Feuchtigkeitsgehalt (Verlust bei Trocknung) (g/100 g): 4,5-13,7
Protein (g/100 g): 1,8-9,3
Fett (g/100 g): 0-1,6
Gesamtkohlenhydrate (g/100 g): 76,3-89,5
Gesamtzucker (als Glucose): 15,2-36,5
Natrium (mg/100 g): 0,1-25,2
Analytische Spezifikationen:
Fremdstoffe: höchstens 0,2 %
Feuchtigkeitsgehalt (Verlust bei Trocknung) (g/100 g): 4,5-13,7
Asche (g/100 g): 3,8-6,6 |
| Extrakt vonAjuga reptans aus Zellkulturen |
Beschreibung/Definition:
Ein hydroalkoholischer Extrakt aus Gewebekulturen vonAjuga reptans L., der im Wesentlichen gleichwertig ist mit Extrakten aus den blühenden oberirdischen Teilen vonAjuga reptans, die aus traditionellen Kulturen gewonnen werden. |
| Akkermansia muciniphila (pasteurisiert)
Stand: VO (EU) 2022/168 |
Beschreibung:
Pasteurisierte Akkermansia muciniphila (Stamm ATCC BAA-835, CIP 107961) werden durch anaerobes Wachstum der Bakterien mit anschließender Pasteurisierung, Zellkonzentration, Kryokonservierung und Gefriertrocknung gewonnen.
Merkmale/Zusammensetzung:
Gesamtzahl der Zellen von A. muciniphila (Zellen/g): 2,5 × 1010 bis 2,5 × 1012
Zahl der lebensfähigen Zellen von A. muciniphila (KBE/g): < 10 (LoD)*
Wasseraktivität: ≤ 0,43
Feuchtigkeit (%): ≤ 12,0
Protein (%): ≤ 35,0
Fett (%): ≤ 4,0
Rohasche (%): ≤ 21,0
Kohlenhydrate (%): 36,0-86,0
Mikrobiologische Kriterien:
Aerobe mesophile Gesamtkeimzahl: ≤ 500 KBE**/g
Sulfitreduzierende Anaerobier: ≤ 50 KBE/g
Koagulasepositive Staphylokokken: ≤ 10 KBE/g
Enterobacteriaceae: ≤ 10 KBE/g
Hefen: ≤ 10 KBE/g
Schimmelpilze: ≤ 10 KBE/g
Bacillus cereus: ≤ 100 KBE/g
Listeria spp.: in 25 g nicht nachweisbar
Salmonella spp.: in 25 g nicht nachweisbar
Escherichia coli: in 1 g nicht nachweisbar
_______
*) LoD: Nachweisgrenze;
**) koloniebildende Einheiten. |
| L-Alanyl-L-Glutamin |
Beschreibung/Definition:
L-Alanyl-L-Glutamin wird gewonnen durch Fermentation mittels eines genetisch veränderten Stamms vonEscherichia coli. Während der Fermentation wird die Zutat in das Wachstumsmedium sekretiert, aus dem es anschließend gelöst und auf eine Konzentration von > 98 % aufgereinigt wird.
Aussehen: weißes kristallines Pulver
Reinheit: > 98 %
Infrarot-Spektroskopie: konform mit Bezugsnorm
Aussehen der Lösung: farblos und klar
Gehalt (Trockenmasse): 98-102 %
Verwandte Stoffe (jeweils): ≤ 0,2 %
Glührückstand: ≤ 0,1 %
Trocknungsverlust: ≤ 0,5 %
Optische Rotation: + 9,0 bis +11,0o
pH (1 %; H2O): 5,0-6,0
Ammonium (NH4): ≤ 0,020 %
Chlorid (Cl): ≤ 0,020 %
Sulfat (SO4): ≤ 0,020 %
Mikrobiologische Kriterien:
Escherichia coli: keine/g |
| Algenöl aus der MikroalgeUlkenia sp. |
Beschreibung/Definition:
Öl aus der MikroalgeUlkenia sp.
Säurezahl: ≤ 0,5 mg KOH/g
Peroxidzahl (PV): ≤ 5,0 meq/kg Öl
Feuchtigkeit und flüchtige Stoffe: ≤ 0,05 %
Unverseifbare Stoffe: ≤ 4,5 %
trans-Fettsäuren: ≤ 1,0 %
DHA-Gehalt: ≥ 32 % |
| Allanblackia-Saatöl
Stand: VO (EU) 2019/110 |
Beschreibung/Definition:
Allanblackia-Saatöl wird aus den Samen der folgendenAllanblackia-Spezies gewonnen: A.floribunda (andere Bezeichnung für A. parviflora) und A. stuhlmannii.
Fettsäurezusammensetzung (als Prozentsatz der Gesamtfettsäuren):
Laurinsäure - Myristinsäure - Palmitinsäure (C12:0 - C14:0 - C16:0): Summe dieser Säuren < 4,0 %
Stearinsäure (C18:0): 45-58 %
Ölsäure (C18:1): 40-51 %
Mehrfach ungesättigte Fettsäuren: < 2 %
Merkmale:
Freie Fettsäuren: max. 0,1 % der Gesamtfettsäuren
trans-Fettsäuren: max. 1,0 % der Gesamtfettsäuren
Peroxidzahl: max. 1,0 meq/kg
Unverseifbare Bestandteile: max 1,0 % (w/w) des Öls
Verseifungszahl: 185-198 mg KOH/g |
| Blattextrakt ausAloe macroclada Baker |
Beschreibung/Definition:
Aus den Blättern vonAloe macroclada Baker gewonnenes Gelextraktpulver ist im Wesentlichen gleichwertig mit demselben Gel, das aus den Blättern vonAloe vera (L.) Burm. f. gewonnen wird.
Asche: 25 %
Ballaststoffe: 28,6 %
Fett: 2,7 %
Feuchtigkeit: 4,7 %
Polysaccharide: 9,5 %
Protein: 1,63 %
Glucose: 8,9 % |
| Larven von Alphitobius diaperinus (Getreideschimmelkäfer), gefroren, als Paste, getrocknet und in Pulverform
Stand: VO (EU) 2023/58 |
Beschreibung/Definition:
Das neuartige Lebensmittel besteht aus ganzem Getreideschimmelkäfer in gefrorener, pastenartiger, getrockneter und pulverisierter Form. Der Begriff "Getreideschimmelkäfer" bezieht sich auf die Larvenform von Alphitobius diaperinus, einer Insektenart, die zur Familie der Tenebrionidae (Schwarzkäfer) gehört.
Die ganzen Getreideschimmelkäfer sind für den menschlichen Verzehr bestimmt, es werden keine Teile entfernt.
Das neuartige Lebensmittel soll in vier verschiedenen Formen vermarktet werden: i) ganze blanchierte und gefrorene Larven von A. diaperinus (ADL gefroren), ii) Paste aus ganzen blanchierten, gemahlenen und gefrorenen Larven von A. diaperinus (ADL Paste), iii) ganze blanchierte und gefriergetrocknete Larven von A. diaperinus (ADL getrocknet) und iv) Pulver aus ganzen blanchierten, gefriergetrockneten und gemahlenen Larven von A. diaperinus (ADL Pulver).
Vor dem Abtöten der Insekten durch eine Hitzebehandlung ist eine Futterkarenz von mindestens 24 Stunden erforderlich, damit die Larven ihren Darminhalt abgeben können. |
| Merkmale/Zusammensetzung (ADL gefroren oder ADL Paste):
Asche (% Massenanteil): ≤ 1,5
Feuchtigkeitsgehalt (% Massenanteil): 65-80
Rohprotein (N × 6,25) (% Massenanteil): 12-25
Verdauliche Kohlenhydrate (% Massenanteil): 0,4-2
Fett (% Massenanteil): 5-12
Peroxidzahl (meq O2/kg Fett): ≤ 0,2
Ballaststoffe (% Massenanteil): 1-4
* Chitin (% Massenanteil): 1,0-2,6
Schwermetalle:
Blei: ≤ 0,1 mg/kg
Cadmium: ≤ 0,05 mg/kg
Mykotoxine:
Aflatoxine (Summe aus B1, B2, G1, G2): ≤ 4 μg/kg
Aflatoxin B1 (μg/kg): ≤ 2
Deoxynivalenol: ≤ 200 μg/kg
Ochratoxin A: ≤ 1 μg/kg
Mikrobiologische Kriterien:
Gesamtzahl der aeroben Bakterien: ≤ 105 ** KBE/g
Hefen und Schimmelpilze: ≤ 100 KBE/g
Escherichia coli: ≤ 50 KBE/g
Salmonella spp.: in 25 g nicht nachweisbar
Listeria monocytogenes: in 25 g nicht nachweisbar
Sulfitreduzierende Anaerobier: ≤ 30 KBE/g
Bacillus cereus: ≤ 100 KBE/g
Enterobacteriaceae: ≤ 100 KBE/g
Koagulasepositive Staphylokokken: ≤ 100 KBE/g |
Merkmale/Zusammensetzung (ADL getrocknet oder ADL Pulver):
Asche (% Massenanteil): ≤ 5
Feuchtigkeitsgehalt (% Massenanteil): 1-5
Rohprotein (N × 6,25) (% Massenanteil): 50-70
Verdauliche Kohlenhydrate (% Massenanteil): 1,5-3,5
Fett (% Massenanteil): 20-35
Peroxidzahl (meq O2/kg Fett): ≤ 5
Ballaststoffe (% Massenanteil): 3-6
* Chitin (% Massenanteil): 3,0-9,1
Schwermetalle:
Blei: ≤ 0,1 mg/kg
Cadmium: ≤ 0,05 mg/kg
Mykotoxine:
Aflatoxine (Summe aus B1, B2, G1, G2): ≤ 4 μg/kg
Aflatoxin B1 (μg/kg): ≤ 2
Deoxynivalenol: ≤ 200 μg/kg
Ochratoxin A: ≤ 1 μg/kg
Mikrobiologische Kriterien:
Gesamtzahl der aeroben Bakterien: ≤ 105 KBE/g
Hefen und Schimmelpilze: ≤ 100 KBE/g
Escherichia coli: ≤ 50 KBE/g
Salmonella spp.: in 25 g nicht nachweisbar
Listeria monocytogenes: in 25 g nicht nachweisbar
Sulfitreduzierende Anaerobier: ≤ 30 KBE/g
Bacillus cereus: ≤ 100 KBE/g
Enterobacteriaceae: ≤ 100 KBE/g
Koagulasepositive Staphylokokken: ≤ 100 KBE/g |
*) Chitin berechnet als Säure-Detergenzienfaser.
**) KBE: koloniebildende Einheiten. |
| Öl aus antarktischem Krill (Euphausia superba)
Stand: VO (EU) 2019/108 |
Beschreibung/Definition:
Zur Gewinnung von Lipidextrakt aus antarktischem Krill (Euphausia superba) wird zerdrückter tiefgefrorener Krill oder getrocknetes Krillmehl einer Lipid-Extraktion mithilfe eines zugelassenen Extraktionsmittels (im Sinne der Richtlinie 2009/32/EG ) unterzogen. Proteine und Krillmaterial werden durch Filtrierung aus dem Lipidextrakt entfernt. Extraktionsmittel und Wasserrückstände werden durch Verdampfung entfernt.
Verseifungszahl: ≤ 230 mg KOH/g
Peroxidzahl (PV): ≤ 3 meq O2/kg Öl
Oxidative Stabilität: Für alle Lebensmittelerzeugnisse, die Öl aus antarktischem Krill (Euphausia superba) enthalten, sollte anhand geeigneter und anerkannter nationaler/internationaler Testmethoden (z.B. AOAC) die oxidative Stabilität nachgewiesen werden.
Feuchtigkeit und flüchtige Stoffe: ≤ 3 % bzw. 0,6, ausgedrückt als Wasseraktivität bei 25 °C
Phospholipide: ≥ 35 % bis < 60 %
trans-Fettsäuren: ≤ 1 %
EPa (Eicosapentaensäure): ≥ 9 %
DHa (Docosahexaensäure): ≥ 5 % |
| Phospholipidreiches Öl aus antarktischem Krill (Euphausia superba) |
Beschreibung/Definition:
Phospholipidreiches Öl wird aus antarktischem Krill (Euphasia superba) gewonnen durch wiederholtes Auswaschen mit einem (gemäß der Richtlinie 2009/32/EG ) zugelassenen Lösungsmittel mit dem Ziel, den Phospholipidgehalt des Öls zu erhöhen. Die Lösungsmittel werden durch Verdampfung aus dem Enderzeugnis entfernt.
Verseifungszahl: ≤230 mg KOH/g
Peroxidzahl (PV): ≤ 3 meq O2/kg Öl
Feuchtigkeit und flüchtige Stoffe: ≤ 3 % bzw. 0,6, ausgedrückt als Wasseraktivität bei 25 °C
Phospholipide: ≥ 60 %
trans-Fettsäuren: ≤ 1 %
EPa (Eicosapentaensäure): ≥ 9 %
DHa (Docosahexaensäure): ≥ 5 % |
| Arachidonsäurereiches Öl aus dem PilzMortierella alpina |
Beschreibung/Definition:
Das klargelbe arachidonsäurereiche Öl wird durch Fermentation aus den nichtgenetisch veränderten Stämmen IS-4, I49-N18, FJRK-MA01 und CBS 210.32 des PilzesMortierella alpina gewonnen, wobei eine geeignete Flüssigkeit eingesetzt wird. Das Öl wird anschließend aus der Biomasse extrahiert und gereinigt.
Arachidonsäure: ≥ 40 Gew.-% des Gesamtfettsäuregehalts
Freie Fettsäuren: ≤ 0,45 % des Gesamtfettsäuregehalts
trans-Fettsäuren: ≤ 0,5 % des Gesamtfettsäuregehalts
Unverseifbare Bestandteile: ≤ 1,5 %
Peroxidzahl (PV): ≤ 5 meq/kg
Anisidinzahl: ≤ 20
Säurezahl: ≤ 1,0 KOH/g
Feuchtigkeit: ≤ 0,5 % |
| Arganöl ausArgania spinosa |
Beschreibung/Definition:
Arganöl ist das Öl, das durch Kaltpressung aus den mandelförmigen Kernen der Früchte vonArgania spinosa (L.) Skeels gewonnen wird. Die Kerne können vor dem Pressen geröstet werden, dürfen aber nicht direkt mit den Flammen in Berührung kommen.
Zusammensetzung:
Palmitinsäure (C16:0): 12-15 %
Stearinsäure (C18:0): 5-7 %
Ölsäure (C18:1): 43-50 %
Linolsäure (C18:2): 29-36 %
Unverseifbare Bestandteile: 0,3-2 %
Gesamtsterole: 100-500 mg/100 g
Gesamttocopherole: 16-90 mg/100 g
Ölsäuregehalt: 0,2-1,5 %
Peroxidzahl (PV): < 10 meq O2/kg |
| Astaxanthinreiches Oleoresin aus der AlgeHaematococcus pluvialis |
Beschreibung/Definition:
Astaxanthin ist ein Carotinoid, das aus der AlgeHaematococcus pluvialis gewonnen wird. Die Alge kann auf unterschiedliche Weise angebaut werden: in geschlossenen Systemen unter Einwirkung von Sonnenlicht oder streng kontrollierter Exposition gegenüber künstlichem Licht, alternativ in offenen Teichen. Die Algenzellen werden geerntet und getrocknet; das Oleoresin wird mittels überkritischem CO2 oder mittels Ethylacetat als Lösungsmittel extrahiert. Das Astaxanthin wird verdünnt und unter Verwendung von Olivenöl, Safloröl, Sonnenblumenöl oder MKT (mittelkettigen Triglyceriden) auf 2,5 %, 5,0 %, 7,0 %, 10 %, 15 % oder 20 % standardisiert.
Zusammensetzung des Oleoresins:
Fett: 42,2-99 %
Protein: 0,3-4,4 %
Kohlenhydrate: 0-52,8 %
Ballaststoffe: < 1,0 %
Asche: 0,0-4,2 %
Spezifikation des Carotenoids in Gew.-%
Gesamtastaxanthine: 2,9-11,1 %
9-cis-Astaxanthin: 0,3-17,3 %
13-cis-Astaxanthin: 0,2-7,0 %
Astaxanthinmonoester: 79,8-91,5 %
Astaxanthindiester: 0,16-19,0 %
Β-Carotin: 0,01-0,3 %
Lutein: 0-1,8 %
Canthaxanthin: 0-1,30 %
Mikrobiologische Kriterien:
Gesamtzahl aerober Bakterien: < 3.000 KBE/g
Hefen und Schimmelpilze: < 100 KBE/g
Coliforme: < 10 KBE/g
E. coli: negativ
Salmonellen: negativ
Staphylococcus: negativ |
| Basilikumsamen (Ocimum basilicum) |
Beschreibung/Definition:
Basilikum (Ocimum basilicum L.) gehört der Familie der Lamiaceae innerhalb der Ordnung der Lippenblütlerartigen (Lamiales) an. Der Samen wird nach der Ernte mechanisch gereinigt. Blüten, Blätter und andere Pflanzenteile werden entfernt. Durch (optisches, mechanisches) Filtern muss Basilikumsamen höchster Reinheit sichergestellt werden. Das Verfahren zur Herstellung von Fruchtsaft und Mischgetränken aus Obst/Gemüse mit Basilikumsamen (Ocimum basilicum) umfasst das Vorquellen und Pasteurisieren des Samens. Es sind mikrobiologische Kontrollen und ein Überwachungssystem vorhanden.
Trockenmasse: 94,1 %
Protein: 20,7 %
Fett: 24,4 %
Kohlenhydrate: 1,7 %
Ballaststoffe: 40,5 % (Verfahren: AOAC 958.29)
Asche: 6,78 % |
| Betain |
Beschreibung/Definition:
Betain (N,N,N-Trimethylglycin oder Carboxy-N,N,N-trimethylmethanaminium), in wasserfreier Form (CH3)3N+CH2COO- (CAS No: 107-43-7) und in Monohydrat-Form (CH3)3N+CH2COO-.H2O (CAS No: 590-47-6), wird bei der Verarbeitung von Zuckerrüben (d. h. Melassen, Vinassen oder Betain-Glycerin) gewonnen.
Merkmale/Zusammensetzung
Aussehen: Frei fließende weiße Kristalle
Betain: ≥ 99,0 % (w/w Trockengewicht)
Feuchtigkeit: ≤ 2,0 % (wasserfrei); ≤ 15,0 % (Monohydrat)
Asche: ≤ 0,1 %
pH-Wert: 5,0 -7,0
Restproteingehalt: 1,0 mg/g
Schwermetalle:
Arsen: < 0,1 mg/kg
Quecksilber: < 0,005 mg/kg
Cadmium: < 0,01 mg/kg
Blei: < 0,05 mg/kg
Mikrobiologische Kriterien:
Gesamtkeimzahl ≤ 100 KBE/g
Coliforme: negativ/10 g
Salmonella-Arten: negativ/25 g
Hefen: ≤ 10 KBE/g
Schimmelpilze: ≤ 10 KBE/g
KBE: koloniebildende Einheiten |
| Fermentierter Extrakt aus schwarzen Bohnen |
Beschreibung/Definition:
Fermentierter Extrakt aus schwarzen Bohnen (Touchi-Extrakt) ist ein feines hellbraunes, proteinreiches Pulver, das mittels Wasserextraktion aus kleinen, mitAspergillus oryzae fermentierten Sojabohnen (Glycine max (L.) Merr.) gewonnen wird. Der Extrakt enthält einen α-Glucosidase-Hemmer.
Merkmale:
Fett: ≤1,0 %
Protein: ≥ 55 %
Wasser: ≤ 7,0 %
Asche: ≤ 10 %
Kohlenhydrate: ≥ 20 %
α-Glucosidase-hemmende Aktivität: IC50 mind. 0,025 mg/ml
Sojaisoflavone: ≤ 0,3 g/100 g |
| Rinder-Lactoferrin |
Beschreibung/Definition:
Rinder-Lactoferrin ist ein Protein, das natürlich in Kuhmilch vorkommt. Es ist ein eisenbindendes Glycoprotein von etwa 77 kDa und besteht aus einer einzigen Polypeptidkette aus 689 Aminosäuren.
Herstellungsverfahren: Rinder-Lactoferrin wird aus entrahmter Milch oder Käsemolke durch Ionenaustausch und anschließende Ultrafiltrationsprozesse isoliert. Dann wird es gefrier- oder sprühgetrocknet, und große Teilchen werden ausgesiebt. Es ist ein nahezu geruchloses, leicht rosafarbenes Pulver.
Physikalisch-chemische Eigenschaften von Rinder-Lactoferrin:
Feuchtigkeit: < 4,5 %
Asche: < 1,5 %
Arsen: < 2,0 mg/kg
Eisen: < 350 mg/kg
Protein: > 93 %
davon Rinder-Lactoferrin: > 95 %
sonstige Proteine: < 5,0 %
pH (2%ige Lösung, 20 °C): 5,2-7,2
Löslichkeit (2%ige Lösung, 20 °C): vollständig |
| Basisches Molkenprotein-Isolat aus Kuhmilch
Stand: VO (EU) 2019/1686 |
Beschreibung
Basisches Molkenprotein-Isolat aus Kuhmilch ist ein gelblich-graues Pulver, gewonnen aus entrahmter Kuhmilch durch aufeinanderfolgende Isolierungs- und Reinigungsschritte.
Merkmale/Zusammensetzung
Gesamtprotein (w/w): ≥ 90 %
Lactoferrin (w/w): 25-75 %
Lactoperoxidase (w/w): 10-40 %
Sonstige Proteine (w/w): ≤ 30 %
TGF-β2: 12-18 mg/100 g
Feuchtigkeitsgehalt: ≤ 6,0 %
pH (Lösung mit 5 % Massenkonzentration): 5,5-7,6
Lactose ≤ 3,0 %
Fett: ≤ 4,5 %
Asche: ≤ 3,5 %
Eisen: ≤ 25 mg/100 g
Schwermetalle
Blei: < 0,1 mg/kg
Cadmium: < 0,2 mg/kg
Quecksilber: < 0,6 mg/kg
Arsen: < 0,1 mg/kg
Mikrobiologische Kriterien:
Aerobe mesophile Gesamtkeimzahl: ≤ 10.000 KBE/g
Enterobacteriaceae: ≤ 10 KBE/g
Escherichia coli: negativ/g
Koagulasepositive Staphylokokken: negativ/g
Salmonellen: negativ/25 g
Listerien: negativ/25 g
Cronobacter spp.: negativ/25 g
Schimmelpilze: ≤ 50 KBE/g
Hefen: ≤ 50 KBE/g |
| Saatöl ausBuglossoides arvensis |
Beschreibung/Definition:
Raffiniertes Öl aus Buglossoides wird aus Samen vonBuglossoides arvensis (L.) I. M. Johnst. gewonnen.
Alpha-Linolensäure: ≥ 35 Gew.-% der Gesamtfettsäuren
Stearidonsäure: ≥ 15 Gew.-% der Gesamtfettsäuren
Linolsäure: ≥ 8,0 Gew.-% der Gesamtfettsäuren
trans-Fettsäuren: ≤ 2,0 Gew.-% der Gesamtfettsäuren
Säurezahl: ≤ 0,6 mg KOH/g
Peroxidzahl (PV): ≤ 5,0 meq O2/kg
Unverseifbare Bestandteile: ≤ 2,0 %
Proteingehalt (Gesamtstickstoff): ≤ 10 µg/ml
Pyrrolizidinalkaloide: Nicht nachweisbar bei einer Nachweisgrenze von 4,0 µg/kg |
| Öl ausCalanus finmarchicus
Stand: VO (EU) 2022/966 |
Beschreibung/Definition:
Das neuartige Lebensmittel ist ein rubinrotes, leicht viskoses Öl mit leichtem Schalentiergeruch, das aus dem Krebstier (marines Zooplankton) Calanus finmarchicus gewonnen wird. Die Zutat besteht hauptsächlich aus Wachsestern (> 85 %) mit geringen Mengen an Triglyceriden und anderen neutralen Lipiden.
Spezifikation:
Wasser: < 1,0 %
Wachsester: > 85 %
Gesamtfettsäuren: > 46 %
Eicosapentaensäure (EPA): > 3,0 %
Docosahexaensäure (DHA): > 4,0 %
Gesamtfettalkohole: > 28 %
C20:1 n-9 Fettalkohol: > 9,0 %
C22:1 n-11 Fettalkohol: > 12 %
trans-Fettsäuren: < 1,0 %
Astaxanthinester: > 0,25 %
Peroxidzahl: < 3,0 meq O2/kg |
| Calcium-L-Methylfolat
Stand: VO"en (EU) 2022/202; 2021/1318 |
Beschreibung:
Das neuartige Lebensmittel wird durch chemische Synthese aus Folsäure hergestellt.
Es handelt sich um ein weißes bis hellgelbliches, fast geruchloses, kristallines Pulver, das in Wasser mäßig löslich ist und in den meisten organischen Lösungsmitteln sehr gering löslich oder unlöslich ist.
Definition:
Chemische Formel: C20H23CaN7O6
Chemische Bezeichnung: N-{4-[[((6S)-2-Amino-1,4,5,6,7,8-hexahydro-5-methyl-4-oxo-6-pteridinyl)methyl]amino]benzoyl}-L-Glutaminsäure, Calciumsalz
CAS-Nummern: 129025-21-4 (Calciumsalz mit nicht spezifiziertem Verhältnis L-5-MTHF/Ca2+) und 151533-22-1 (Calciumsalz mit spezifiziertem 1:1-Verhältnis L-5-MTHF/Ca2+).
Molmasse: 497,5 Daltons
Synonyme: L-Methylfolat, Calcium; L-5-Methyltetrahydrofolsäure, Calciumsalz [(L-5-MTHF-Ca)]; (6S)-5-Methyltetrahydrofolsäure, Calciumsalz [(6S)-5-MTHF-Ca]; (6S)-5-Methyl-5,6,7,8-tetrahydropteroyl-L-Glutaminsäure, Calciumsalz, und L-5-Methyl-tetrahydrofolsäure (L-5-MTHF) ohne Spezifikation des Kations.
Strukturformel: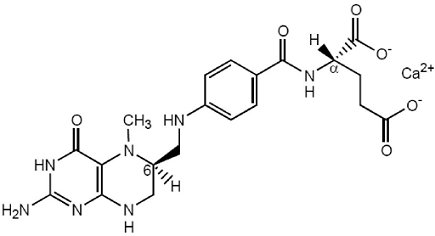
Merkmale
Reinheit: > 95 % (bezogen auf die Trockenmasse)
Wasser: ≤ 17,0 %
Calcium (wasserfrei und lösemittelfrei): 7,0-8,5 %
Calcium-D-Methylfolat (6R, αS-Isomer): ≤ 1,0 %
Andere Folate und verwandte Stoffe: ≤ 2,5 %
Ethanol ≤ 0,5 %
Kontaminanten |
| Säuglinge und Kleinkinder |
Allgemeine Bevölkerung ohne Säuglinge und Kleinkinder |
| Blei: ≤ 1 mg/kg |
Blei: ≤ 1 mg/kg |
| Bor: ≤ 10 mg/kg |
Bor: ≤ 10 mg/kg |
| Cadmium ≤ 0,5 mg/kg |
Cadmium ≤ 0,5 mg/kg |
| Quecksilber: ≤ 1,0 mg/kg |
Quecksilber: ≤ 1,5 mg/kg |
| Arsen: ≤ 1,5 mg/kg |
Arsen: ≤ 1,5 mg/kg |
| Platin: ≤ 2 mg/kg |
Platin: ≤ 10 mg/kg |
| Mikrobiologische Kriterien:
Gesamtkeimzahl: ≤ 1.000 KBE/g
Hefen und Schimmelpilze insgesamt: ≤ 100 KBE/g
KBE: koloniebildende Einheiten |
| Calciumfructoborat
Stand: VO (EU) 2021/2129 |
Beschreibung/Definition
Das neuartige Lebensmittel ist Calciumfructoborat, ein Calciumsalz-Tetrahydrat eines (Bis)Fructose-Esters der Borsäure in Pulverform, mit der Summenformel Ca[(C6H10O6)2B]2•4H2O und einer Molmasse von 846 Da.
Das neuartige Lebensmittel wird durch chemische Synthese gewonnen, indem Fructose mit Borsäure in Wasser kombiniert wird, um durch verschiedene Erhitzungs- und Mischvorgänge einen Bis(Fructose)-Ester der Borsäure herzustellen. Anschließend wird Calciumcarbonat hinzugefügt, um eine Lösung zu erhalten, die das Calciumsalz von Fructoborat (Tetrahydrat) enthält. Die Lösung wird gefriergetrocknet und gemahlen, um das Endprodukt in Pulverform zu erhalten, welches anschließend verpackt und unter repräsentativen Lagerbedingungen (22 ± 1 °C RH 55-60%) gelagert wird.
Merkmale/Zusammensetzung
Freie Feuchtigkeit: < 5,0 %
Calcium: 4,5-5 %
Bor: 2,5-2,9 %
Fructose: 80-85 %
Asche: 15-16 %
Schwermetalle
Arsen: ≤ 1 mg/kg
Mikrobiologische Kriterien
Gesamtkeimzahl: ≤ 1.000 KBE/ga
Hefen und Schimmelpilze: < 100 KBE/g
Coliforme: ≤ 10 KBE/g
Escherichia coli < 10 KBE/g
Salmonella-Arten: in 25 g nicht nachweisbar
Koagulasepositive Staphylokokken: in 1 g nicht nachweisbar
_____
a) KBE: koloniebildende Einheiten |
| Kaubase (Monomethoxypolyethylenglycol) |
Beschreibung/Definition:
Die neuartige Lebensmittelzutat ist ein synthetisches Polymer (Patentnummer WO2006016179). Sie besteht aus verzweigten Polymeren von Monomethoxypolyethylenglycol (MPEG), die auf Polyisopren-g-Maleinsäureanhydrid (PIP-g-MA) gepfropft sind, und aus MPEG in seinem Ausgangszustand (weniger als 35 Gew.-%).
Weiß bis cremefarben.
CAS-Nr.: 1246080-53-4
Merkmale:
Feuchtigkeit: < 5,0 %
Aluminium: < 3,0 mg/kg
Lithium: < 0,5 mg/kg
Nickel: < 0,5 mg/kg
Anhydridrückstände: < 15 µmol/g
Polydispersitätsindex: < 1,4
Isopren: < 0,05 mg/kg
Ethylenoxid: < 0,2 mg/kg
Freies Maleinsäureanhydrid: < 0,1 %
Gesamtoligomere (weniger als 1.000 Dalton): ≤ 50 mg/kg
Ethylenglycol: < 200 mg/kg
Diethylenglycol: < 30 mg/kg
Monoethylenglycolmethylether: < 3,0 mg/kg
Diethylenglycolmethylether: < 4,0 mg/kg
Triethylenglycolmethylether: < 7,0 mg/kg
1,4-Dioxan: < 2,0 mg/kg
Formaldehyd: < 10 mg/kg |
| Kaubase (Methylvinylether/Maleinsäureanhydrid-Copolymer) |
Beschreibung/Definition:
Methylvinylether/Maleinsäureanhydrid-Copolymer ist ein wasserfreies Copolymer von Methylvinylether und Maleinsäure.
Frei fließendes, weißes bis weißgraues Pulver.
CAS-Nr.: 9011-16-9
Reinheit:
Testwert: mindestens 99,5 % in Trockenmasse
Spezifische Viskosität (1 % MEK): 2-10
Methylvinyletherrückstände: ≤ 150 ppm
Maleinsäurerückstände: ≤ 250 ppm
Acetaldehyd: ≤ 500 ppm
Methanol: ≤ 500 ppm
Dilauroylperoxid: ≤ 15 ppm
Schwermetalle insgesamt: ≤ 10 ppm
Mikrobiologische Kriterien:
Gesamtzahl der aeroben Keime: ≤ 500 KBE/g
Schimmelpilze/Hefe: ≤ 500 KBE/g
Escherichia coli: Test mit negativem Befund
Salmonellen: Test mit negativem Befund
Staphylococcus aureus: Test mit negativem Befund
Pseudomonas aeruginosa: Test mit negativem Befund |
| Getrocknete Nüsse von Canarium indicum L. ("Kanaribaum") (Traditionelles Lebensmittel aus einem Drittland)
Stand: VO (EU) 2023/667 |
Beschreibung/Definition:
Das traditionelle Lebensmittel besteht aus verarbeiteten getrockneten Kanarinüssen. Der Begriff "Kanarinüsse" bezieht sich auf die Kerne der reifen Kanarifrucht, bekannt unter der wissenschaftlichen Bezeichnung Canarium indicum L. (oder Canarium amboinense Hochr.) aus der Familie der Burseraceae.
Zusammensetzung:
Asche: ≤ 5 (g/100 g)
Feuchtigkeit: ≤ 6 (g/100 g)
Protein: 12,8-14,4 g/100 g
Kohlenhydrate: 11,0-16,4 g/100 g
Fett: 59,3-66,3 g/100 g
Ballaststoffe: 4,4-9,8 g/100 g
Mikrobiologische Kriterien:
Zahl der aeroben Keime: ≤ 5,0 x 103 KBE/g
Coliforme: < 3 MPN/g
E. coli: < 3 MPN/g
Hefen und Schimmelpilze: < 10 KBE/g
Salmonellen: in 25 g nicht nachweisbar
Staphylococcus aureus (nicht nachweisbar/25 g)
Listeria monocytogenes (nicht nachweisbar/25 g)
Aflatoxine
Aflatoxine B1: ≤ 2 mcg/kg
Aflatoxine (Summe aus B1, B2, G1, G2): ≤ 4 mcg/kg
Dioxine und dioxinähnliche PCB
Summe der Dioxine: ≤ 0,75 pg/g Fett
Summe der Dioxine und dioxinähnlichen PCB: ≤ 1,5 pg/g Fett
Schwermetalle
Cadmium (Cd): ≤ 0,02 mg/kg
Blei (Pb): ≤ 0,07 mg/kg
KBE: koloniebildende Einheiten |
|
| Getrocknete Nüsse von Canarium ovatum Engl.
Stand: VO (EU) 2023/267 |
Beschreibung/Definition:
Das traditionelle Lebensmittel besteht aus den ungerösteten getrockneten Nüssen von Canarium ovatum Engl. (Familie: Burseraceae), gemeinhin als Pilinüsse bekannt. Pilinüsse stammen ausschließlich von Pflanzen der Art Canarium ovatum Engl., und zwar den Sorten Laysa, Magnaye, M. Orolfo, Lanuza und Magayon, und können mit oder ohne Schale in Verkehr gebracht werden. Essbarer Teil der Nuss ist der Kern.
Typische Spannbreite der Zusammensetzung:
Fett: 57-73 %
Protein: 11-15 %
Wasser: 1-5 %
Kohlenhydrate: 8-16,5 %
Asche: 2,8-3,4 %
Mikrobiologische Kriterien:
Schimmelpilze und Hefen: ≤ 100 KBE/g
Gesamtgehalt an Mikroorganismen bei 30 °C: ≤ 10.000 KBE/g
Coliforme: ≤ 100 KBE/g
Escherichia coli: ≤ 10 KBE/g
Staphylococcus aureus: in 25 g nicht nachweisbar
Salmonella spp.: in 25 g nicht nachweisbar
Listeria monocytogenes: in 25 g nicht nachweisbar
Sulfitreduzierende Anaerobier: ≤ 10 KBE/g
KBE: koloniebildende Einheiten |
|
| Cellobiose
Stand: VO (EU) 2023/943 |
Beschreibung/Definition:
Cellobiose ist ein Disaccharid mit zwei durch eine β-(1-4)-glucosidische Bindung verbundenen Glucosemonomeren, das im Rahmen einer zweistufigen enzymatischen Reaktion und anschließender Reinigungsschritte aus Saccharose und Glucose hergestellt wird.
Merkmale/Zusammensetzung:
Cellobiose (Trockenmasse) (%): ≥ 99
Feuchtigkeit (%): < 1
Sonstige identifizierte Zucker (%): ≤ 1
Optische Drehung [α]D (c 10, Wasser): +33-36
Asche (g/100 g): < 0,1
Proteingehalt (g/100 g) < 0,01
Schwermetalle:
Arsen: < 0,1 mg/kg
Mikrobiologische Kriterien:
Gesamtzahl der aeroben Keime (KBE/g): ≤ 1.000
Hefen und Schimmelpilze (KBE/g): ≤ 100
Salmonella (in 25 g): n. n.
Coliforme (KBE/g): ≤ 10
E. coli (in 10 g): n. n.
KBE: koloniebildende Einheiten
n. n.: nicht nachweisbar |
|
| Cetylierte Fettsäuren
Stand: VO (EU) 2022/187 |
Beschreibung/Definition:
Das neuartige Lebensmittel betrifft in erster Linie eine Mischung aus cetylierter Myristinsäure und cetylierter Ölsäure, die aus Cetylalkohol, Myristinsäure und Ölsäure und in geringerem Umfang anderen cetylierten Fettsäuren und anderen Verbindungen aus Olivenöl synthetisiert wird.
Merkmale/Zusammensetzung:
Estergehalt: 70-80 %, davon: Cetyloleat: 22-30 %, Cetylmyristat: 41-56 %
Triglyceride: 22-25 %
Säurezahl (mg KOH/g) ≤ 5
Verseifungszahl (mg KOH/g) 130-150
Mikrobiologische Kriterien:
Gesamtzahl der aeroben Bakterien: ≤ 1.000 KBE/g
Hefen und Schimmelpilze: ≤ 100 KBE/g
KOH: Kaliumhydroxid
KBE: koloniebildende Einheiten |
|
|
|
| Chiaöl ausSalvia hispanica |
Beschreibung/Definition:
Chiaöl wird durch Kaltpressung aus Chiasamen (Salvia hispanica L.) (99,9 % rein) hergestellt. Es werden keine Lösungsmittel verwendet, und das Öl wird nach der Pressung in Absetzbehältern aufgefangen; Verunreinigungen werden dann durch einen Filtrationsprozess entfernt. Die Herstellung kann auch durch Extraktion mit überkritischem CO2 erfolgen.
Herstellungsverfahren:
Hergestellt durch Kaltpressung. Es werden keine Lösungsmittel verwendet, und das Öl wird nach der Pressung in Absetzbehältern aufgefangen; Verunreinigungen werden dann durch einen Filtrationsprozess entfernt.
Säuregehalt (ausgedrückt in Ölsäure): ≤ 2,0 %
Peroxidzahl (PV): ≤ 10 meq/kg
Unlösliche Verunreinigungen: ≤ 0,05 %
Alpha-Linolensäure: ≥ 60 %
Linolsäure: 15-20 % |
| Chiasamen (Salvia hispanica) |
Beschreibung/Definition:
Chia (Salvia hispanica L.) ist eine einjährige krautige Sommerpflanze aus der Familie der Labiatae. Die Samen werden nach der Ernte mechanisch gereinigt. Blüten, Blätter und andere Pflanzenteile werden entfernt.
Trockenmasse: 90-97 %
Protein: 15-26 %
Fett: 18-39 %
Kohlenhydrate *: 18-43 %
Rohfaser **: 18-43 %
Asche: 3-7 %
___
*) Kohlenhydrate umfassen den Ballaststoffgehalt.
**) Als Rohfaser wird der Anteil der Ballaststoffe bezeichnet, der vor allem aus unverdaulicher Zellulose, Pentosanen und Lignin besteht.
Herstellungsverfahren:
Das Verfahren zur Herstellung von Fruchtsäften und Fruchtsaftmischungen mit Chiasamen umfasst das Vorquellen und Pasteurisieren des Samens. Es sind mikrobiologische Kontrollen und ein Überwachungssystem vorhanden. |
| Zugelassenes neuartiges Lebensmittel |
Spezifikation |
| Chitin-Glucan ausAspergillus niger |
Beschreibung/Definition:
Chitin-Glucan wird aus dem Mycel vonAspergillus niger gewonnen; es ist ein gelbliches, geruchloses, frei fließendes Pulver. Sein Gehalt an Trockensubstanz beträgt mindestens 90 %.
Chitin-Glucan setzt sich vor allem aus zwei Polysacchariden zusammen:
- Chitin, bestehend aus wiederkehrenden Einheiten vonN-Acetyl-D-glucosamin (CAS-Nr.: 1398-61-4),
- Beta(1,3)-Glucan, bestehend aus wiederkehrenden Einheiten von D-Glucose (CAS-Nr.: 9041-22-9).
Trocknungsverlust: ≤ 10 %
Chitin-Glucan: ≥ 90 %
Verhältnis von Chitin zu Glucan: 30:70 bis 60:40
Asche: ≤ 3,0 %
Lipide: ≤ 1,0 %
Proteine: ≤ 6,0 % |
| Chitin-Glucan-Komplex ausFomes fomentarius |
Beschreibung/Definition:
Der Chitin-Glucan-Komplex wird aus den Zellwänden der Fruchtkörper des PilzesFomes fomentarius gewonnen. Er besteht hauptsächlich aus zwei Polysacchariden:
- Chitin, bestehend aus wiederkehrenden Einheiten vonN-Acetyl-D-glucosamin (CAS-Nr.: 1398-61-4);
- Beta-(1,3)(1,6)-D-glucan, bestehend aus wiederkehrenden Einheiten von D-Glucose (CAS-Nr.: 9041-22-9).
Das Herstellungsverfahren umfasst mehrere Schritte wie: Reinigen, Zerkleinern und Mahlen, Einweichen in Wasser und Erhitzen in einer alkalischen Lösung, Waschen, Trocknen. Während des Herstellungsverfahrens wird keine Hydrolyse durchgeführt.
Aussehen: Pulver, geruchlos, geschmacklos, braun
Reinheit:
Feuchtigkeit: ≤ 15 %
Asche: ≤ 3,0 %
Chitin-Glucan: ≥ 90 %
Verhältnis von Chitin zu Glucan: 70:20
Gesamtkohlenhydrate, ausgenommen Glucane: ≤ 0,1 %
Proteine: ≤ 2,0 %
Lipide: ≤ 1,0 %
Melanine: ≤ 8,3 %
Zusatzstoffe: keine
pH: 6,7-7,5
Schwermetalle:
Blei (ppm): ≤ 1,00
Cadmium (ppm): ≤ 1,00
Quecksilber (ppm): ≤ 0,03
Arsen (ppm): ≤ 0,20
Mikrobiologische Kriterien:
Gesamtgehalt mesophile Bakterien: ≤ 103/g
Hefen und Schimmelpilze: ≤ 103/g
Coliforme bei 30 °C: ≤ 103/g
E. coli: ≤ 10/g
Salmonellen und andere pathogene Bakterien: in 25 g nicht nachweisbar |
| Chitosanextrakt aus Pilzen (Agaricus bisporus; Aspergillus niger) |
Beschreibung/Definition:
Der Chitosanextrakt (der hauptsächlich Poly-D-Glucosamin enthält) wird aus Stämmen vonAgaricus bisporus oder aus dem Mycel vonAspergillus niger gewonnen.
Das patentierte Herstellungsverfahren umfasst mehrere Schritte wie: Extraktion und Deacetylierung (Hydrolyse) in alkalischem Medium, Solubilisierung in saurem Medium, Ausfällung in alkalischem Medium, Waschen und Trocknen.
Synonym: Poly(D-Glucosamin)
CAS-Nummer Chitosan: 9012-76-4
Formel Chitosan: (C6H11NO4)n
Beschaffenheit: feines, frei fließendes Pulver
Aussehen: cremefarben bis leicht bräunlich
Geruch: geruchlos
Reinheit:
Chitosangehalt (% w/w Trockengewicht): ≥ 85
Glucangehalt (% w/w Trockengewicht): ≤ 15
Trocknungsverlust (% w/w Trockengewicht): ≤ 10
Viskosität (1 % in 1%iger Essigsäure): 1-15
Grad der Acetylierung (in % M/Frischmasse): 0-30
Viskosität (1 % in 1%iger Essigsäure) (mPa.s): 1-14 bei Chitosan ausAspergillus niger; 12-25 bei Chitin ausAgaricus bisporus
Asche (% w/w Trockengewicht): ≤ 3,0
Protein (% w/w Trockengewicht): ≤ 2,0
Partikelgröße: > 100 nm
Stampfdichte (g/cm3): 0,7-1,0
Fettbindevermögen 800x (w/w Frischmasse): ok
Schwermetalle:
Quecksilber (ppm): ≤ 0,1
Blei (ppm): ≤ 1,0
Arsen (ppm): ≤ 1,0
Cadmium (ppm): ≤ 0,5
Mikrobiologische Kriterien:
Aerobe Keime insgesamt (KBE/g): ≤ 103
Hefen und Schimmelpilze insgesamt (KBE/g): ≤ 103
Escherichia coli (KBE/g): ≤ 10
Enterobacteriaceae (KBE/g): ≤ 10
Salmonellen: in 25 g nicht nachweisbar
Listeria monocytogenes: in 25 g nicht nachweisbar |
| Chromhaltige Biomasse der Hefe Yarrowia lipolytica
Stand: VO (EU) 2020/1822 |
Beschreibung/Definition:
Das neuartige Lebensmittel besteht aus der getrockneten und durch Hitze abgetöteten chromhaltigen Biomasse der Hefe Yarrowia lipolytica.
Das neuartige Lebensmittel wird durch Fermentation unter Zugabe von Chromchlorid gewonnen, gefolgt von einer Reihe von Reinigungsschritten sowie einer Abtötung der Hefe durch Hitze, um sicherzustellen, dass im neuartigen Lebensmittel keine lebensfähigen Zellen von Yarrowia lipolytica vorhanden sind.
Merkmale/Zusammensetzung:
Gesamtchrom: 18-23μg/g
Chrom (VI): < 10μg/kg (d. h. Nachweisgrenze)
Protein: 40-50 g/100 g
Ballaststoffe: 24-32 g/100 g
Zucker: < 2 g/100 g
Fett: 6-12 g/100 g
Gesamtasche: ≤ 15 %
Wasser: ≤ 5 %
Trockenmasse: ≥ 95 %
Schwermetalle:
Blei: ≤ 3,0 mg/kg
Cadmium: ≤ 1,0 mg/kg
Quecksilber: ≤ 0,1 mg/kg
Mikrobiologische Kriterien:
Gesamtzahl der aeroben Bakterien: ≤ 5x103 KBE/g
Hefen und Schimmelpilze insgesamt: ≤ 102 KBE/g
Lebensfähige Zellen von Yarrowia lipolytica1: < 10 KBE/g (d. h. Nachweisgrenze)
Coliforme: ≤ 10 KBE/g
Salmonella spp.: in 25 g nicht nachweisbar
KBE: koloniebildende Einheiten
___
1) Anwendbar in allen Phasen nach der Hitzebehandlung, um sicherzustellen, dass keine lebensfähigen Zellen von Yarrowia lipolytica vorhanden sind, und unmittelbar nach der Hitzebehandlung zu prüfen. Es sind Maßnahmen zur Verhinderung einer Kreuzkontamination mit lebensfähigen Zellen von Yarrowia lipolytica bei der Verpackung und/oder Lagerung des neuartigen Lebensmittels zu treffen. |
| Chondroitinsulfat |
Beschreibung/Definition:
Chondroitinsulfat (Natriumsalz) ist ein Biosyntheseprodukt. Es wird durch chemische Sulfatierung von mittels Fermentation des BakteriumsEscherichia coli O5:K4:H4 Stamm U1-41 (ATCC 23502) gewonnenem Chondroitin hergestellt.
Chondroitinsulfat (Natriumsalz) (% Trockenmasse): 95-105
MWw (Massenmittel) (kDa): 5-12
MWn (Zahlenmittel) (kDa): 4-11
Dispersität (wh/w0,05): ≤ 0,7
Sulfatierungsmuster (ΔDi-6S) (%): ≤ 85
Trocknungsverlust (%) (105 °C bei konstantem Gewicht): ≤ 10,0
Glührückstand (% Trockenmasse): 20-30
Protein (%Trockenmasse): ≤ 0,5
Endotoxine (EU/mg): ≤ 100
Organische Verunreinigungen insgesamt (mg/kg): ≤ 50 |
| Chrompicolinat |
Beschreibung/Definition:
Chrompicolinat ist ein rötliches, frei fließendes Pulver, schwer löslich in Wasser bei pH 7. Das Salz ist auch löslich in polaren organischen Lösungsmitteln.
Chemische Bezeichnung: Tris(2-Pyridincarboxylat-N,O)Chrom(III)- oder 2-Pyridincarbonsäure-Chrom(III)-Salz
CAS-Nr.: 14639-25-9
Chemische Formel: Cr(C6H4NO2)3
Chemische Eigenschaften:
Chrompicolinat: ≥ 95 %
Chrom (III): 12-13 %
Chrom (VI): nicht nachweisbar
Wasser: ≤ 4,0 % |
| "Cistus incanus L. Pandalis (Kraut)"
Stand: VO (EU) 2022/202 |
Beschreibung:
Cistus incanus L. Pandalis (Kraut) Art aus der Familie der Cistaceae und im Mittelmeerraum auf der Halbinsel Chalkidiki beheimatet.
Das neuartige Lebensmittel besteht aus den getrockneten und geschnittenen oberirdischen Teilen (junge Sprossen mit holzigen Teilen) von Cistus incanus L. Pandalis |
| Citicolin |
Beschreibung/Definition:
Citicolin wird durch einen mikrobiologischen Prozess gewonnen.
Citicolin besteht aus Cytosin, Ribose, Pyrophosphat und Cholin.
Weißes kristallines Pulver
Chemische Bezeichnung: Cholin-cytidin-5"-pyrophosphat, Cytidin-5"-(trihydrogendiphosphat)-P"-[2-(trimethylammonio)ethyl]ester, inneres Salz
Chemische Formel: C14H26N4O11P2
Molmasse: 488,32 g/mol
CAS-Nr.: 987-78-0
pH (Probelösung von 1 %): 2,5-3,5
Reinheit:
Mindestgehalt: ≥ 98 %, bezogen auf die Trockenmasse
Trocknungsverlust (bei 100 °C über 4 Std.): ≤ 5,0 %
Ammonium: ≤ 0,05 %
Arsen: höchstens 2 ppm
Freie Phosphorsäuren: ≤ 0,1 %
5"-Cytidylsäure: ≤ 1,0 %
Mikrobiologische Kriterien:
Gesamtkeimzahl: ≤ 103 KBE/g
Hefen und Schimmelpilze: ≤ 102 KBE/g
Escherichia coli: in 1 g nicht nachweisbar |
| Clostridium butyricum |
Beschreibung/Definition:
Clostridium butyricum (CBM-588) ist ein grampositives, sporenbildendes, obligat anaerobes, nichtpathogenes, nicht genetisch verändertes Bakterium. Depotnummer FERM BP-2789
Mikrobiologische Kriterien:
Gesamtkeimzahl: ≤ 103 KBE/g
Escherichia coli: in 1 g nicht nachweisbar
Staphylococcus aureus: in 1 g nicht nachweisbar
Pseudomonas aeruginosa: in 1 g nicht nachweisbar
Hefen und Schimmelpilze: ≤ 102 CFU/g |
| D-Ribose
Stand: VO (EU) 2019/506 |
Beschreibung
D-Ribose ist ein Aldopentose-Monosaccharid, das durch Fermentation mittels eines transketolase-armen Stammes von Bacillus subtilis gewonnen wird.
Chemische Formel: C5H10O5
CAS-Nr.: 50-69-1
Molmasse: 150,13 Da
Merkmale/Zusammensetzung
Aussehen: trocken mit pulvriger Struktur, weiß bis leicht gelb
Spezifische Drehung [α]D25: - 19,0° bis - 21,0°
Reinheit der D-Ribose (% Trockenmasse):
-HPLC/RI 8-Methode 98,0-102,0 %
Asche: < 0,2 %
Trocknungsverlust (Feuchtigkeit): < 0,5 %
Klarheit der Lösung: ≥ 95 % Lichtdurchlässigkeit
Schwermetalle
Blei: ≤ 0,1 mg/kg
Arsen: ≤ 0,1 mg/kg
Cadmium: ≤ 0,1 mg/kg
Quecksilber: ≤ 0,1 mg/kg
Mikrobiologische Kriterien
Gesamtkeimzahl: ≤ 100 KBE 9/g
Hefen:<100 KBE/g
Schimmelpilze: ≤ 100 KBE/g
Coliforme: ≤ 10 KBE/g
Salmonellasp.: negativ/25 g |
| Extrakt aus entfettetem Kakaopulver |
Extrakt aus Kakao (Theobroma cacao L.)
Aussehen: Dunkelbraunes Pulver ohne sichtbare Verunreinigungen
Physikalisch-chemische Eigenschaften:
Polyphenolgehalt: mind. 55,0 % GAE
Theobromingehalt: max. 10,0 %
Aschegehalt: max. 5,0 %
Feuchtigkeitsgehalt: max. 8,0 %
Schüttdichte: 0,40-0,55 g/cm3
pH: 5,0-6,5
Lösungsmittelreste: max. 500 ppm |
| Kakaoextrakt mit geringem Fettanteil |
Extrakt aus fettarmem Kakao (Theobroma cacao L.)
Aussehen: dunkelrotes bis violettes Pulver
Kakaoextrakt, Konzentrat: mind. 99 %
Siliciumdioxid (technischer Hilfsstoff): max. 1,0 %
Kakaoflavanole: mind. 300 mg/g
- Epicatechin: mind. 45 mg/g
Trocknungsverlust: max. 5,0 % |
| Koriandersamenöl ausCoriandrum sativum
Stand: VO"en (EU) 2021/1319; 2019/2165; 2019/456 |
Beschreibung/Definition:
Koriandersamenöl ist ein Fettsäureglyceride enthaltendes Öl, das aus den Samen der Korianderpflanze Coriandrum sativum L. gewonnen wird.
Gelbliche bis braune Farbe, milder Geschmack
CAS-Nr.: 8008-52-4
Fettsäurezusammensetzung:
Palmitinsäure (C16:0): 2-5 %
Stearinsäure (C18:0): < 1,5 %
Petroselinsäure (cis-C18:1(n-12)): 60-75 %
Ölsäure (cis-C18:1(n-9)): 7-15 %
Linolsäure (C18:2): 12-19 %
α-Linolensäure (C18:3): < 1,0 %
trans-Fettsäuren: ≤ 1,0 %
Reinheit:
Refraktionsindex (20 °C): 1,466-1,474
Säurezahl: ≤ 4 mg KOH/g
Peroxidzahl: ≤ 5,0 meq/kg
Iodzahl: 88-110 Einheiten
Verseifungszahl: 179-200 mg KOH/g
Unverseifbare Fraktion: ≤ 15 g/kg |
| Pulver aus Cranberry-Extrakt
Stand: VO (EU) 2018/1631 |
Beschreibung/Definition:
Pulver aus Cranberry-Extrakt ist ein wasserlöslicher phenolreicher Pulverextrakt, der durch ethanolische Extraktion aus dem Saftkonzentrat intakter, reifer Beeren des Cranberry-KultivarsVaccinium macrocarpon gewonnen wird.
Merkmale/Zusammensetzung:
Feuchtigkeitsgehalt (Massenanteil): ≤ 4
Proanthocyanidine (PAC) (% w/w Trockengewicht)
- OSC-DMAC-Methode 3 5: 55,0-60,0 oder
- BL-DMAC-Methode 4 5: 15,0-18,0
Gesamtphenolgehalt (GAE 6, % w/w Trockengewicht) 5
- Folin-Ciocalteau-Methode: > 46,2
Löslichkeit (Wasser): 100 %, ohne sichtbare unlösliche Partikel
Ethanolgehalt (mg/kg): ≤ 100
Screen-Analyse: 100 % durch 30-Maschen-Sieb
Aussehen und Geruch als Pulver: rieselfähig, dunkelrote Farbe. Erdiges Aroma, kein verbrannter Geruch.
Schwermetalle:
Arsen (ppm): < 3
Mikrobiologische Kriterien:
Hefen: < 100 KBE 7/g
Schimmelpilze: < 100 KBE/g
Zahl der aeroben Keime: < 1.000 KBE/g
Coliforme: < 10 KBE/g
Escherichia coli: < 10 KBE/g
Salmonellen: in 375 g nicht nachweisbar |
| Getrocknete Früchte vonCrataegus pinnatifida |
Beschreibung/Definition:
Getrocknete Früchte der im nördlichen China und in Korea beheimateten ArtCrataegus pinnatifida aus der Familie der Rosaceae.
Zusammensetzung:
Trockenmasse: 80 %
Kohlenhydrate: 55 g/kg Frischgewicht
Fructose: 26,5-29,3 g/100 g
Glucose: 25,5-28,1 g/100 g
Vitamin C: 29,1 mg/100 g Frischgewicht
Natrium: 2,9 g/100 g Frischgewicht
Kompott wird hergestellt durch eine thermische Behandlung des genießbaren Teils einer oder mehrerer Obstsorten, ganz oder in Stücken, passiert oder unpassiert und ohne nennenswerte Konzentration. Es können Zucker, Wasser, Apfelwein, Gewürze und Zitronensaft verwendet werden. |
| α-Cyclodextrin |
Beschreibung/Definition:
Nichtreduzierendes cyclisches Saccharid, bestehend aus sechs α-1,4-verknüpften D-Glucopyranosyleinheiten, das durch Einwirkung von Cycloglycosyltransferase (CGTase, EC 2.4.1.19) aus hydrolisierter Stärke hergestellt wird. α-Cyclodextrin kann mit einer der folgenden Methoden gewonnen und gereinigt werden: Ausfällung eines Komplexes von α-Cyclodextrin mit 1-Decanol, Auflösen in Wasser bei erhöhter Temperatur und erneute Ausfällung, Entfernen des Komplexbildners mittels Dampfdestillation und Kristallisation von α-Cyclodextrin aus der Lösung; oder Chromatografie mit Ionen-Austausch und Gel-Filtration, dann Kristallisation von α-Cyclodextrin aus der gereinigten Mutterlauge; oder Membrantrennverfahren wie Ultra-Filtration und Umkehrosmose. Beschreibung: Praktisch geruchloser, weißer oder fast weißer kristalliner Feststoff
Synonyme: α-Cyclodextrin, α-Dextrin, Cyclohexaamylose, Cyclomaltohexaose, α-Cycloamylose
Chemische Bezeichnung: Cyclohexaamylose
CAS-Nr.: 10016-20-3
Chemische Formel: (C6H10O5)6
Formelgewicht: 972,85
Gehalt: ≥ 98 % bezogen auf die Trockensubstanz
Eigenschaften:
Schmelzbereich: zersetzt sich oberhalb von 278 °C
Löslichkeit: leicht wasserlöslich; sehr gering löslich in Ethanol
Spezifische Drehung: [α]D25: zwischen +145° und +151° (1%ige Lösung) Chromatografie: Die Retentions-Zeit für den Haupt-Peak in einem Flüssigchromatogramm der Probe entspricht der für α-Cyclodextrin in einem Chromatogramm von Referenz-α-Cyclodextrin (erhältlich beiConsortium für Elektrochemische Industrie GmbH, München, Deutschland, oderWacker Biochem Group, Adrian, MI, USA) unter den in "Verfahren zur Gehaltsbestimmung" beschriebenen Bedingungen.
Reinheit:
Wasser: ≤ 11 % (Karl-Fischer-Methode)
Rest-Komplexbildner: ≤ 20 mg/kg
(1-Decanol)
Reduzierende Stoffe: ≤0,5 % (als Glucose)
Sulfatasche: ≤ 0,1 %
Blei: ≤ 0,5 mg/kg
Verfahren zur Gehaltsbestimmung:
Der Gehalt wird mit Flüssig-Chromatografie wie folgt bestimmt:
Probenlösung: Sorgfältig etwa 100 mg der Probe abwiegen, in einen 10-ml-Messkolben geben und etwa 8 ml deionisiertes Wasser hinzufügen. Die Probe mithilfe eines Ultraschallbades vollständig auflösen (10-15 Min.) und bis zur Markierung mit gereinigtem und deionisiertem Wasser auffüllen. Durch einen 0,45-Mikrometer-Filter filtrieren.
Referenzlösung: Sorgfältig etwa 100 mg α-Cyclodextrin abwiegen, in einen 10-ml-Messkolben geben und etwa 8 ml deionisiertes Wasser hinzufÌgen. Die Probe mithilfe eines Ultraschallbades vollständig auflösen und bis zur Markierung mit gereinigtem und deionisiertem Wasser auffüllen.
Chromatografie: Flüssigchromatograf, ausgerüstet mit einem Refraktionsindexdetektor und einem Gerät für eine Integralaufzeichnung.
Säule und Packung: Nucleosil-100-NH2 (10 µm) (Macherey & Nagel Co. Düren, Deutschland) oder ähnlich.
Länge: 250 mm
Durchmesser: 4 mm
Temperatur: 40 °C
Mobile Phase: Acetonitril/Wasser (67/33, v/v) Flussrate: 2,0 ml/min
Injektionsvolumen: 10 µl
Verfahren: Die Probenlösung in den Chromatografen einspritzen, das Chromatogramm aufzeichnen und die Fläche des α-CD-Peak messen. Den prozentualen Anteil an α-Cyclodextrin in der Analyseprobe wie folgt berechnen:
% α-Cyclodextrin (auf Trockenbasis) = 100 x (AS/AR) (WR/WS),
wobei
AS and AR die Flächen der α-Cyclodextrin-Peaks der Probenlösung bzw. der Referenzlösung sind und
WS and WR die Gewichte (mg) der Analyseprobe bzw. des Referenz-α-Cyclodextrins, korrigiert um den Wassergehalt, sind. |
| γ-Cyclodextrin |
Beschreibung/Definition:
Nichtreduzierendes cyclisches Saccharid, bestehend aus acht α-1,4-verknüpften D-Glucopyranosyleinheiten, das durch Einwirkung von Cycloglycosyltransferase (CGTase, EC 2.4.1.19) auf hydrolysierte Stärke hergestellt wird. Wiederfindung und Reinigung von γ-Cyclodextrin können durch Ausfällung eines Komplexes von γ-Cyclodextrin mit 8-Cyclohexadecen-1-on, Auflösen des Komplexes in Wasser und n-Decan, Steam-stripping der wässrigen Phase und Kristallisation aus der Lösung erfolgen.
Praktisch geruchloser, weißer oder fast weißer, kristalliner Feststoff
Synonyme: γ-Cyclodextrin, γ-Dextrin, Cyclooctaamylose, Cyclomaltooctaose, γ-Cycloamylase
Chemische Bezeichnung: Cyclooctaamylose
CAS-Nr.: 17465-86-0
Chemische Formel: (C6H10O5)8
Gehalt: ≥ 98 % bezogen auf die Trockensubstanz
Eigenschaften:
Schmelzbereich: zersetzt sich oberhalb von 285 °C
Löslichkeit: leicht wasserlöslich; sehr gering löslich in Ethanol
Spezifische Drehung: [α]D25: zwischen +174° und +180° (1%ige Lösung)
Reinheit:
Wasser: ≤ 11 %
Rest-Komplexiermittel (8-Cyclohexadecen-1-on (CHDC)): ≤ 4 mg/kg
Lösungsmittelreste (n-Decan): ≤ 6 mg/kg
Reduzierende Stoffe: ≤ 0,5 % (als Glucose)
Sulfatasche: ≤ 0,1 % |
Geschälte Körner vonDigitaria exilis(Kippist) Stapf (Fonio)
(Traditionelles Lebensmittel aus einem Drittland)
Stand: VO (EU) 2018/2016 |
Beschreibung/Definition
Bei dem traditionellen Lebensmittel handelt es sich um geschälte Körner (ohne Kleie) vonDigitaria exilis(Kippist) Stapf.
Digitaria exilis(Kippist) Stapf ist eine einjährige krautige Pflanze aus der Familie der Poaceae.
Typische Nährstoffbestandteile geschälter Fonio-Körner
Kohlenhydrate: 76,1 g/100 g Fonio
Wasser: 12,4 g/100 g Fonio
Protein: 6,9 g/100 g Fonio
Fett: 1, 2 g/100 g Fonio
Faser: 2,2 g/100 g Fonio
Asche: 1,2 g/100 g Fonio
Phytatgehalt: ≤ 2,1 mg/g |
| Dextranzubereitung, hergestellt mithilfe vonLeuconostoc mesenteroides |
- Pulverform:
Kohlenhydrate: 60 % mit: (Dextran: 50 %, Mannit: 0,5 %, Fructose: 0,3 %, Leucrose: 9,2 %)
Protein: 6,5 %
Lipid: 0,5 %
Milchsäure: 10 %
Ethanol: Spuren
Asche: 13 %
Feuchtigkeit: 10 %
- Flüssige Form:
Kohlenhydrate: 12 % mit: (Dextran: 6,9 %, Mannit: 1,1 %, Fructose: 1,9 %, Leucrose: 2,2 %)
Protein: 2,0 %
Lipid: 0,1 %
Milchsäure: 2,0 %
Ethanol: 0,5 %
Asche: 3,4 %
Feuchtigkeit: 80 %
|
| Diacylglyceridöl pflanzlichen Ursprungs |
Beschreibung/Definition:
Hergestellt aus Glycerid und Fettsäuren, die unter Verwendung eines bestimmten Enzyms aus essbaren pflanzlichen Ölen gewonnen wurden, vor allem aus Sojabohnenöl (Glycine max) oder Rapssamenöl (Brassica campestris, Brassica napus).
Acylglycerid-Verteilung:
Diacylglyceride (DAG): ≥ 80 %
1,3-Diacylglyceride (1,3-DAG): ≥ 50 %
Triacylglyceride (TAG): ≤ 20 %
Monoacylglyceride (MAG): ≤ 5,0 %
Fettsäurezusammensetzung (MAG, DAG, TAG):
Ölsäure (C18:1): 20-65 %
Linolsäure (C18:2): 15-65 %
Linolensäure (C18:3): ≤15 %
Gesättigte Fettsäuren: ≤10 %
Sonstiges:
Säurezahl: ≤ 0,5 mg KOH/g
Feuchtigkeit und flüchtige Bestandteile: ≤ 0,1 %
Peroxidzahl (PV): ≤ 1,0 meq/kg
Unverseifbare Bestandteile: ≤ 2,0 %
trans-Fettsäuren: ≤ 1,0 %
MAG = Monoacylglyceride, DAG = Diacylglyceride, TAG = Triacylglyceride |
| Zugelassenes neuartiges Lebensmittel |
Spezifikation |
| Dihydrocapsiat (DHC) |
Beschreibung/Definition:
Dihydrocapsiat wird durch enzymkatalysierte Veresterung von Vanillylalkohol und 8-Methylnonansäure hergestellt. Nach der Veresterung wird Dihydrocapsiat mit n-Hexan extrahiert.
Viskose, farblose bis gelbe Flüssigkeit
Chemische Formel: C18H28O4
CAS-Nr.: 205687-03-2
Physikalisch-chemische Eigenschaften:
Dihydrocapsiat: > 94 %
8-Methylnonansäure: < 6,0 %
Vanillylalkohol: < 1,0 %
Sonstige synthesebedingte Stoffe: < 2,0 % |
| Getrocknete oberirdische Teile vonHoodia parviflora |
Beschreibung/Definition
Es handelt sich um die gesamten getrockneten oberirdischen Teile vonHoodia parviflora N.E.Br. (Familie der Apocynaceae).
Merkmale/Zusammensetzung
Pflanzenmaterial: oberirdische Teile von mindestens 3-jährigen Pflanzen
Aussehen: feines Pulver, hellgrün bis hellbraun
Löslichkeit (Wasser): > 25 mg/ml
Feuchtigkeit: < 5,5 %
Aw: < 0,3
pH: < 5,0
Protein: < 4,5 g/100 g
Fett: < 3 g/100 g
Kohlenhydrate (einschließlich Ballaststoffe): < 80 g/100 g
Ballaststoffe: < 55 g/100 g
Gesamtzucker: < 10,5 g/100 g
Asche: < 20 %
Hoodigoside
P57: 5-50 mg/kg
L: 1.000-6.000 mg/kg
O: 500-5.000 mg/kg
Insgesamt: 1.500 -11.000 mg/kg
Schwermetalle
Arsen: < 1,00 mg/kg
Quecksilber: < 0,1 mg/kg
Cadmium: < 0,1 mg/kg
Blei: < 0,5 mg/kg
Mikrobiologische Kriterien
Zahl der aeroben Keime: < 105 KBE/g
Escherichia coli: < 10 CFU/g
Staphylococcus aureus: < 50 KBE/g
Coliforme insgesamt: < 10 KBE/g
Hefe: ≤ 100 KBE/g
Schimmelpilze: ≤ 100 KBE/g
Salmonella-Arten: Negativ/25 g
Listeria monocytogenes: Negativ/25 g
KBE: koloniebildende Einheiten |
| Getrockneter Extrakt vonLippia citriodora aus Zellkulturen |
Beschreibung/Definition:
Getrockneter Extrakt vonLippia citriodora (Palau) Kunth aus HTN®Vb-Zellkulturen. |
| Extrakt vonEchinacea angustifolia aus Zellkulturen |
Beschreibung/Definition:
Extrakt aus der Wurzel vonEchinacea angustifolia, der aus Pflanzengewebekulturen gewonnen wird und im Wesentlichen gleichwertig ist mit einem Extrakt aus der Wurzel vonEchinacea angustifolia, der in zu 4 % Echinacosid titriertem Ethanol-Wasser gewonnen wird. |
| Extrakt vonEchinacea purpurea aus Zellkulturen |
Beschreibung/Definition:
Getrockneter Extrakt von Echinacea purpurea aus EchiPure-PC™-Zellkulturen |
| Öl ausEchium plantagineum |
Beschreibung/Definition:
Echium-Öl ist das blassgelbe Produkt, das durch Raffinieren von Öl aus den Samen vonEchium plantagineum L. gewonnen wird. Stearidonsäure: ≥ 10 % Gew.-% der Gesamtfettsäuren
trans-Fettsäuren: ≤ 2,0 % (Gew.-% der Gesamtfettsäuren)
Säurezahl: ≤ 0,6 mg KOH/g
Peroxidzahl (PV): ≤ 5,0 meq O2/kg
Unverseifbare Bestandteile: ≤ 2,0 %
Proteingehalt (Gesamtstickstoff): ≤ 20 µg/ml
Pyrrolizidinalkaloide: nicht nachweisbar bei einer Nachweisgrenze von 4,0 µg/kg |
| Phlorotannine ausEcklonia cava
Stand: VO (EU) 2020/1559 |
Beschreibung/Definition
Phlorotannine ausEcklonia cava werden durch Alkoholextraktion aus der essbaren MeeresalgeEcklonia cava gewonnen. Bei dem Extrakt handelt es sich um ein dunkelbraunes Pulver, das reich an Phlorotanninen ist, Polyphenolverbindungen, die als sekundäre Metaboliten in bestimmten Braunalgenarten vorkommen.
Merkmale/Zusammensetzung
Phlorotanningehalt: 90 ± 5 %
Antioxidative Aktivität: > 85 %
Feuchtegehalt: < 5 %
Aschegehalt: < 5 %
Mikrobiologische Kriterien
Gesamtzahl der lebensfähigen Zellen: < 3.000 KBE/g
Schimmelpilze/Hefe < 300 KBE/g
Coliforme: negativ
Salmonellaspp.: negativ
Staphylococcus aureus: negativ
Schwermetalle und Halogene
Blei: < 3,0 mg/kg
Quecksilber: < 0,1 mg/kg
Cadmium: < 3,0 mg/kg
Arsen: < 25,0 mg/kg
Anorganisches Arsen: < 0,5 mg/kg
Jod: 150,0-650,0 mg/kg
KBE: koloniebildende Einheiten |
| Eimembran-Hydrolysat |
Beschreibung
Das Eimembran-Hydrolysat wird aus Eierschalenmembranen von Hühnereiern gewonnen. Die Eierschalen werden einer hydro-mechanischen Trennung unterzogen, um die Eimembranen zu gewinnen, die anschließend mittels einer patentierten Solubilisierungsmethode weiter verarbeitet werden. Im Anschluss an den Solubilisierungsprozess wird die Lösung gefiltert, konzentriert, sprühgetrocknet und verpackt.
Merkmale/Zusammensetzung |
| Chemische Parameter |
Methoden |
| Stickstoffhaltige Verbindungen insgesamt (% w/w): ≥ 88 |
Verbrennung gemäß AOAC 990.03 und AOAC 992.15 |
| Kollagen (% w/w): ≥ 15 |
SircolTM Soluble Collagen Assay |
| Elastin (% w/w): ≥ 20 |
FastinTM Elastin Assay |
| Glycosaminoglycane insgesamt (% w/w): ≥ 5 |
USP26 (Chondroitinsulfat-K0032-Methode) |
| Calcium: ≤ 1 % |
|
Physikalische Parameter
pH: 6,5-7,6
Asche (% w/w): ≤ 8
Feuchtigkeitsgehalt (% w/w): ≤ 9
Wasseraktivität: ≤ 0,3
Löslichkeit (in Wasser): löslich
Schüttdichte: ≥ 0,6 g/cc
Schwermetalle
Arsen: ≤ 0,5 mg/kg
Mikrobiologische Kriterien
Zahl der aeroben Keime: ≤ 2.500 KBE/g
Escherichia coli: ≤ 5 MPN/g
Salmonellen: Negativ (in 25 g)
Coliforme: ≤ 10 MPN/g
Staphylococcus aureus: ≤ 10 KBE/g
Mesophile Gesamtkeimzahl: ≤ 25 KBE/g
Thermophile Gesamtkeimzahl: ≤ 10 KBE/10 g
Hefen: ≤ 10 KBE/g
Schimmelpilze: ≤ 200 KBE/g
KBE: koloniebildende Einheiten; MPN = wahrscheinlichste Zahl (Most Probable Number); USP: United States Pharmacopeia. |
| Epigallocatechingallat als gereinigter Extrakt aus Blättern von grünem Tee (Camellia sinensis) |
Beschreibung/Definition:
Hochreines Extrakt aus den Blättern von grünem Tee (Camellia sinensis (L.) Kuntze) in Form eines feinen, cremefarben bis blassrosa Pulvers. Es besteht aus mindestens 90 % Epigallocatechingallat (EGCG) und sein Schmelzpunkt liegt zwischen ca. 210 und 215 °C.
Aussehen: cremefarbenes bis blassrosa Pulver
Chemische Bezeichnung: Polyphenol (-) Epigallocatechin-3-gallat
Synonyme: Epigallocatechingallat (EGCG)
CAS-Nr.: 989-51-5
INCI-Bezeichnung: Epigallocatechingallat
Molmasse: 458,4 g/mol
Trocknungsverlust: max. 5,0 %
Schwermetalle:
Arsen: max. 3,0 ppm
Blei: max. 5,0 ppm
Gehalt:
mind. 94 % EGCG (bezogen auf die Trockenmasse) max. 0,1 % Koffein
Löslichkeit: EGCG ist recht gut löslich in Wasser, Ethanol, Methanol und Aceton. |
| L-Ergothionein |
Definition
Chemische Bezeichnung (IUPAC): (2S)-3-(2-Thioxo-2,3-dihydro-1H-imidazol-4-yl)-2-(trimethylammonio)-propanoat
Chemische Formel: C9H15N3O2S
Molmasse: 229,3 Da
CAS-Nr.: 497-30-3 |
| Parameter |
Spezifikation |
Methode |
| Aussehen |
Weißes Pulver |
Visuelle Prüfung |
| Optische Rotation |
[α]D ≥ (+)122 (c = 1, H2O)a) |
Polarimetrische Messung |
| Chemische Reinheit |
≥ 99,5 %
≥ 99,0 % |
HPLC [ Eur. Ph. 2.2.29]
1H-NMR |
| Identifikation |
Übereinstimmend mit der Struktur
C: 47,14 ± 0,4 %
H: 6,59 ± 0,4 %
N: 18,32 ± 0,4 % |
1H-NMR
Elementaranalyse |
| Lösungsmittelrückstände
(Methanol, Ethylacetat, Isopropanol, Ethanol) |
[Eur. Ph. 01/2008:50400]
< 1.000 ppm |
Gaschromatografie
[Eur. Ph. 01/2008:20424] |
| Trocknungsverlust |
Interner Standard < 0,5 % |
[Eur. Ph. 01/2008:20232] |
| Verunreinigungen |
< 0,8 % |
HPLC/GPC oder 1H-NMR |
| Schwermetalleb) c) |
| Blei |
< 3,0 ppm |
ICP/AES |
| Cadmium |
< 1,0 ppm |
(Pb, Cd) |
| Quecksilber |
< 0,1 ppm |
Atomfluoreszens (Hg) |
| Spezifikation Mikrobiologieb) |
| Gesamtkeimzahl (TVAC) |
≤ 1 x 103 KBE/g |
[Eur. Ph. 01/2011:50104] |
| Hefen und Schimmelpilze insgesamt (TYMC) |
≤ 1 x 102 CKBE/g |
|
| Escherichia coli |
in 1 g nicht nachweisbar |
|
| Eur. Ph.: Europäisches Arzneibuch; 1H-NMR: Proton-Kernspinresonanz; HPLC: Hochleistungs-Flüssigkeitschromatografie; GPC: Gelchromatografie; ICP/AES: Atomemissionsspektrometrie mit induktiv gekoppeltem Plasma;
CFU: koloniebildende Einheiten.
__
a) ITL. [α]D = (+) 126,6 ° (c = 1, H2O)
b) Prüfung jeder einzelnen Charge
c) Höchstgehalte nach Verordnung (EG) Nr. 1881/2006 der Kommission |
| Getrocknete Biomasse von Euglena gracilis |
Beschreibung/Definition:
Bei dem neuartigen Lebensmittel handelt es sich um getrocknete ganze Euglena-Zellen, d. h. getrocknete Biomasse der Mikroalge Euglena gracilis.
Das neuartige Lebensmittel wird durch Fermentation, gefolgt von einer Filtrierung und Hitzebehandlung der Mikroalge gewonnen, um sicherzustellen, dass es keine lebensfähigen Zellen von Euglena gracilis enthält.
Merkmale/Zusammensetzung:
Kohlenhydrate insgesamt: ≤ 75 %
Beta-Glucan: > 50 %
Protein: ≥ 15 %
Fett: ≤ 15 %
Asche: ≤ 10 %
Feuchtigkeit: ≤ 6 %
Schwermetalle:
Blei: ≤ 0,5 mg/kg
Cadmium: ≤ 0,5 mg/kg
Quecksilber: ≤ 0,05 mg/kg
Arsen: ≤ 0,02 mg/kg
Mikrobiologische Kriterien:
Zahl der aeroben Keime: ≤ 10.000 KBE/g
Coliforme: ≤ 100 MPN/g
Hefen und Schimmelpilze: ≤ 500 KBE/g
Escherichia coli: in 10 g nicht nachweisbar
Staphylococcus aureus: in 10 g nicht nachweisbar
Salmonellen: in 25 g nicht nachweisbar
Listeria monocytogenes: in 25 g nicht nachweisbar
KBE: koloniebildende Einheiten
MPN: wahrscheinlichste Zahl. |
| Extrakt aus drei pflanzlichen Wurzeln (Cynanchum wilfordii Hemsley,Phlomis umbrosaTurcz. undAngelica gigas Nakai)
Stand: VO (EU) 2020/1559 |
Beschreibung/Definition
Die Mischung aus den drei pflanzlichen Wurzeln ist ein gelblichbraunes feines Pulver, das durch Heißwasserextraktion, Konzentration durch Verdampfen und Sprühtrocknung gewonnen wird.
Zusammensetzung des Extrakts aus der Mischung der drei pflanzlichen Wurzeln
Cynanchum wilfordii: 32,5 Gew.-%
Phlomis umbrosa: 32,5 Gew.-%
Angelica gigas: 35,0 Gew.-%
Spezifikation
Trocknungsverlust: max. 100 mg/g
Gehalt
Zimtsäure: 0,012-0,039 mg/g
Shanzhisid-Methylester: 0,20-1,55 mg/g
Nodakenin: 3,35-10,61 mg/g
Methoxsalen: < 3 mg/g
Phenole: 13,0-40,0 mg/g
Cumarine: 13,0-40,0 mg/g
Iridoide: 13,0-39,0 mg/g
Saponine: 5,0-15,5 mg/g
Nährstoffe
Kohlenhydrate: 600-880 mg/g
Proteine: 70-170 mg/g
Fette: < 4 mg/g
Mikrobiologische Parameter
Gesamtkeimzahl: < 5000 KBE/g
Gesamtgehalt an Schimmelpilzen und Hefen: < 100 KBE/g
Coliforme Bakterien: < 10 KBE/g
Salmonella: negativ/25 g
Escherichia coli: negativ/25 g
Staphylococcus aureus: negativ/25 g
Schwermetalle
Blei: < 0,65 mg/kg
Arsen: < 3,0 mg/kg
Quecksilber: < 0,1 mg/kg
Cadmium: < 1,0 mg/kg
KBE: koloniebildende Einheiten |
| Eisen(III)-Natrium-EDTA |
Beschreibung/Definition:
Eisen(III)-Natrium-EDTa (Ethylendiamintetraessigsäure) ist ein geruchloses, frei fließendes, gelbes bis braunes Pulver mit einer chemischen Reinheit von über 99 Gew.-%. Es ist leicht wasserlöslich.
Chemische Formel: C10H12FeN2NaO8 * 3H2O
Chemische Eigenschaften:
pH-Wert einer 1%igen Lösung: 3,5-5,5
Eisen: 12,5-13,5 %
Natrium: 5,5 %
Wasser: 12,8 %
Organische Stoffe (CHNO): 68,4 %
EDTA: 65,5-70,5 %
Wasserunlösliche Bestandteile: ≤ 0,1 %
Nitrilotriacetsäure: ≤ 0,1 % |
| Eisen(II)-Ammoniumphosphat |
Beschreibung/Definition:
Eisen(II)-Ammoniumphosphat ist ein graugrünes feines Pulver, praktisch unlöslich in Wasser und löslich in verdünnten Mineralsäuren.
CAS-Nr.: 10101-60-7
Chemische Formel: FeNH4PO4
Chemische Eigenschaften:
pH-Wert einer 5%igen Suspension in Wasser: 6,8-7,8
Eisen (insgesamt): ≥ 28 %
Eisen(II): 22-30 Gew.-%
Eisen(III): ≤ 7 Gew.-%
Ammoniak: 5-9 Gew.-%
Wasser: ≤ 3,0 % |
| Eisenhydroxid-Adipat-Tartrat
Stand: VO (EU) 2022/1373 |
Beschreibung/Definition:
Eisenhydroxid-Adipat-Tartrat (IHAT - Iron Hydroxide Adipate Tartrate) ist ein geruchloses technisch hergestelltes Nanomaterial in Pulverform, das wasserunlöslich ist und durch eine chemische Synthese hergestellt wird, die mehrere Schritte einschließlich Säure-basen-Reaktion, Ausfällung, Filtration und Trocknung umfasst.
Die Nahrungsergänzungsmittel, die das neuartige Lebensmittel enthalten, werden in Form von Kapseln hergestellt. Überschüssiges Adipat, Tartrat und Natriumchlorid werden in Mengen, die beim Herstellungsprozess anfallen, dazu verwendet, IHAT stabil zu machen und die zulässige Partikelgrößenverteilung zu gewährleisten. Wenn andere Darreichungsformen von Nahrungsergänzungsmitteln (z.B. tabletten, Pastillen, Pulver in Beuteln, Gummitabletten, Sirups usw.) zusammen mit Adipat, Tartrat und Natriumchlorid oder zusammen mit anderen Stoffen verwendet werden oder wenn in Nahrungsergänzungsmitteln in Kapselform, die das neuartige Lebensmittel enthalten, andere Stoffe verwendet werden, ist sicherzustellen, dass die zulässige Partikelgrößenverteilung von IHAT erhalten bleibt. |
| Gebräuchliche Bezeichnung |
Eisenoxohydroxid-Adipat-Tartrat |
| Sonstige Bezeichnungen |
Eisenhydroxid-Adipat-Tartrat, Eisenoxyhydroxid-Adipat-Tartrat |
| Handelsbezeichnung |
IHAT |
| CAS-Nummer |
2460638-28-0 |
| Chemische Formel(berechnet) |
FeOm(OH)n(H2O)x(C4H6O6)y(C6H10O4)z
wobei Folgendes gilt: m und n sind nach akzeptierter Praxis für Eisen(III)-oxohydroxide undefiniert*x = 0,28-0,88x = 0,78-1,50x = 0,04-0,19Weinsäure (C4H6O6) und Adipinsäure (C6H10O4) liegen in ihrer protonierten Form vor. |
| Molekulargewicht |
Durchschnittliches Molekulargewicht: 35.803,4 Da (Unter- und Obergrenze: 27.670,5 - 45.319,4 Da) |
Merkmale/Zusammensetzung:
Physikalisch/chemisch
Eisen (in % der Trockenmasse): 24,0-36,0
Adipat: (in % der Trockenmasse): 1,5-4,5
Tartrat: (in % der Trockenmasse): 28,0-40,0
Wassergehalt (%): 10,0-21,0
Natrium (in % der Trockenmasse): 9,0-11,0
Chlorid (in % der Trockenmasse): 2,6-4,2
Phasenverteilung
Löslich (%): 2,0 - 4,0
Nano (%): 92,0 - 98,0
Mikro (%): 0,0 - 3,0
Primärpartikelgröße
Mediandurchmesser1: 1,5-2,3 nm
Mittlerer Durchmesser1: 1,8-2,8 nm
Dv (10)2: 1,5-2,5 nm
Dv (50)2: 2,5-3,5 nm
Dv (90)2: 5,0-6,0 nm
Schwermetalle
Arsen: < 0,80 mg/kg
Nickel: < 50,0 mg/kg
Lösungsmittelreste
Ethanol: < 500 mg/kg
Mikrobiologische Kriterien
Gesamtzahl der aeroben Bakterien: < 10 KBE/g
Hefen und Schimmelpilze insgesamt: < 10 KBE/g
______
*) Cornell RM und Schwertmann U, 2003. The Iron Oxides: Structure, Properties, Reactions, Occurrences and Uses. Zweite Ausgabe. Wiley. https://doi.org/10.1002/3527602097.
1) Zahlenbasiert (mittels Transmissionselektronenmikroskopie (TEM));
2) Volumenbasiert (hydrodynamischer Durchmesser mittels dynamischer Lichtstreuung (DLS)); KBE: koloniebildende Einheiten. |
| Zugelassenes neuartiges Lebensmittel |
Spezifikation |
|
|
|
| Locusta migratoria (Wanderheuschrecke), gefroren, getrocknet und in Pulverform
Stand: VO (EU) 2021/1975 |
Beschreibung/Definition:
Das neuartige Lebensmittel besteht aus gefrorenen, getrockneten und pulverförmigen Wanderheuschrecken. Der Begriff "Wanderheuschrecke" bezieht sich auf adulte Locusta migratoria, eine Insektenart aus der Familie der Feldheuschrecken (Acrididae) (Unterfamilie Locustinae).
Das neuartige Lebensmittel soll in drei verschiedenen Formen in Verkehr gebracht werden: i) thermisch behandelte und gefrorene L. migratoria (gefrorene LM), ii) thermisch behandelte und gefriergetrocknete L. migratoria (getrocknete LM) und iii) thermisch behandelte, gefriergetrocknete und gemahlene ganze L. migratoria (Pulver von ganzen LM). Getrocknete LM können als solche oder in Pulverform in Verkehr gebracht werden.
Bei gefrorenen LM und getrockneten LM müssen Beine und Flügel entfernt werden, um einer Verstopfung des Darms vorzubeugen, welche durch den Verzehr der großen Stacheln an den Unterschenkeln der Insekten verursacht werden kann. Das Pulver von ganzen LM wird durch mechanisches Mahlen der Insekten samt Flügeln und Beinen und durch Sieben zur Verringerung der Partikelgröße auf weniger als 1 mm gewonnen.
Vor dem Abtöten der Insekten durch Einfrieren ist eine Futterkarenz von mindestens 24 Stunden erforderlich, damit sich die Insekten ihres Darminhalts entledigen können. |
|
|
|
| Parameter |
Gefrorene LM |
Getrocknete LM |
Pulver von ganzen LM |
| Merkmale/Zusammensetzung |
| Asche (% Massenanteil) |
0,6 -1,0 |
2,0 -3,1 |
1,8 -1,9 |
| Feuchtigkeitsgehalt (% Massenanteil) |
67 -73 |
≤ 5 |
≤ 5 |
| Rohprotein (N × 6,25) (% Massenanteil) |
11 -21 |
43 -53 |
50 -60 |
| Fett (% Massenanteil) |
7 -13 |
31 -41 |
31 -41 |
| Gesättigte Fettsäuren (% Fett) |
35 -43 |
35 -43 |
35 -43 |
| Verdauliche Kohlenhydrate (% Massenanteil) |
0,1 -2,0 |
0,1 -2,0 |
1,0 -3,5 |
| 13 Ballaststoffe (% Massenanteil) |
1,5 -3,5 |
5,5 -9,0 |
5,5 -9,0 |
| Chitin (% Massenanteil) |
1,7 -2,4 |
6,4 -10,4 |
10,5 -13,9 |
| Peroxidzahl (Meq O2 /kg Fett) |
≤ 5 |
≤ 5 |
≤ 5 |
| Kontaminanten |
| Blei (mg/kg) |
≤ 0,07 |
≤ 0,07 |
≤ 0,07 |
| Cadmium (mg/kg) |
≤ 0,05 |
≤ 0,05 |
≤ 0,05 |
| Aflatoxine (Summe aus B1, B2, G1, G2) (μg/kg) |
≤ 4 |
≤ 4 |
≤ 4 |
| Aflatoxin B1 (μg/kg) |
≤ 2 |
≤ 2 |
≤ 2 |
| Deoxynivalenol (μg/kg) |
≤ 200 |
≤ 200 |
≤ 200 |
| Ochratoxin a (μg/kg) |
≤ 1 |
≤ 1 |
≤ 1 |
| Summe der Dioxine und dioxinähnlichen PCB Obergrenze ( 14 WHO2005 PCDD/F-PCB-TEQ) (pg/g Fett) |
≤ 1,2 |
≤ 1,2 |
≤ 1,2 |
| Mikrobiologische Kriterien |
| Aerobe mesophile Gesamtkeimzahl ( 7 KBE/g) |
≤ 10 5 |
≤ 10 5 |
≤ 10 5 |
| Enterobacteriaceae (präsumtiv) (KBE/g) |
≤ 100 |
≤ 100 |
≤ 100 |
| Escherichia coli (KBE/g) |
≤ 50 |
≤ 50 |
≤ 50 |
| Listeria monocytogenes |
In 25 g nicht nachweisbar |
In 25 g nicht nachweisbar |
In 25 g nicht nachweisbar |
| Salmonella spp. |
In 25 g nicht nachweisbar |
In 25 g nicht nachweisbar |
In 25 g nicht nachweisbar |
| Bacillus cereus (präsumtiv) (KBE/g) |
≤ 100 |
≤ 100 |
≤ 100 |
| Koagulasepositive Staphylokokken (KBE/g) |
≤ 100 |
≤ 100 |
≤ 100 |
| Sulfitreduzierende Anaerobier (KBE/g) |
≤ 30 |
≤ 30 |
≤ 30 |
| Hefen und Schimmelpilze (KBE/g) |
≤ 100 |
≤ 100 |
≤ 100 |
Beeren vonLonicera caerulea L. (Haskap)
(Traditionelles Lebensmittel aus einem Drittland)
Stand: VO(EU) 2018/1991 |
Beschreibung/Definition:
Bei dem traditionellen Lebensmittel handelt es sich um frische und gefrorene Beeren vonLonicera caerulea var. edulis.
Lonicera caerulea L. ist ein sommergrüner Strauch aus der Familie der Caprifoliaceae.
Typische Nährstoffbestandteile von Haskap-Beeren (frische Beeren):
Kohlenhydrate: 12,8 %
Faser: 2,1 %
Lipide: 0,6 %
Proteine: 0,7 %
Asche: 0,4 %
Wasser: 85,5 % |
|
| Extrakt aus den Blättern der Luzerne (Medicago sativa) |
Beschreibung/Definition:
Die Luzerne (Medicago sativa L.) wird innerhalb von zwei Stunden nach der Ernte verarbeitet. Sie wird geschnitten und gemahlen. Sie durchläuft eine Art Ölpresse, wobei ein faseriger Rückstand und Presssaft (10 % Trockenmasse) entstehen. Die Trockenmasse des Safts enthält ca. 35 % Roheiweiß. Der Presssaft (pH-Wert 5,8-6,2) wird neutralisiert. Durch Vorheizen und Dampfeinspritzung können die mit Carotinoid und Chlorophyllpigmenten assoziierten Proteine koagulieren. Das Proteinpräzipitat wird durch Zentrifugation abgetrennt und anschließend getrocknet. Nach Zugabe von Ascorbinsäure wird das Luzerne-Proteinkonzentrat granuliert und unter Schutzgas oder kühl gelagert.
Zusammensetzung:
Protein: 45-60 %
Fett: 9-11 %
Freie Kohlenhydrate (lösliche Ballaststoffe): 1-2 %
Polysaccharide (unlösliche Ballaststoffe): 11-15 %
einschließlich Zellulose: 2-3 %
Mineralstoffe: 8-13 %
Saponine: ≤ 1,4 %
Isoflavone: ≤ 350 mg/kg
Cumestrol: ≤ 100 mg/kg
Phytate: ≤ 200 mg/kg
L-Canavanin: ≤ 4,5 mg/kg |
|
| Lycopin |
Beschreibung/Definition:
Synthetisches Lycopin wird durch die Wittig-Kondensation von Synthesezwischenprodukten gewonnen, die gewöhnlich bei der Herstellung anderer Carotinoide für Lebensmittel zum Einsatz kommen. Synthetisches Lycopin besteht zu ≥ 96 % aus Lycopin und enthält geringe Mengen anderer verwandter Carotinoid-Bestandteile. Lycopin liegt entweder als Pulver in einer geeigneten Matrix oder als Öldispersion vor. Die Farbe ist dunkelrot oder rot-violett. Oxidationsschutz ist sicherzustellen.
Chemische Bezeichnung: Lycopin
CAS-Nr.: 502-65-8 (all-trans-Lycopin)
Chemische Formel: C40H56
Molmasse: 536,85 Da |
| Lycopin ausBlakeslea trispora |
Beschreibung/Definition:
Gereinigtes Lycopin ausBlakeslea trispora besteht zu ≥ 95 % aus Lycopin und zu ≤ 5 % aus anderen Carotinoiden. Es liegt entweder als Pulver in einer geeigneten Matrix oder als Öldispersion vor. Die Farbe ist dunkelrot oder rot-violett. Oxidationsschutz ist sicherzustellen.
Chemische Bezeichnung: Lycopin
CAS-Nr.: 502-65-8 (all-trans-Lycopin)
Chemische Formel: C40H56
Molmasse: 536,85 Da |
| Lycopin aus Tomaten |
Beschreibung/Definition:
Gereinigtes Lycopin aus Tomaten (Lycopersicon esculantum L.) besteht zu ≥ 95 % aus Lycopin und zu ≤ 5 % aus anderen Carotinoiden. Es liegt entweder als Pulver in einer geeigneten Matrix oder als Öldispersion vor. Die Farbe ist dunkelrot oder rot-violett. Oxidationsschutz ist sicherzustellen.
Chemische Bezeichnung: Lycopin
CAS-Nr.: 502-65-8 (all-trans-Lycopin)
Chemische Formel: C40H56
Molmasse: 536,85 Da |
| Lycopin-Oleoresin aus Tomaten |
Beschreibung/Definition:
Lycopin-Oleoresin aus Tomaten wird durch Extraktion mittels Lösungsmitteln aus reifen Tomaten (Lycopersicon esculentum Mill.) mit anschließender Entfernung des Lösungsmittels gewonnen. Es handelt sich um eine zähe, klare Flüssigkeit roter bis dunkelbrauner Farbe.
Lycopin insgesamte: 5-15 %
davontrans-Lycopin: 90-95 %
Carotinoide insgesamt (berechnet als Lycopin): 6,5-16,5 %
Sonstige Carotinoide: 1,75 %
(Phytoen/Phytofluen/β-Carotin): (0,5-0,75 % bzw. 0,4-0,65 % bzw. 0,2-0,35 %)
Tocopherole insgesamt: 1,5-3,0 %
Unverseifbare Bestandteile: 13-20 %
Fettsäuren insgesamt: 60-75 %
Wasser (nach Karl Fischer): ≤ 0,5 % |
| Lysozymhydrolysat aus Hühnereiweiß
Stand: VO (EU) 2020/1559 |
Beschreibung/Definition
Lysozymhydrolysat aus Hühnereiweiß wird mittels eines enzymatischen Prozesses unter Verwendung von Subtilisin ausBacillus licheniformis aus Hühnereiweiß-Lysozym gewonnen.
Bei dem Produkt handelt es sich um ein weißes bis hellgelbes Pulver.
Spezifikation
Protein (TN * x 5,30): 80-90 %
Trytophan: 5-7 %
Verhältnis Tryptophan/LNAa **: 0,18-0,25
Hydrolysegrad: 19-25 %
Feuchtigkeitsgehalt: < 5 %
Aschegehalt: < 10 %
Natrium: < 6 %
Schwermetalle
Arsen: < 1 ppm
Blei: < 1 ppm
Cadmium: < 0,5 ppm
Quecksilber: < 0,1 ppm
Mikrobiologische Kriterien
Gesamtzahl der aeroben Keime: < 103 KBE/g
Gesamtzahl Hefen/Schimmelpilze (kombiniert): < 102 KBE/g
Enterobakterien: < 10 KBE/g
Salmonellaspp: in 25 g nicht nachweisbar
Escherichia coli: in 10 g nicht nachweisbar
Staphylococcus aureus: in 10 g nicht nachweisbar
Pseudomonas aeruginosa: in 10 g nicht nachweisbar
___
*) TN: Gesamtstickstoff
**) LNAA: große neutrale Aminosäuren |
| Magnesiumcitratmalat |
Beschreibung/Definition:
Magnesiumcitratmalat ist ein weißes bis gelblich-weißes, amorphes Pulver.
Chemische Formel: Mg5(C6H5O7)2(C4H4O5)2
Chemische Bezeichnung: Pentamagnesium-di-(2-hydroxybutandioat)-di-(2-hydroxypropan-1,2,3-tricarboxylat)
CAS-Nr.: 1259381-40-2
Molmasse: 763,99 Daltons (wasserfrei)
Löslichkeit: Frei löslich in Wasser (rund 20 g in 100 ml)
Beschreibung des physikalischen Zustands: amorphes Pulver
Magnesiumgehalt: 12,0-15,0 %
Trocknungsverlust (120 °C/4 h): ≤ 15 %
Farbe (Feststoff): weißes bis gelblich-weißes Pulver
Farbe (20%ige wässrige Lösung): farblos bis gelblich
Beschaffenheit (20%ige wässrige Lösung): klare Lösung
pH (20%ige wässrige Lösung): ca. 6,0
Verunreinigungen:
Chlorid: ≤ 0,05 %
Sulfat: ≤ 0,05 %
Arsen: ≤ 3,0 ppm
Blei: ≤ 2,0 ppm
Cadmium: ≤ 1 ppm
Quecksilber: ≤ 0,1 ppm |
| Magnolienrindenextrakt |
Beschreibung/Definition:
Magnolienrindenextrakt wird aus der Rinde vonMagnolia officinalisL. gewonnen und unter Verwendung von überkritischem Kohlendioxid hergestellt. Die Rinde wird gewaschen und zwecks Feuchteentzugs im Ofen getrocknet und anschließend gemahlen, bevor ihr unter Verwendung von überkritischem Kohlendioxid der Extrakt entzogen wird. Der Pflanzenextrakt wird in Ethanol für medizinische Anwendungen gelöst und anschließend rekristallisiert; dieser Prozess ergibt das Produkt mit der Bezeichnung Magnolienrindenextrakt.
Magnolienrindenextrakt setzt sich hauptsächlich aus den beiden Phenolverbindungen Magnolol und Honokiol zusammen.
Beschaffenheit: Hellbraunes Pulver
Reinheit:
Magnolol: ≥ 85,2 %
Honokiol: ≥ 0,5 %
Magnolol & Honokiol: ≥ 94 %
Gesamteudesmol: ≤ 2 %
Feuchtigkeit: 0,50 %
Schwermetalle:
Arsen (ppm): ≤ 0,5
Blei (ppm): ≤ 0,5
Methyleugenol (ppm): ≤ 10
Tubocurarin (ppm): ≤ 2,0
Gesamtalkaloid (ppm): ≤ 100 |
| Maiskeimöl mit hohem Anteil an unverseifbaren Bestandteilen |
Beschreibung/Definition:
Maiskeimöl mit hohem Anteil an unverseifbaren Bestandteilen wird mittels Vakuumdestillation hergestellt und unterscheidet sich von raffiniertem Maiskeimöl in der Konzentration des unverseifbaren Anteils (1,2 g bei raffiniertem Maiskeimöl und 10 g bei "Maiskeimöl mit hohem Anteil an unverseifbaren Bestandteilen").
Reinheit:
Unverseifbare Bestandteile: > 9,0 g/100 g
Tocopherole: ≥ 1,3 g/100 g
α-Tocopherol (%): 10-25 %
β-Tocopherol (%): < 3,0 %
γ-Tocopherol (%): 68-89 %
δ-Tocopherol (%): < 7,0 %
Sterine, Triterpenalkohole, Methylsterine: > 6,5 g/100 g
Fettsäuren in Triglyceriden:
Palmitinsäure: 10,0-20,0 %
Stearinsäure: < 3,3 %
Ölsäure: 20,0-42,2 %
Linolsäure: 34,0-65,6 %
Linolensäure: < 2,0 %
Säurezahl: ≤ 6,0 mg KOH/g
Peroxidzahl (PV): ≤ 10 mEq O2/kg
Schwermetalle:
Eisen (Fe): < 1.500 µg/kg
Kupfer (Cu): < 100 µg/kg
Verunreinigungen:
Polyzyklische aromatische Kohlenwasserstoffe (PAH) Benzo(a)pyren: < 2 µg/kg
Es ist eine Behandlung mit Aktivkohle erforderlich, um zu gewährleisten, dass bei der Herstellung von "Maiskeimöl mit hohem Anteil an unverseifbaren Bestandteilen" keine polyzyklischen aromatischen Kohlenwasserstoffe (PAH) angereichert werden. |
| Methylcellulose |
Beschreibung/Definition:
Methylcellulose ist eine direkt aus natürlich vorkommenden pflanzlichen Fasern gewonnene Cellulose, die teilweise mit Methylgruppen verethert ist.
Chemische Bezeichnung: Methylether der Cellulose
Chemische Formel: Polymere von substituierten Anhydroglucoseeinheiten der allgemeinen Formel:
C6H7O2(OR1)(OR2)(OR3), wobei R1, R2 und R3 sein können:
Molmasse: Macromoleküle: von etwa 20.000 (n etwa 100) bis etwa 380.000 g/mol (n etwa 2.000)
Gehalt: mindestens 25 % und höchstens 33 % Methoxylgruppen (-OCH3) und höchstens 5 % Hydroxyethylgruppen (-OCH2CH2OH) Leicht hygroskopisches, weißes, leicht gelbliches oder graues geruch- und geschmackloses, körniges oder fasriges Pulver.
Löslichkeit: quillt in Wasser (dabei bildet sich eine klare bis schillernde, zähflüssige kolloidale Lösung); nicht löslich in Ethanol, Ether und Chloroform. Löslich in Eisessig.
Reinheit:
Trocknungsverlust: ≤ 10 % (105 °C, 3 h)
Sulfatasche: ≤ 1,5 %, bestimmt bei 800 ± 25 °C
pH: ≥ 5,0 und ≤ 8,0 (1 % kolloidale Lösung)
Schwermetalle:
Arsen: ≤ 3,0 mg/kg
Blei: ≤ 2,0 mg/kg
Quecksilber: ≤ 1,0 mg/kg
Cadmium: ≤ 1,0 mg/kg |
| 1-Methylnicotinamidchlorid |
Definition
Chemische Bezeichnung: 3-Carbamoyl-1-methyl-pyridiniumchlorid
Strukturformel: C7H9N2OCl
CAS-Nr.: 1005-24-9
Molmasse: 172,61 Da
Beschreibung
1-Methylnicotinamidchlorid ist ein weißer oder cremefarbener kristalliner Feststoff und wird durch chemische Synthese gewonnen.
Merkmale/Zusammensetzung:
Aussehen: weißer bis cremefarbener kristalliner Feststoff
Reinheit: ≥ 98,5 %
Trigonellin: ≤ 0,05 %
Nicotinsäure: ≤ 0,10 %
Nicotinamid: ≤ 0,10 %
Größte unbekannte Verunreinigung: ≤ 0,05 %
Summe unbekannter Verunreinigungen: ≤ 0,20 %
Summe aller Verunreinigungen: ≤ 0,50 %
Löslichkeit: löslich in Wasser und Methanol praktisch unlöslich in 2-Propanol und Dichlormethan
Feuchtigkeitsgehalt: ≤ 0,3 %
Verlust bei Trocknung: ≤ 1,0 %
Glührückstand: ≤ 0,1 %
Lösungsmittelreste und Schwermetalle
Methanol: ≤ 0,3 %
Schwermetalle: ≤ 0,002 %
Mikrobiologische Kriterien
Gesamtzahl der aeroben Bakterien: ≤ 100 KBE/g
Schimmelpilze/Hefe: < 10 KBE/g
Enterobakterien: in 1 g nicht nachweisbar
Pseudomonas aeruginosa: in 1 g nicht nachweisbar
Staphylococcus aureus: in 1 g nicht nachweisbar
KBE: koloniebildende Einheiten |
| (6S)-5-Methyltetrahydrofolsäure, Glucosaminsalz |
Beschreibung/Definition:
Chemische Bezeichnung: N-[4-[[[(6S)-2-Amino-1,4,5,6,7,8-hexahydro-5-methyl-4-oxo-6-pteridinyl]methyl]amino]benzoyl]-L-Glutaminsäure, Glucosaminsalz
Chemische Formel: C32H51N9O16
Molmasse: 817,80 g/mol (wasserfrei)
CAS-Nr.: 1181972-37-1
Aussehen: Cremefarbenes bis hellbraunes Pulver
Reinheit:
Diastereoisomerische Reinheit: mindestens 99 % (6S)-5-Methyltetrahydrofolsäure
Glucosamingehalt: 34-46 %, bezogen auf die Trockenmasse
Gehalt an 5-Methyltetrahydrofolsäure: 54-59 %, bezogen auf die Trockenmasse
Wasser: ≤ 8,0 %
Schwermetalle:
Blei: ≤ 2,0 ppm
Cadmium: ≤ 1,0 ppm
Quecksilber: ≤ 0,1 ppm
Arsen: ≤ 2,0 ppm
Bor: ≤ 10 ppm
Mikrobiologische Kriterien:
Gesamtzahl der aeroben Bakterien: ≤100 KBE/g
Hefen und Schimmelpilze: ≤ 100 KBE/g
Escherichia coli: in 10 g nicht nachweisbar |
| Monomethylsilantriol (Organisches Silicium) |
Beschreibung/Definition:
Chemische Bezeichnung: Silantriol, 1-Methyl-
Chemische Formel: CH6O3Si
Molmasse: 94,14 g/mol
CAS-Nr.: 2445-53-6
Reinheit:
Zubereitung aus organischem Silicium (Monomethylsilantriol) (wässrige Lösung):
Säuregehalt (pH): 6,4-6,8
Silicium: 100-150 mg Si/l
Schwermetalle:
Blei: ≤ 1,0 µg/l
Quecksilber: ≤ 1,0 µg/l
Cadmium: ≤ 1,0 µg/l
Arsen: ≤ 3,0 µg/l
Lösungsmittel:
Methanol: ≤ 5,0 mg/kg (Reste) |
| Zugelassenes neuartiges Lebensmittel |
Spezifikation |
| Mycelauszug aus dem Shiitake-Pilz (Lentinula edodes) |
Beschreibung/Definition:
Die neuartige Lebensmittelzutat ist ein steriler wässriger Auszug aus dem Mycel vonLentinula edodes, das in einer Submersfermentation kultiviert wird. Es ist eine hellbraune, leicht trübe Flüssigkeit.
Lentinan ist ein β-(1-3) β-(1-6)-D-Glucan mit einem Molekulargewicht von ca. 5 × 105 Dalton, einem Verzweigungsgrad von 2/5 und einer Dreifachhelix-Tertiärstruktur.
Reinheit/Zusammensetzung desLentinula-edodes-Mycelauszugs:
Feuchtigkeit: 98 %
Trockenmasse: 2 %
Freie Glucose: < 20 mg/ml
Gesamtprotein1: < 0,1 mg/ml
N-haltige Bestandteile2: < 10 mg/ml
Lentinan: 0,8-1,2 mg/ml
___
1) Bradford-Methode
2) Kjeldahl-Methode |
| Myzelien von Antrodia camphorata in Pulverform
Stand: VO (EU) 2022/2535 |
Beschreibung/Definition:
Bei dem neuartigen Lebensmittel handelt es sich um gefriergetrocknete Myzelien des Pilzes Antrodia camphorata (Stamm BCRC 39106), die mittels Feststoff-Fermentation kultiviert werden. Die gefriergetrockneten Myzelien werden zu einem Pulver zermahlen. Antrodia camphorata ist ein Synonym für Taiwanofungus camphoratus (Familie: Fomitopsidaceae).
Merkmale/Zusammensetzung:
Trocknungsverlust (Feuchtigkeit): < 10 %
Kohlenhydrate: ≤ 80 g/100 g
Protein: ≤ 20 g/100 g
Asche: ≤ 6 g/100 g
Fett: ≤ 6 g/100 g
Gesamt-Triterpenoide: 1,0 bis 10,0 g/100 g
Antrochinonol: 1,0 bis 20,0 mg/g
Schwermetalle:
Arsen: < 0,5 mg/kg
Mikrobiologische Kriterien:
Gesamtzahl der aeroben Bakterien: ≤ 103 *KBE/g
Hefen und Schimmelpilze insgesamt: ≤ 100 KBE/g
Escherichia coli: in 10 g nicht nachweisbar
Salmonella spp.: in 25 g nicht nachweisbar
Staphylococcus aureus: in 10 g nicht nachweisbar
*KBE: koloniebildende Einheiten |
| Mit Myzelien von Lentinula edodes (Shiitake-Pilz) fermentiertes Erbsen- und Reisprotein
Stand: VO (EU) 2023/6 |
Beschreibung:
Das neuartige Lebensmittel wird durch Fermentierung einer Mischung aus Konzentraten von 65 % Erbsenprotein und 35 % Reisprotein mit den Myzelien des Shiitake-Pilzes (Lentinula edodes) hergestellt, anschließend zum Abschluss der Fermentierung wärmebehandelt und einer Reihe von Trocknungsvorgängen unterzogen, um ein Pulver zu erzeugen.
Merkmale/Zusammensetzung:
Protein (% Trockengewicht, N x 6,25): ≥ 75,0
Feuchtigkeit: ≤ 7,0
Gesamtfettgehalt (% Trockengewicht): ≤ 10,0
Asche (% Trockengewicht) ≤ 10,0
Kohlenhydrate (% durch Berechnung) ≤ 15,0
Mykotoxine:
Aflatoxin B1 (μg/kg): < 1,0
Aflatoxin B2 (μg/kg): < 1,0
Aflatoxin G1 (μg/kg): < 1,0
Aflatoxin G2 (μg/kg): < 1,0
Aflatoxin insgesamt (B1+B2+G1+G2) (μg/kg): < 3,0
Schwermetalle:
Arsen (μg/g): < 0,1
Kadmium (μg/g): < 0,1
Blei (μg/g): < 0,3
Quecksilber (μg/g): < 0,1
Mikrobiologische Kriterien:
Gesamtzahl der aeroben Bakterien: < 1.000 KBE/g
Gesamtzahl Hefen/Schimmelpilze: < 100 KBE/g
Coliforme: ≤ 10 KBE/g
Salmonella spp.: in 25 g nicht nachweisbar
Escherichia coli: < 10 KBE/g
Listeria monocytogenes: in 25 g nicht nachweisbar
*KBE: koloniebildende Einheiten |
| Nicotinamid-Ribosidchlorid
Stand: VO"en (EU) 2022/1160; 2020/16 |
Beschreibung/Definition:
Bei dem neuartigen Lebensmittel handelt es sich um eine synthetische Form von Nicotinamidribosid. Das neuartige Lebensmittel enthält ≥ 90 % Nicotinamid-Ribosidchlorid, überwiegend in seiner β-Form; die übrigen Bestandteile sind Lösungsmittelreste, Reaktionsnebenprodukte und Abbauprodukte.
Nicotinamid-Ribosidchlorid:
CAS-Nr.: 23111-00-4
EG-Nr.: 807-820-5
IUPAC-Bezeichnung: 1-[(2R,3R,4S,5R)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]pyridin-1-ium-3-carboxamide; chloride
Chemische Formel: C11H15N2O5Cl
Molmasse: 290,7 g/mol
Merkmale/Zusammensetzung:
Farbe: weiß bis hellbraun
Form: Pulver
Identifikation: bestätigt durch NMR (Kernspinresonanz)
Nicotinamid-Ribosidchlorid: ≥ 90 %
Wassergehalt: ≤ 2 %
Lösungsmittelreste:
Aceton: ≤ 5.000 mg/kg
Methanol: ≤ 1.000 mg/kg
Acetonitril: ≤ 50 mg/kg
Methyl-tert-butylether: ≤ 500 mg/kg
Reaktionsnebenprodukte:
Methylacetat: ≤ 1.000 mg/kg
Acetamid: ≤ 27 mg/kg
Essigsäure: ≤ 5.000 mg/kg
Schwermetalle:
Arsen: ≤ 1 mg/kg
Quecksilber *: ≤ 0,1 mg/kg
Cadmium *: ≤ 1 mg/kg
Blei * ≤ 0,5 mg/kg
Mikrobiologische Kriterien:
Gesamtkeimzahl: < 1.000 KBE/g(b)
Hefen und Schimmelpilze: < 100 KBE/g
Escherichia coli: in 10 g nicht nachweisbar
KBE: koloniebildende Einheiten
____
*) nur für Lebensmittel für besondere medizinische Zwecke, Tagesrationen für gewichtskontrollierende Ernährung und Mahlzeitersatz |
| Noni-Fruchtsaft (Morinda citrifolia) |
Beschreibung/Definition:
Die Noni-Früchte (Früchte vonMorinda citrifolia L.) werden gepresst. Der gewonnene Saft wird pasteurisiert. Vor oder nach dem Pressen kann eine Fermentation stattfinden.
Rubiadin: ≤ 10 µg/kg
Lucidin: ≤ 10 µg/kg |
| Noni-Fruchtsaftpulver (Morinda citrifolia) |
Beschreibung/Definition:
Samen und Schale der sonnengetrockneten Früchte vonMorinda citrifolia werden entfernt. Das gewonnene Fruchtfleisch wird gefiltert, um Saft und Fleisch zu trennen. Für die Trocknung des gewonnenen Safts gibt es zwei Verfahren:
Mikronisieren mit Maltodextrin aus Mais als Trägerstoff; die Mischung wird durch einen gleichmäßigen Fluss von Saft und Maltodextrin gewonnen;
Zeolith-Trocknung ("Zeodratation") oder Trocknen und Mischen mit einem Hilfsstoff; bei diesem Verfahren kann der Saft zuerst getrocknet und dann mit Maltodextrin vermischt werden (gleiche Menge wie beim Mikronisieren). |
| Nonifruchtpüree und -konzentrat (Morinda citrifolia) |
Beschreibung/Definition:
Die Früchte vonMorinda citrifolia werden von Hand geerntet. Samen und Schale können mechanisch von den pürierten Früchten getrennt werden. Nach der Pasteurisierung wird das Püree in sterile Behälter verpackt und kühl gelagert.
Das Konzentrat ausMorinda citrifolia wird aus Püree von M. citrifolia durch Behandlung mit pektolytischen Enzymen (50-60 °C, 1-2 h) hergestellt. Danach wird das Püree zur Inaktivierung der Pektinasen erhitzt und unmittelbar wieder abgekühlt. Der Saft wird in einer Absetzzentrifuge abgetrennt, aufgefangen und pasteurisiert, bevor er in einem Vakuumverdampfer von einem Brix-Wert von 6 bis 8 auf einen Brix-Wert von 49 bis 51 im Endkonzentrat konzentriert wird.
Zusammensetzung:
Püree:
Feuchtigkeit: 89-93 %
Protein: < 0,6 g/100 g
Fett: ≤ 0,4 g/100 g
Asche: < 1,0 g/100 g
Gesamtkohlenhydrate: 5-10 g/100 g
Fructose: 0,5-3,82 g/100 g
Glucose: 0,5-3,14 g/100 g
Ballaststoffe: < 0,5-3 g/100 g
5,15-Dimethylmorindol1: ≤ 0,254 µg/ml
Lucidin1: nicht nachweisbar
Alizarin1: nicht nachweisbar
Rubiadin1: nicht nachweisbar
Konzentrat:
Feuchtigkeit: 48-53 %
Protein: 3-3,5 g/100 g
Fett: < 0,04 g/100 g
Asche: 4,5-5,0 g/100 g
Gesamtkohlenhydrate: 37-45 g/100 g
Fructose: 9-11 g/100 g
Glucose: 9-11 g/100 g
Ballaststoffe: 1,5-5,0 g/100 g
5,15-Dimethylmorindol1: ≤ 0,254 µg/ml
___
1) Durch eine für die Analyse der Anthrachinone in Püree und Konzentrat aus Morinda citrifolia puree entwickelte und validierte HPLC-UV-Methode. Nachweisgrenze: 2,5 ng/ml (5,15-Dimethylmorindol); 50,0 ng/ml (Lucidin); 6,3 ng/ml (Alizarin) und 62,5 ng/ml (Rubiadin). |
| Noniblätter (Morinda citrifolia) |
Beschreibung/Definition:
Die geschnittenen Blätter vonMorinda citrifolia werden getrocknet und geröstet. Die Größe der Bestandteile des Produkts reicht von zerbrochenen Blättern bis hin zu grobem Pulver mit kleinen Blattteilchen. Es ist von grünbrauner bis brauner Farbe.
Reinheit/Zusammensetzung:
Feuchtigkeit: < 5,2 %
Protein: 17-20 %
Kohlenhydrate: 55-65 %
Asche: 10-13 %
Fett: 4-9 %
Oxalsäure: < 0,14 %
Gerbsäure: < 2,7 %
5,15-Dimethylmorindol: < 47 mg/kg
Rubiadin: nicht nachweisbar, ≤ 10 µg/kg
Lucidin: nicht nachweisbar, ≤ 10 µg/kg |
| Nonifruchtpulver (Morinda citrifolia) |
Beschreibung/Definition:
Nonifruchtpulver wird durch Gefriertrocknen von Nonifruchtpüree (Morinda citrifolia L.) gewonnen. Die Früchte werden püriert und die Samen entfernt. Nach dem Gefriertrocknen, in dessen Verlauf den Noni-Früchten das Wasser entzogen wird, wird das verbleibende Fruchtfleisch zu einem Pulver zermahlen und in Kapseln abgefüllt.
Reinheit/Zusammensetzung:
Feuchtigkeit: 5,3-9 %
Protein: 3,8-4,8 g/100 g
Fett: 1-2 g/100 g
Asche: 4,6-5,7 g/100 g
Gesamtkohlenhydrate: 80-85 g/100 g
Fructose: 20,4-22,5 g/100 g
Glucose: 22-25 g/100 g
Ballaststoffe: 15,4-24,5 g/100 g
5,15-Dimethylmorindol1: ≤ 2,0 µg/ml
___
1) Durch eine für die Analyse der Anthrachinone in Püree und Konzentrat aus Morinda citrifolia entwickelte und validierte HPLC-UV-Methode. Nachweisgrenze: 2,5 ng/ml (5,15-Dimethylmorindol) |
| MikroalgeOdontella aurita |
Silicium: 3,3 %
Kristallines Siliciumdioxid: max. 0,1-0,3 % als Verunreinigung |
| Osteopontin aus Kuhmilch
Stand: VO (EU) 2023/463 |
Beschreibung
Osteopontin aus Kuhmilch wird durch Ionenaustauschchromatografie, Ultrafiltration zur Entfernung von niedrigmolekularen Bestandteilen und Sprühtrocknung aus pasteurisierter oder mikrofiltrierter Kuhmolke oder Kuhmilch isoliert. Während des Filtrationsvorganges werden Laktose und Molkenproteine, in erster Linie α-Lactalbumin und β-Lactoglobulin, entfernt.
Merkmale/Zusammensetzung
Proteingehalt (de facto, %) (N × 6,38): 76,5-80,5
Osteopontin aus Kuhmilch (mbOPN) (% des Proteingehalts): ≥ 84,5
Volllängen-bmOPN (M: 33,9 kDa) (% des bmOPN-Gehalts): ≥ 15
N-terminale bmOPN-Fragmente (M: 19,8 kDa) (% des bmOPN-Gehalts): ≥ 70
Sonstiges Milcheiweiß (% des Proteingehalts): ≤ 14,5
Feuchtigkeit: < 9,5 %
Laktose: ≤ 1,0 %
Fett: ≤ 1,0 %
Asche: ≤ 11 %
Unlöslichkeitsindex (ml): ≤ 1,0
Schwermetalle
Blei: < 0,05 mg/kg
Kadmium: < 0,05 mg/kg
Quecksilber: < 0,05 mg/kg
Arsen: < 0,5 mg/kg
Aflatoxin M1: < 0,1 μg/kg
Mikrobiologische Kriterien
Gesamtkeimzahl (30 °C) (KBE/g): ≤ 5.000
Schimmel/Hefe (KBE/g): ≤ 100
Bacillus cereus (KBE/g): < 50
Sulfitreduzierende Clostridien (KBE/g): < 10
Staphylococcus aureus: in 1 g nicht nachweisbar
Enterobacteriaceae (KBE/g): < 10
Salmonella spp.: in 25 g nicht nachweisbar
KBE: koloniebildende Einheiten |
| Mit Phytosterinen/Phytostanolen angereichertes Öl |
Beschreibung/Definition:
Mit Phytosterinen/Phytostanolen angereichertes Öl besteht aus einer Ölfraktion und einer Phytosterolfraktion.
Acylglycerid-Verteilung:
Freie Fettsäuren (ausgedrückt als Ölsäure): ≤ 2,0 %
Monoacylglyceride (MAG): ≤ 10 %
Diacylglyceride (DAG): ≤ 25 %
Triacylglyceride (TAG): Rest
Phytosterinfraktion:
β-Sitosterin: ≤ 80 %
β-Sitostanol: ≤ 15 %
Campesterin: ≤ 40 %
Campestanol: ≤ 5,0 %
Stigmasterin: ≤ 30 %
Brassicasterin: ≤ 3,0 %
andere Sterine/Stanole: ≤ 3,0 %
Sonstige:
Feuchtigkeit und flüchtige Bestandteile: ≤ 0,5 %
Peroxidzahl (PV): < 5,0 meq/kg
trans-Fettsäuren: ≤ 1 %
Verunreinigung/Reinheit (GC-FID oder gleichwertiges Verfahren) von Phytosterinen/Phytostanolen:
Phytosterine und Phytostanole, die aus anderen Quellen als lebensmittelgeeigneten Pflanzenölen gewonnen wurden, müssen frei von Kontaminanten sein, was am besten durch eine Reinheit von mehr als 99 % gewährleistet wird. |
| Aus Kalmaren gewonnenes Öl |
Säurezahl: ≤ 0,5 KOH/g oil
Peroxidzahl (PV): ≤ 5 meq O2/kg Öl
p-Anisidinzahl: ≤ 20
Kältetest bei 0 °C: ≤ 3 Stunden
Feuchtigkeit: ≤ 0,1 % (w/w)
Unverseifbare Bestandteile: ≤ 5,0 %
trans-Fettsäuren: ≤ 1,0 %
Docosahexaensäure: ≥ 20 %
Eicosapentaensäure: ≥ 10 % |
| Zugelassenes neuartiges Lebensmittel |
Spezifikation |
| Hochdruckpasteurisierte Fruchtzubereitungen |
Parameter |
Ziel |
Anmerkungen |
| Lagerung der Früchte vor der Hochdruckpasteurisierung |
Mindestens 15 Tage bei -20 °C |
Die Früchte sind entsprechend der guten/hygienischen Landwirtschafts- und Herstellungspraxis geerntet und gelagert worden. |
| Früchtezusatz |
40-60 % aufgetaute Früchte |
Früchte homogenisiert und anderen Zutaten hinzugefügt |
| pH |
3,2-4,2 |
|
| °Brix |
7-42 |
Durch Zuckerzusatz gewährleistet |
| aw |
< 0,95 |
Durch Zuckerzusatz gewährleistet |
| Letzte Lagerung |
Höchstens 60 Tage bei höchstens +5 °C |
Entsprechend den Lagerungsbedingungen für konventionell verarbeitete Produkte |
| Extrakt aus Panax notoginseng und Astragalus membranaceus
Stand: VO (EU) 2020/1821 |
Beschreibung/Definition:
Das neuartige Lebensmittel enthält zwei Extrakte. Einer ist ein Ethanolextrakt aus den Wurzeln von Astragalus membranaceus (Fisch.) Bunge. Der andere ist ein Heißwasserextrakt aus den Wurzeln von Panax notoginseng (Burkill) F.H. Chen, der durch Absorption auf einem Harz weiter konzentriert und anschließend mit 60 % Ethanol eluiert wird. Am Ende des Herstellungsprozesses werden beide Extrakte (45-47,5 % jedes Extrakts) mit Maltodextrin (5-10 %) gemischt.
Merkmale/Zusammensetzung:
Saponine insgesamt: 1,5-5 %
Ginsenosid Rb1: 0,1-0,5 %
Astragalosid I: 0,01-0,1 %
Kohlenhydrate: ≥ 90 %
Proteingehalt: ≤ 4,5 %
Asche: ≤ 1 %
Feuchtigkeitsgehalt: ≤ 5 %
Fett: ≤ 1,5 %
Schwermetalle:
Arsen: ≤ 0,3 mg/kg
Mikrobiologische Kriterien:
Gesamtkeimzahl: ≤ 5.000 KBE/g
Hefen und Schimmelpilze insgesamt: ≤ 500 KBE/g
Enterobakterien: < 10 KBE/g
Escherichia coli: in 25 g nicht nachweisbar
Salmonellen: in 375 g nicht nachweisbar
Staphylococcus aureus: in 25 g nicht nachweisbar
KBE: koloniebildende Einheit. |
| Phenylcapsaicin
Stand: VO (EU) 2019/1976 |
Beschreibung/Definition:
Phenylcapsaicin (N-[(4-hydroxy-3-methoxyphenyl)methyl]-7-phenylhept-6-ynamid, C21H23NO3, CAS-Nr.: 848127-67-3), wird chemisch in einem zweistufigen Syntheseprozess hergestellt, der zur Herstellung von Phenylcapsaicin in einem ersten Schritt die Herstellung des Acetylensäure-Zwischenprodukts durch eine Reaktion von Phenylacetylen mit einem Carbonsäurederivat und in einem zweiten Schritt eine Reihe von Reaktionen des Acetylensäure-Zwischenprodukts mit einem Vanillylaminderivat umfasst.
Merkmale/Zusammensetzung
Reinheit (Prozentanteil Trockenmasse): ≥ 98 %
Feuchtigkeit: ≤ 0,5 %
Gesamtheit der synthesebezogenen Herstellungsnebenprodukte ≤ 1,0 %
N,N-Dimethylformamid: ≤ 880 mg/kg
Dichlormethan: ≤ 600 mg/kg
Dimethoxyethan: ≤ 100 mg/kg
Ethylacetat: ≤ 0,5 %
Andere Lösungsmittel: ≤ 0,5 %
Schwermetalle:
Blei: ≤ 1,0 mg/kg
Cadmium: ≤ 1,0 mg/kg
Quecksilber: ≤ 0,1 mg/kg
Arsen: ≤ 1,0 mg/kg
Mikrobiologische Kriterien:
Gesamtkeimzahl: ≤ 10 KBE/g
Coliforme: ≤ 10 KBE/g
Escherichia coli: negativ/10 g
Salmonella sp.: negativ/10 g
Hefen und Schimmelpilze: ≤ 10 KBE/g
KBE: koloniebildende Einheiten |
| Phosphatierte Maisstärke |
Beschreibung/Definition:
Phosphatierte Maisstärke (phosphatiertes Distärkephosphat) ist eine chemisch veränderte resistente Stärke, die aus amylosereicher Stärke durch Kombination chemischer Behandlungen zur Schaffung von Phosphatvernetzungen zwischen Kohlenhydratresten und veresterten Hydroxylgruppen gewonnen wird.
Die neuartige Lebensmittelzutat ist ein weißes oder fast weißes Pulver.
CAS-Nr.: 11120-02-8
Chemische Formel: (C6H10O5)n [(C6H9O5)2PO2H]x [(C6H9O5)PO3H2]y
n = Anzahl Glucoseeinheiten; x, y = Substitutionsgrade
Chemische Merkmale von phosphatiertem Distärkephosphat:
Trocknungsverlust: 10-14 %
pH: 4,5-7,5
Ballaststoffe: ≥ 70 %
Stärke: 7-14 %
Protein: ≤ 0,8 %
Lipide: ≤ 0,8 %
Gebundener Restphosphor: ≤ 0,4 % (als Phosphor) "amylosereicher Mais" als Quelle |
| Phosphatierte Weizenstärke
Stand: VO (EU) 2023/937 |
Beschreibung:
Aus Weizenstärke hergestelltes phosphatiertes Distärkephosphat (phosphatierte Weizenstärke) ist eine chemisch veränderte resistente Stärke, die gewonnen wird durch die Kombination chemischer Behandlungen zur Schaffung von Phosphatvernetzungen innerhalb von und zwischen einzelnen Stärkemolekülen.
Die neuartige Lebensmittelzutat ist ein weißes oder nahezu weißes rieselfähiges Pulver.
Merkmale/Zusammensetzung:
CAS-Nr.: 11120-02-8
Chemische Formel: (C6H10O5)n [(C6H9O5)2PO2H]x [(C6H9O5)PO3H2]y
n = Anzahl Glucoseeinheiten; x, y = Substitutionsgrade |
| Parameter |
Pulverform 1 |
Pulverform 2 |
| Phosphatiertes Distärkephosphat (bezogen auf die Trockenmasse) |
≥ 85 % |
≥ 75 % |
| Nicht modifizierte Weizenstärke (bezogen auf die Trockenmasse) |
≤ 15 % |
≤ 25 % |
| Feuchtigkeit |
9 -12 % |
| Ballaststoffe insgesamt (bezogen auf die Trockenmasse) |
≥ 76,0 % |
≥ 66,0 % |
| Asche |
≤ 3 % |
| Protein |
≤ 0,5 % |
| Gesamtfettgehalt |
≤ 0,50 % |
≤ 0,34 % |
| Gebundener Restphosphor |
≤ 0,4 % (als Phosphor) |
| pH (25%ige Suspension) |
4,5 -6,5 |
Schwermetalle:
Arsen: ≤ 1 mg/kg
Blei: ≤ 2 mg/kg
Quecksilber: ≤ 0,1 mg/kg
Mikrobiologische Kriterien:
Gesamtkeimzahl: ≤ 104 KBE/g
Hefen und Schimmelpilze insgesamt: ≤ 200 KBE/g
Escherichia coli: negativ
Salmonella spp.: negativ
KBE: Koloniebildende Einheiten |
| Phosphatidylserin aus Fisch-Phospholipiden |
Beschreibung/Definition:
Die neuartige Lebensmittelzutat ist ein gelbes bis braunes Pulver. Phosphatidylserin wird durch enzymatische Transphosphatidylierung mit der Aminosäure L-Serin aus Fisch-Phospholipiden gewonnen.
Spezifikation für Phosphatidylserin aus Fisch-Phospholipiden:
Feuchtigkeit: < 5,0 %
Phospholipide: ≥ 75 %
Phosphatidylserin: ≥ 35 %
Glyceride: < 4,0 %
Freies L-Serin: < 1,0 %
Tocopherole: < 0,5 %1
Peroxidzahl (PV): < 5,0 meq O2/kg
___
1) Gemäß der Verordnung (EU) Nr. 1129/2011 der Kommission dürfen Tocopherole als Antioxidantien hinzugefügt werden. |
| Phosphatidylserin aus Soja-Phospholipiden |
Beschreibung/Definition:
Die neuartige Lebensmittelzutat ist ein cremefarbenes bis hellgelbes Pulver. Es ist auch in flüssiger Form mit hellbrauner bis oranger Farbe erhältlich. Die flüssige Form enthält mittelkettige Triacylglycerole (MCT) als Trägerstoff. Sie enthält geringere Mengen an Phosphatidylserin, weil sie beträchtliche Mengen an Öl (MCT) enthält.
Phosphatidylserin aus Soja-Phospholipiden wird durch enzymatische Transphosphatidylierung aus phosphatidylcholinreichem Sojabohnenlecithin mit der Aminosäure L-Serin gewonnen. Phosphatidylserin besteht aus einem Glycerophosphatskelett, das mit zwei Fettsäuren und L-Serin über eine Phosphodiester-Bindung konjugiert ist.
Merkmale von Phosphatidylserin aus Soja-Phospholipiden:
Pulver:
Feuchtigkeit: < 2,0 %
Phospholipide: ≥ 85 %
Phosphatidylserin: ≥ 61 %
Glyceride: < 2,0 %
Freies L-Serin: < 1,0 %
Tocopherole: < 0,3 %
Phytosterine: < 0,2 %
Flüssige Form:
Feuchtigkeit: < 2,0 %
Phospholipide: ≥ 25 %
Phosphatidylserin: ≥ 20 %
Glyceride: keine Angabe
Freies L-Serin: < 1,0 %
Tocopherole: < 0,3 %
Phytosterine: < 0,2 % |
| Phospholipidprodukt mit gleichen Anteilen an Phosphatidylserin und Phosphatidsäure |
Beschreibung/Definition:
Die Herstellung des Produkts erfolgt durch enzymatische Umsetzung von Sojalecithin. Das Phospholipidprodukt ist ein hochkonzentriertes gelbbraunes Pulver aus Phosphatidylserin und Phosphatidsäure zu gleichen Anteilen.
Spezifikation des Produktes:
Feuchtigkeit: ≤ 2,0 %
Gesamtphospholipide: ≥ 70 %
Phosphatidylserin: ≥ 20 %
Phosphatidsäure: ≥ 20 %
Glyceride: ≤ 1,0 %
Freies L-Serin: ≤ 1,0 %
Tocopherole: ≤ 0,3 %
Phytosterine: ≤ 2,0 %
Siliciumdioxid wird bis zu einem Höchstgehalt von 1,0 % zugesetzt. |
| Phospholipide aus Eigelb |
Phospholipide aus Eigelb mit einem Reinheitsgrad von 85 % und 100 % |
| Phytoglycogen |
Beschreibung:
Weißes bis cremefarbenes Pulver eines geruch-, farb- und geschmacklosen Polysaccharids, das mit konventionellen Techniken der Lebensmittelverarbeitung aus gentechnikfreiem Zuckermais gewonnen wird.
Definition:
Glucosepolymer (C6H12O6)n aus linear verknüpften glycosidischen α(1-4)-Bindungen, die alle 8 bis 12 Glucoseeinheiten durch glycosidische α(1-6)-Bindungen verzweigen
Spezifikationen:
Kohlenhydrate: 97 %
Zucker: 0,5 %
Ballaststoffe: 0,8 %
Fett: 0,2 %
Protein: 0,6 % |
| Phytosterine/Phytostanole |
Beschreibung/Definition:
Phytosterine und Phytostanole sind aus Pflanzen extrahierte Sterine und Stanole, die sich als freie Sterine und Stanole darstellen oder mit lebensmittelgeeigneten Fettsäuren verestert werden.
Zusammensetzung (ermittelt durch GC-FID oder gleichwertiges Verfahren):
β- Sitosterin: < 81 %
β-Sitostanol: < 35 %
Campesterin: < 40 %
Campestanol: < 15 %
Stigmasterin: < 30 %
Brassicasterin: < 3,0 %
andere Sterine/Stanole: < 3,0 %
Verunreinigung/Reinheit (GC-FID oder gleichwertiges Verfahren):
Phytosterine und Phytostanole, die aus anderen Quellen als lebensmittelgeeigneten Pflanzenölen gewonnen wurden, müssen frei von Kontaminanten sein, was am besten durch eine Reinheit von mehr als 99 % der Phytosterin-/Phytostanolzutat gewährleistet wird. |
| Pflaumenkernöl |
Beschreibung/Definition:
Pflaumenkernöl ist ein Pflanzenöl, das durch Kaltpressen von Pflaumenkernen (Prunus domestica) gewonnen wird.
Zusammensetzung:
Ölsäure (C18:1): 68 %
Linolsäure (C18:2): 23 %
γ-Tocopherol: 80 % der Gesamttocopherole
β- Sitosterin: 80-90 % der Gesamtsterine
Triolein: 40-55 % Triglyceride
Cyanwasserstoffsäure: höchstens 5 mg/kg Öl |
| Kartoffelproteine (koaguliert) und daraus hergestellte Hydrolysate |
Trockenmasse: ≥ 800 mg/g
Protein (N * 6,25): ≥ 600 mg/g (Trockenmasse)
Asche: ≤ 400 mg/g (Trockenmasse)
Glycoalkaloid (gesamt): ≤ 150 mg/kg
Lysinoalanin (gesamt): ≤ 500 mg/kg
Lysinoalanin (frei): ≤ 10 mg/kg |
| Prolyloligopeptidase (Enzymzubereitung) |
Spezifikation des Enzyms:
Systematischer Name: Prolyloligopeptidase
Synonyme: Prolylendopeptidase, prolinspezifische Endopeptidase, Endoprolylpeptidase
Molmasse: 66 kDa
Nummer der Enzymkommission: EC 3.4.21.26
CAS-Nummer: 72162-84-6
Quelle: Genetisch veränderter Stamm vonAspergillus niger (GEP-44)
Beschreibung:
Prolyloligopeptidase ist als Enzymzubereitung verfügbar, die ca. 30 % Maltodextrin enthält.
Spezifikationen der Enzymzubereitung aus Prolyloligopeptidase:
Aktivität: > 580.000 PPI1/g (> 34,8 PPU2/g)
Erscheinungsform: Mikrogranulat
Farbe: Cremefarben bis gelblich-orangefarben. Die Farbe kann sich von Charge zu Charge ändern.
Trockenmasse: > 94 %
Gluten: < 20 ppm
Schwermetalle:
Blei: ≤ 1,0 mg/kg
Arsen: ≤ 1,0 mg/kg
Cadmium: ≤ 0,5 mg/kg
Quecksilber: ≤ 0,1 mg/kg
Mikrobiologische Kriterien:
Gesamtzahl der aeroben Keime: ≤ 103 KBE/g
Gesamtzahl Hefen und Schimmel: ≤ 102 KBE/g
Sulfitreduzierende Anaerobier: ≤ 30 KBE/g
Enterobakterien: < 10 KBE/g
Salmonellen: in 25 g nicht nachweisbar
Escherichia coli: in 25 g nicht nachweisbar
Staphylococcus aureus: in 10 g nicht nachweisbar
Pseudomonas aeruginosa: in 10 g nicht nachweisbar
Listeria monocytogenes: in 10 g nicht nachweisbar
Antimikrobielle Aktivität: nicht nachweisbar
Mykotoxine: Unter den Nachweisgrenzen: Aflatoxin B1, B2, G1, G2 (< 0,25 µg/kg), Aflatoxine insgesamt (< 2,0 µg/kg), Ochratoxin a (< 0,20 µg/kg), T-2-Toxin (< 5 µg/kg), Zearalenon (< 2,5 µg/kg), Fumonisin B1 und B2 (< 2,5 µg/kg)
____
1) PPI - Protease Picomole International
2) PPU - Prolyl Peptidase Units oder Proline Protease Units |
| Protein aus Mungbohnen (Vigna radiata)
Stand: VO (EU) 2022/673 |
Beschreibung/Definition:
Bei dem neuartigen Lebensmittel handelt es sich um Mungbohnen-Proteinpulver, das aus den Samen der Pflanze Vigna radiata in mehreren Verarbeitungsschritten extrahiert und anschließend pasteurisiert und sprühgetrocknet wird.
Merkmale/Zusammensetzung:
Feuchtigkeit: ≤ 6 %
Protein (Massenanteil)a: ≥ 84 %
Asche (Massenanteil): ≤ 6,0 %
Fett (Massenanteil): ≤ 5,5 %
Kohlenhydrate (Massenanteil): ≤ 5,0 durch Berechnung
Mikrobiologische Kriterien:
Zahl der aeroben Keime: < 5.000 KBE/gb
Hefen und Schimmelpilze: < 100 KBE/g
Coliforme: < 100 KBE/g
Escherichia coli: < 10 KBE/g
Listeria monocytogenes: In 25 g nicht nachweisbar
Salmonella spp.: In 25 g nicht nachweisbar
_____
a) Massenanteil: Gewicht pro Gewicht.
b) KBE: koloniebildende Einheiten. |
| Zugelassenes neuartiges Lebensmittel |
Spezifikation |
| trans-Resveratrol
Stand: VO (EU) 2022/672 |
Beschreibung/Definition:
Synthetisch: trans-Resveratrol besteht aus cremefarbenen bis beigefarbenen Kristallen.
Chemische Bezeichnung: 5-[(E)-2-(4-hydroxyphenyl)ethenyl]benzen-1,3-diol
Chemische Formel: C14H12O3
Molmasse: 228,25 Da
CAS-Nr.: 501-36-0
Reinheit:
trans-Resveratrol: ≥ 98-99 %
Summe aller Nebenprodukte (verwandte Stoffe): ≤ 0,5 %
Jeder einzelne verwandte Stoff: ≤ 0,1 %
Sulfatasche: ≤ 0,1 %
Trocknungsverlust: ≤ 0,5 %
Schwermetalle:
Blei: ≤ 1,0 ppm
Quecksilber: ≤ 0,1 ppm
Arsen: ≤ 1,0 ppm
Verunreinigungen:
Diisopropylamin: ≤ 50 mg/kg
Mikrobielle Quelle: genetisch veränderter Stamm von Saccharomyces cerevisiae
Aussehen: cremefarbenes bis leicht gelbes Pulver
Gehalt an trans-Resveratrol: mind. 98 % Massenanteil (Trockengewicht)
Asche: max. 0,5 % Massenanteil
Feuchtigkeit: max. 3 % Massenanteil |
| Hahnenkammextrakt |
Beschreibung/Definition:
Hahnenkammextrakt wird vonGallus gallus durch enzymatische Hydrolyse von Hahnenkämmen und durch anschließende Filtration, Konzentration und Ausfällung gewonnen. Hauptbestandteile von Hahnenkammextrakt sind die Glycosaminoglycane Hyaluronsäure, Chondroitinsulfat a und Dermatansulfat (Chondroitinsulfat B). Weißes oder fast weißes hygroskopisches Pulver.
Hyaluronsäure: 60-80 %
Chondroitinsulfat A: ≤ 5,0 %
Dermatansulfat (Chondroitinsulfat B): ≤ 25 %
pH: 5,0-8,5
Reinheit:
Chloride: ≤ 1,0 %
Stickstoff: ≤ 8,0 %
Trocknungsverlust: (105 °C über 6 h): ≤10 %
Schwermetalle:
Quecksilber: ≤0,1 mg/kg
Arsen: ≤ 1,0 mg/kg
Cadmium: ≤ 1,0 mg/kg
Chrom: ≤ 10 mg/kg
Blei: ≤ 0,5 mg/kg
Mikrobiologische Kriterien:
Gesamtkeimzahl: ≤ 102 KBE/g
Escherichia coli: in 1 g nicht nachweisbar
Salmonellen: in 1 g nicht nachweisbar
Staphylococcus aureus: in 1 g nicht nachweisbar
Pseudomonas aeruginosa: in 1 g nicht nachweisbar |
| Sacha-Inchi-Öl ausPlukenetia volubilis |
Beschreibung/Definition:
Sacha-Inchi-Öl ist ein zu 100 % kalt gepresstes Pflanzenöl aus den Samen von Plukenetia volubiis L. Es ist bei Raumtemperatur transparent, flüssig und glänzend. Der Geschmack ist fruchtig, leicht, erinnert an grünes Gemüse ohne unerwünschte Noten.
Aussehen: Transparenz, Glanz, Farbe: Bei Raumtemperatur flüssig, rein, goldgelb
Geruch und Geschmack: Fruchtig, ohne unerwünschte Noten
Reinheit:
Wasser und flüchtige Stoffe: < 0,2 g/100 g
In Hexan nicht lösliche Verunreinigungen: < 0,05 g/100 g
Ölsäuregehalt: < 2,0 g/100 g
Peroxidzahl (PV): < 15 meq O2/kg
trans-Fettsäuren: < 1,0 g/100 g
Ungesättigte Fettsäuren insgesamt: > 90 %
Omega-3-alpha-Linolensäure (ALA): > 45 %
Gesättigte Fettsäuren: < 10 %
keinetrans-Fettsäuren (< 0,5 %)
keine Erucasäure (< 0,2 %)
mehr als 50 % Tri-Linolensäure- und Di-Linolensäure-Triglyceride
Phytosterine: Zusammensetzung und Gehalt:
kein Cholesterin (< 5,0 mg/100 g) |
| Salatrims |
Beschreibung/Definition:
Salatrim ist das international anerkannte Akronym für "Short and long chain acyl triglyceride molecule". Gewonnen wird Salatrim durch Umesterung, ohne Verwendung von Enzymen, von Triacetin, Tripropionin bzw. Tributyrin oder deren Mischungen mit hydriertem Raps-, Soja- Baumwollsaat- oder Sonnenblumenöl. Beschreibung: Klare leicht bernsteinfarbene Flüssigkeit bis hell gefärbter wachsartiger Feststoff bei Zimmertemperatur. Frei von Schwebstoffen und von Fremd- bzw. ranzigem Geruch.
Glyceridesterverteilung:
Triacylglyceride: > 87 %
Diacylglyceride: ≤ 10 %
Monoacylglyceride: ≤ 2,0 %
Fettsäurezusammensetzung:
Mol-% langkettige Fettsäuren: 33-70 %
Mol-% kurzkettige Fettsäuren: 30-67 %
Langkettige gesättigte Fettsäuren: < 70 % Gewichtsanteil
trans-Fettsäuren: ≤ 1,0 %
Freie Fettsäuren, ausgedrückt als Ölsäure: ≤ 0,5 %
Triacylglycerid-Profil:
Triester (kurz/lang von 0,5 bis 2,0): ≥ 90 %
Triester (kurz/lang = 0): ≤ 10 %
Unverseifbare Bestandteile: ≤ 1,0 %
Feuchtigkeit: ≤ 0,3 %
Asche: ≤ 0,1 %
Farbe: ≤ 3,5 Rot (nach Lovibond- Farbmessung)
Peroxidzahl (PV): ≤ 2,0 meq/kg |
| DHA- und EPA-reiches Öl ausSchizochytrium sp. |
Säurezahl: ≤ 0,5 mg KOH/g
Peroxidzahl (PV): ≤ 5,0 meq/kg Öl
Oxidative Stabilität: Für alle Lebensmittelerzeugnisse, die DHA- und EPA-reiches Öl ausSchizochytrium sp. enthalten, sollte anhand geeigneter und anerkannter nationaler/internationaler Testmethoden (z.B. AOAC) die oxidative Stabilität nachgewiesen werden.
Feuchtigkeit und flüchtige Stoffe: ≤ 0,05 %
Unverseifbare Stoffe: ≤ 4,5 %
trans-Fettsäuren: ≤ 1 %
DHA-Gehalt: ≥ 22,5 %
EPA-Gehalt: ≥ 10 % |
| Schizochytrium sp. (ATCC PTA-9695)-Öl
Stand: VO (EU) 2019/387 |
Das neuartige Lebensmittel wird aus dem Stamm ATCC PTA-9695 der Mikroalge Schizochytrium sp. gewonnen
Peroxidzahl (PV): ≤ 5,0 meq/kg Öl
Unverseifbare Stoffe: ≤ 3,5 %
trans-Fettsäuren: ≤ 2,0 %
reie Fettsäuren: ≤ 0,4 %
Docosapentaensäure (DPA) n-6: ≤ 7,5 %
DHA-Gehalt: ≥ 35 % |
| Schizochytrium sp. (FCC-3204)-Öl
Stand: VO (EU) 2021/1326 |
Beschreibung/Definition:
Das neuartige Lebensmittel ist ein Öl aus dem Stamm FCC-3204 der Mikroalge Schizochytrium sp.
Zusammensetzung:
Säurezahl: ≤ 0,5 mg KOH/g
Peroxidzahl (PV): ≤ 5,0 meq/kg Öl
Feuchtigkeit und flüchtige Stoffe: ≤ 0,05 %
Unverseifbare Stoffe: ≤ 4,5 %
trans-Fettsäuren: ≤ 1,0 %
Docosahexaensäure (DHA): ≥ 32,0 %
p-Anisidinzahl: ≤ 10 |
| Schizochytrium sp. (WZU477)-Öl |
Beschreibung/Definition:
Das neuartige Lebensmittel ist ein Öl aus dem Stamm WZU477 der Mikroalge Schizochytrium sp.
Zusammensetzung:
Säurezahl: ≤ 0,5 mg KOH/g
Peroxidzahl (PV): ≤ 5,0 meq/kg Öl
Feuchtigkeit und flüchtige Stoffe: ≤ 0,05 %
Unverseifbare Stoffe: ≤ 4,5 %
trans-Fettsäuren: ≤ 1,0 %
Docosahexaensäure (DHA): ≥ 32,0 %
p-Anisidinzahl: ≤ 10 |
| Schizochytrium sp.-Öl |
Säurezahl: ≤ 0,5 mg KOH/g
Peroxidzahl (PV): ≤ 5,0 meq/kg Öl
Feuchtigkeit und flüchtige Stoffe: ≤ 0,05 %
Unverseifbare Stoffe: ≤ 4,5 %
trans-Fettsäuren: ≤1,0 %
DHA-Gehalt: ≥ 32,0 % |
| Schizochytrium sp. (T18)-Öl
Stand: VO (EU) 2020/478 |
Säurezahl: ≤ 0,8 mg KOH/g
Peroxidzahl (PV): ≤ 5,0 meq/kg Öl
Feuchtigkeit und flüchtige Stoffe: ≤ 0,05 %
Unverseifbare Stoffe: ≤ 3,5 %
trans-Fettsäuren: ≤ 2,0 %
Freie Fettsäuren: ≤ 0,4 %
DHA-Gehalt: ≥ 35 % |
3"-Sialyllactose (3"-SL) -Natriumsalz
(mikrobiell)
Stand: VO (EU) 2021/96 |
Beschreibung:
3"-Sialyllactose (3"-SL) -Natriumsalz ist ein gereinigtes weißes bis cremefarbenes Pulver oder Agglomerat, das durch einen mikrobiellen Prozess gewonnen wird und begrenzte Mengen an Lactose, 3"-Sialyllactose und Sialinsäure enthält.
Quelle: Genetisch veränderter Escherichiacoli-Stamm K-12 DH1
Definition:
Chemische Formel: C23H38NO19Na
Chemische Bezeichnung: N-Acetyl-α-D-neuraminyl-(2→ 3)β-D-galactopyranosyl-(1→ 4)-D-glucose, Natriumsalz
Molmasse: 655,53 Da
CAS-Nr. 128596-80-5
Merkmale/Zusammensetzung:
Aussehen: weißes bis cremefarbenes Pulver oder Agglomerat
Summe aus 3"-Sialyllactose-Natriumsalz, D-Lactose und Sialinsäure (in % der Trockenmasse): ≥ 90,0 Gew.-%
3"-Sialyllactose-Natriumsalz (in % der Trockenmasse): ≥ 88,0 Gew.-%
D-Lactose: ≤ 5,0 Gew.-%
Sialinsäure: ≤ 1,5 Gew.-%
3"-Sialyllactose: ≤ 5,0 Gew.-%
Summe anderer Kohlenhydrate: ≤ 3,0 Gew.-%
Feuchtigkeit: ≤ 8,0 Gew.-%
Natrium: 2,5-4,5 Gew.-%
Chlorid: ≤ 1,0 Gew.-%
pH (20 °C, 5%ige Lösung): 4,5-6,0
Restproteingehalt: ≤ 0,01 Gew.-%
Mikrobiologische Kriterien:
Aerobe mesophile Gesamtkeimzahl: ≤ 1000 KBE/g
Enterobacteriaceae: ≤ 10 KBE/g
Salmonella sp.: in 25 g nicht nachweisbar
Hefen: ≤ 100 KBE/g
Schimmelpilze: ≤ 100 KBE/g
Restgehalt an Endotoxinen: ≤ 10 EU/mg
KBE: koloniebildende Einheiten; EU: Endotoxineinheiten (Endotoxin Units) |
3"-Sialyllactose-Natriumsalz ("3"-SL")
(erzeugt durch abgeleitete Stämme von E. coli BL21(DE3))
Stand: VO (EU) 2023/113 |
Beschreibung:
3"-Sialyllactose-Natriumsalz (3"-SL) ist ein gereinigtes weißes bis cremefarbenes Pulver oder Agglomerat, das durch einen mikrobiellen Prozess gewonnen wird und begrenzte Mengen an Lactose, 3"-Sialyllactose und Sialinsäure enthalt.
Definition:
Chemische Bezeichnung: N-Acetyl-α-D-neuraminyl-(2 2-3)-β-D-galactopyranosyl-(1 1-4)-D-glucose, Natriumsalz
Chemische Formel: C23H38NO19Na
Molmasse: 655,53 Da
CAS-Nr.: 128596-80-5
Quelle: Zwei genetisch veränderte Stämme (ein Produktionsstamm und ein fakultativer Abbaustamm) von Escherichia coli BL21(DE3)
Merkmale/Zusammensetzung:
3"-Sialyllactose-Natriumsalz (in % der Trockenmasse): ≥ 88,0 Gew.-%
3"-Sialyllactulose (in % der Trockenmasse): ≤ 5,0 Gew.-%
D-Lactose (in % der Trockenmasse): ≤ 5,0 Gew.-%
Sialinsäure (% der Trockenmasse): ≤ 1,5 Gew.-%
N-Acetyl-D-glucosamin (in % der Trockenmasse): ≤ 1,0 Gew.-%
Summe anderer Kohlenhydrate (in % der Trockenmasse): ≤ 5,0 Gew.-%
Feuchtigkeit: ≤ 9,0 Gew.-%
Asche: ≤ 8,5 Gew.-%
Restproteingehalt: ≤ 0,01 Gew.-%
Natrium: ≤ 4,2 Gew.-%
Mikrobiologische Kriterien:
Standardkeimzahl ≤ 1.000 *KBE/g
Enterobacteriaceae: ≤ 10 KBE/g
Salmonella spp.: in 25 g nicht nachweisbar
Hefen und Schimmelpilze: ≤ 100 KBE/g
Cronobacter (Enterobacter) sakazakii: in 10 g nicht nachweisbar
Restgehalt an Endotoxinen: ≤ 10 **EU/mg
______
a) Summe anderer Kohlenhydrate = 100 (Gew.-% der Trockenmasse) - 3"-Sialyllactose-Natriumsalz (Gew.-% der Trockenmasse) - quantifizierte Kohlenhydrate (Gew.-% der Trockenmasse) - Asche (Gew.-%) der Trockenmasse;
*) KBE: koloniebildende Einheiten;
**) EU: Endotoxineinheiten (Endotoxin Units). |
6"-Sialyllactose ("6"-SL") -Natriumsalz
(mikrobiell)
Stand: VO (EU) 2021/82 |
Beschreibung:
6"-Sialyllactose (6"-SL) -Natriumsalz ist ein gereinigtes weißes bis cremefarbenes Pulver oder Agglomerat, das durch einen mikrobiellen Prozess gewonnen wird und begrenzte Mengen an Lactose, 6"-Sialyllactose und Sialinsäure enthält.
Quelle: Genetisch veränderter Escherichiacoli-Stamm K-12 DH1
Definition:
Chemische Formel: C23H38NO19Na
Chemische Bezeichnung: N-Acetyl-α-D-neuraminyl-( 2→ 6)β-D-galactopyranosyl-( 1→ 4)-D-glucose, Natriumsalz
Molmasse: 655,53 Da
CAS-Nr. 157574-76-0
Merkmale/Zusammensetzung:
Aussehen: weißes bis cremefarbenes Pulver oder Agglomerat
Summe aus 6"-Sialyllactose-Natriumsalz, D-Lactose und Sialinsäure (in % der Trockenmasse): ≥ 94,0 Gew.-%
6"-Sialyllactose-Natriumsalz (in % der Trockenmasse): ≥ 90,0 Gew.-%
D-Lactose: ≤ 5,0 Gew.-%
Sialinsäure: ≤ 2,0 Gew.-%
6"-Sialyllactulose: ≤ 3,0 Gew.-%
Summe anderer Kohlenhydrate: ≤ 3,0 Gew.-%
Feuchtigkeit: ≤ 6,0 Gew.-%
Natrium: 2,5-4,5 Gew.-%
Chlorid: ≤ 1,0 Gew.-%
pH (20 °C, 5%ige Lösung): 4,5-6,0
Restproteingehalt: ≤ 0,01 Gew.-%
Mikrobiologische Kriterien:
Aerobe mesophile Gesamtkeimzahl: ≤ 1.000 KBE/g
Enterobacteriaceae: ≤ 10 KBE/g
Salmonella sp.: in 25 g nicht nachweisbar
Hefen: ≤ 100 KBE/g
Schimmelpilze: ≤ 100 KBE/g
Restgehalt an Endotoxinen: ≤ 10 EU/mg
KBE: koloniebildende Einheiten; EU: Endotoxineinheiten (Endotoxin Units) |
| Zugelassenes neuartiges Lebensmittel |
Spezifikation |
| Getrocknete Larven von Tenebrio molitor (Mehlkäfer)
Stand: VO (EU) 2021/882 |
Beschreibung/Definition:
Bei dem neuartigen Lebensmittel handelt es sich um den ganzen, thermisch getrockneten Mehlwurm, entweder ganz (blanchierte, ofengetrocknete Larven) oder in Form eines Pulvers (blanchierte, ofengetrocknete, gemahlene Larven). Der Begriff "Mehlwurm" bezieht sich auf die Larvenform von Tenebrio molitor, einer Insektenart, die zur Familie der Tenebrionidae (Schwarz- oder Dunkelkäfer) gehört.
Die ganzen Mehlwürmer sind für den menschlichen Verzehr bestimmt und es werden keine Teile entfernt.
Vor der thermischen Trocknung ist eine Futterkarenz von mindestens 24 Stunden erforderlich, damit sich die Larven ihres Darminhalts entledigen können.
Merkmale/Zusammensetzung:
Asche (% Massenanteil): 3,5-4,5
Feuchtigkeitsgehalt (% Massenanteil): 1-8
Rohprotein (N x 6,25) (% Massenanteil): 56-61
Verdauliche Kohlenhydrate * (% Massenanteil): 1-6
Fett (% Massenanteil): 25-30
davon gesättigt (% Massenanteil): 4-9
Peroxidzahl (Meq O2/kg Fett): ≤ 5
Ballaststoffe (% Massenanteil): 4-7
Chitin (% Massenanteil): 4-7
Schwermetalle:
Blei: ≤ 0,075 mg/kg
Cadmium: ≤ 0,1 mg/kg
Mykotoxine:
Aflatoxine (Summe aus B1, B2, G1, G2): ≤ 4 μg/kg
Aflatoxin B1: ≤ 2 μg/kg
Desoxynivalenol: ≤ 200 μg/kg
Ochratoxin A: ≤ 1 μg/kg
Mikrobiologische Kriterien:
Aerobe mesophile Gesamtkeimzahl: ≤ 105 KBE **/g
Hefen und Schimmelpilze: ≤ 100 KBE/g
Escherichia coli: ≤ 50 KBE/g
Salmonella spp.: In 25 g nicht nachweisbar
Listeria monocytogenes: In 25 g nicht nachweisbar
Sulfitreduzierende Anaerobier: ≤ 30 KBE/g
Bacillus cereus (präsumtiv): ≤ 100 KBE/g
Enterobacteriaceae (präsumtiv): < 10 KBE/g
Koagulasepositive Staphylokokken: ≤ 100 KBE/g
_____
*) Verdauliche Kohlenhydrate = 100 - (Rohprotein + Fett + Ballaststoffe + Asche + Feuchtigkeit).
**) KBE: koloniebildende Einheiten |
| Tetrahydrocurcuminoide
Stand: VO (EU) 2022/961 |
Beschreibung:
Die Tetrahydrocurcuminoide werden durch eine Abfolge von Schritten gewonnen, nämlich Extraktion von Curcuminoiden aus den getrockneten, pulverisierten Rhizomen von Gelbwurz ( Curcuma longa L.), Hydrierung (unter Verwendung von Palladium auf Aktivkohle (Pd/C) als Katalysator), Konzentration, Kristallisation, Trocknen und Vermahlen zu einem Pulver.
Merkmale/Zusammensetzung:
Tetrahydrocurcuminoide insgesamt (% w/w Trockengewicht) > 95,0
Feuchtigkeitsgehalt (% w/w): ≤ 1,0
Asche (% w/w): ≤ 1,0
Palladium (mg/kg): < 5,0
Mikrobiologische Kriterien:
Gesamtzahl der aeroben Bakterien: ≤ 5.000 KBE/g
Gesamtzahl Hefen/Schimmelpilze: ≤ 100 KBE/g
Escherichia coli: < 10 KBE/g
Staphylococcus aureus: ≤ 10 KBE/g
Enterobacteriaceae: ≤ 10 KBE/g
Salmonella spp.: in 25 g nicht nachweisbar
Coliforme: ≤ 10 KBE/g
KBE: koloniebildende Einheiten |
| Getrocknete Mikroalgen der ArtTetraselmis chuii |
Beschreibung/Definition:
Das gefriergetrocknete Produkt stammt von der marinen MikroalgeTetraselmis chuii, die zu der Familie der Chlorodendraceae gehört und in sterilem Meerwasser von der Außenluft isoliert in geschlossenen Photobioreaktoren kultiviert wird.
Reinheit/Zusammensetzung:
Identifiziert anhand des molekularen Markers 18 S rDNa (analysierte Sequenz mindestens 1.600 basenpaare) in der Datenbank des National center for Biotechnology information (NCBI): mindestens 99,9 %
Feuchtigkeit: ≤7,0 %
Proteine: 35-40 %
Asche: 14-16 %
Kohlenhydrate: 30-32 %
Ballaststoffe: 2-3 %
Fett: 5-8 %
Gesättigte Fettsäuren: 29-31 % der Fettsäuren insgesamt
Einfach ungesättigte Fettsäuren: 21-24 % der Fettsäuren insgesamt
Mehrfach ungesättigte Fettsäuren: 44-49 % der Fettsäuren insgesamt
Iod: ≤15 mg/kg |
| Therapon barcoo/Omega-Barsch |
Beschreibung/Definition:
Der Omega-Barsch (Therapon barcoo) ist eine Fischart aus der Familie der Terapontidae. Es ist ein Süßwasserfisch mit der Heimat Australien, der inzwischen in Aquakultur gezüchtet wird.
Taxonomische Systematik: Klasse: Actinopterygii > Ordnung: Perciformes > Familie: Terapontidae > Gattung: Therapon oder Scortum barcoo
Beschaffenheit des Fleisches:
Protein (%): 18-25
Feuchtigkeit (%): 65-75
Asche (%): 0,5-2,0
Energie (KJ/kg): 6.000-11.500
Kohlenhydrate (%): 0,0
Fett (%): 5-15
Fettsäuren (mg FA/g Filet):
Σ PUFa n-3: 1,2-20,0
Σ PUFa n-6: 0,3-2,0
PUFa n-3/n-6: 1.5-15.0
Omega-3-Säuren insgesamt: 1,6-40,0
Omega-6-Säuren insgesamt: 2,6-10,0 |
| D-Tagatose |
Beschreibung/Definition:
Tagatose wird durch Isomerisierung von Galactose mithilfe chemischer oder enzymatischer Umsetzung oder durch Epimerisierung von Fructose mithilfe enzymatischer Umsetzung gewonnen. Dies sind Einphasen-Umsetzungen.
Aussehen: weiße oder fast weiße Kristalle
Chemische Bezeichnung: D-Tagatose
Synonym: D-lyxo-Hexulose
CAS-Nummer: 87-81-0
Chemische Formel: C6H12O6
Formelgewicht: 180,16 (g/mol)
Reinheit:
Gehalt: ≥ 98 % bezogen auf die Trockenmasse
Trocknungsverlust: ≤ 0,5 % (102 °C, 2 h) Spezifische Drehung: [α]D20: - 4 bis - 5,6° (1 % wässrige Lösung) 1
Schmelzbereich: 133-137 °C
Schwermetalle:
Blei: ≤ 1,0 mg/kg*
___
*) Bestimmung mithilfe eines für den spezifizierten Reinheitsgrad geeigneten Atomabsorptionsverfahrens. Probengröße und Probenvorbereitung können sich an den Grundsätzen des in FNP 5 unter "Instrumental methods" 1 beschriebenen Verfahrens orientieren.
1) Food and nutrition paper 5 Rev 2 - Guide to specifications for general notices, general analytical techniques, identification tests, test solutions and other reference materials. (JECFA) 1991, 307 S.; Englisch - ISBN 92-5-102991-1 |
| Stark taxifolinhaltiger Extrakt
Stand: VO (EU) 2020/1559 |
Beschreibung:
Stark taxifolinhaltiger Extrakt aus dem Holz der Dahurischen Lärche (Larix gmelinii (Rupr.) Rupr) ist ein weißes bis blassgelbes Pulver, das aus warmen wässrigen Lösungen auskristallisiert wird.
Definition:
Chemische Bezeichnung: [(2R,3R)-2-(3,4-Dihydroxyphenyl)-3,5,7-trihydroxy-2,3-dihydrochromen-4-on, auch (+) trans (2R,3R)-Dihydroquercetin] und mit höchstens 2 % der cis-Form
Spezifikationen:
Physikalischer Parameter
Feuchtigkeit: ≤ 10 %
Analyse der Bestandteile
Taxifolin (m/m): ≥ 90,0 % der Trockenmasse
Schwermetalle, Pestizide
Blei: ≤ 0,5 mg/kg
Arsen: ≤ 0,02 mg/kg
Cadmium: ≤ 0,5 mg/kg
Quecksilber: ≤ 0,1 mg/kg
Dichlordiphenyltrichlorethan (DDT): ≤ 0,05 mg/kg
Lösungsmittelreste
Ethanol: < 5.000 mg/kg
Mikrobiologische Kriterien
Gesamtkeimzahl: ≤ 104 KBE/g
Enterobakterien: ≤ 100/g
Hefen und Schimmelpilze: ≤ 100 KBE/g
Escherichia coli: in 1 g nicht nachweisbar
Salmonellen: in 10 g nicht nachweisbar
Staphylococcus aureus: in 1 g nicht nachweisbar
Pseudomonas: in 1 g nicht nachweisbar
Üblicher Anteil der Bestandteile in stark taxifolinhaltigem Extrakt (bezogen auf die Trockenmasse) |
| Bestandteile des Extrakts |
Anteil, üblicherweise festgestellte Spanne (in %) |
| Taxifolin |
90-93 |
| Aromadendrin |
2,5-3,5 |
| Eriodictyol |
0,1-0,3 |
| Quercetin |
0,3-0,5 |
| Naringenin |
0,2-0,3 |
| Kaempferol |
0,01-0,1 |
| Pinocembrin |
0,05-0,12 |
| Unbekannte Flavonoide 1-3 |
1 - 3 |
| Wasser* |
1,5 |
___
*) Taxifolin ist in seiner hydrierten Form und während des Trocknens ein Kristall. Dies führt zu einem Anteil von Kristallwasser in Höhe von 1,5 %. |
| Trehalose |
Beschreibung/Definition:
Ein nichtreduzierendes Disaccharid, bestehend aus zwei durch eine α-1,1-Glucosidbindung verknüpften Glucoseanteilen. Es wird durch einen aus mehreren Schritten bestehenden enzymtechnischen Prozess aus verflüssigter Stärke oder aus Sucrose hergestellt. Das Handelsprodukt ist Dihydrat. Praktisch geruchlose, weiße oder fast weiße Kristalle mit süßem Geschmack
Synonyme: α,α-Trehalose
Chemische Bezeichnung: α-D-Glucopyranosyl-α-D-glucopyranosid, Dihydrat
CAS-Nr.: 6138-23-4 (Dihydrat)
Chemische Formel: C12H22O11 · 2H2O (Dihydrat)
Formelgewicht: 378,33 (Dihydrat)
Gehalt: ≥ 98 % auf trockener Grundlage
Bestimmung mithilfe eines für den spezifizierten Reinheitsgrad geeigneten Atomabsorptionsverfahrens. Probengröße und Probenvorbereitung können sich an den Grundsätzen des in FNP 5 (1) unter "Instrumental methods" beschriebenen Verfahrens orientieren.
Verfahren zur Gehaltsbestimmung:
Trehalose wird durch Flüssigchromatografie ermittelt und durch Vergleich mit einer Standard-Bezugstrehalose quantifiziert.
Zubereitung einer Probelösung: Sorgfältig etwa 3 g der Trockenprobe abwiegen und in einen 100-ml-Messkolben geben und etwa 80 ml gereinigtes deionisiertes Wasser hinzufügen. Probe vollständig auflösen und mit gereinigtem deionisiertem Wasser bis zur Markierung verdünnen. Durch einen 0,45-Mikron-Filter filtrieren.
Zubereitung einer Standardlösung: Sorgfältig abgewogene Mengen trockener Standard-Bezugstrehalose in Wasser auflösen, um eine Lösung mit einer bekannten Konzentration von etwa 30 mg Trehalose pro ml zu erhalten.
Geräte: Flüssigchromatograf, ausgerüstet mit einem Refraktionsindexdetektor und einem Gerät für eine Gesamtaufzeichnung.
Bedingungen:
Säule: Shodex Ionpack KS-801 (Showa Denko Co.) oder gleichwertig
- Länge: 300 mm
- Durchmesser: 10 mm
- Durchmesser: 50 °C
Mobile Phase: Wasser
Durchsatz: 0,4 ml/min
Injektionsvolumen: 8 µl
Verfahren: Getrennte Injektion gleicher Volumen der Probelösung und der Standardlösung in den Chromatografen.
Aufzeichnung der Chromatogramme und Messung der Reaktion des Trehalose-Peaks.
Berechnung der Trehalosemenge in mg in 1 ml der Probelösung durch folgende Formel:
% trehalose = 100 × (RU/RS) (WS/WU) dabei ist
RS = Peak-Bereich der Trehalose im Standardpräparat
RU = Peak-Bereich der Trehalose im Probepräparat
WS = Gewicht der Trehalose in mg im Standardpräparat
WU = Gewicht der Trockenprobe in mg
Merkmale:
Eigenschaften:
Löslichkeit: frei löslich in Wasser, sehr schwach löslich in Ethanol
Spezifische Drehung: [α]D20 = +179° (5 % wässrige Lösung, Dihydrat), +199° (5 % wässrige Lösung, wasserfreie Substanz) Schmelzpunkt: 97 °C (Dihydrat)
Reinheit:
Trocknungsverlust: ≤ 1,5 % (60 °C, 5h)
Gesamtasche: ≤ 0,05 %
Schwermetalle:
Blei: ≤ 1,0 mg/kg |
| UV-behandelte Pilze (Agaricus bisporus)
Stand: VO (EU) 2020/1559 |
Beschreibung/Definition
Kommerziell angebauteAgaricus bisporus, die nach der Ernte mit UV-Licht behandelt werden.
UV-Bestrahlung: Bestrahlung mit ultraviolettem Licht innerhalb des Wellenlängebereichs von 200-800 nm.
Vitamin D2
Chemische Bezeichnung: (3β,5Z,7E,22E)-9,10-Secoergosta-5,7,10(19),22-tetraen-3-ol
Synonym: Ergocalciferol
CAS-Nr.: 50-14-6
Molmasse: 396,65 g/mol
Gehalt
Vitamin D2 im Enderzeugnis: 5-20 µg/100 g Frischgewicht bei Ablauf der Haltbarkeitsdauer |
| UV-behandelte Bäckerhefe (Saccharomyces cerevisiae)
Stand: VO"en (EU) 2022/196; 2020/1559 |
Beschreibung/Definition
Bäckerhefe (Saccharomyces cerevisiae) wird mit UV-Licht behandelt, damit Ergosterol in Vitamin D2 (Ergocalciferol) umgewandelt wird. Der Vitamin-D2-Gehalt im Hefekonzentrat liegt zwischen 800.000 und 3.500.000 IE Vitamin D/100 g (200-875 μg/g).
Die Hefe ist zur Verwendung in Säuglingsanfangsnahrung und Folgenahrung, Getreidebeikost und Lebensmitteln für besondere medizinische Zwecke im Sinne der Verordnung (EU) Nr. 609/2013 zu inaktivieren, während die Hefe zur Verwendung in anderen Lebensmitteln inaktiviert werden kann oder auch nicht.
Das Hefekonzentrat wird mit normaler Bäckerhefe gemischt, damit der Höchstgehalt in vorverpackter frischer oder getrockneter Hefe für das Backen zu Hause nicht überschritten wird.
Gelbbraune, rieselfähige Körner
Vitamin D2
Chemische Bezeichnung: (5Z,7E,22E)-(3S)-9,10-Secoergosta-5,7,10(19),22-tetraen-3-ol
Synonyme: Ergocalciferol
CAS-Nr.: 50-14-6
Molmasse: 396,65 g/mol
Mikrobiologische Kriterien für das Hefekonzentrat:
Coliforme: ≤ 103/g
Escherichia coli: ≤ 10/g
Salmonellen: in 25 g nicht nachweisbar |
| UV-behandeltes Brot |
Beschreibung/Definition:
Der Ausdruck "UV-behandeltes Brot" bezeichnet Hefe-getriebenes Brot und Hefe-getriebenes Kleingebäck (ohne Auflage), die nach dem Backen mit ultravioletten Strahlen behandelt werden, um Ergosterol in Vitamin D2 (Ergocalciferol) umzuwandeln.
UV-Strahlung: ein Verfahren der Bestrahlung mit ultraviolettem Licht innerhalb des Wellenlängebereichs von 240-315 nm während maximal 5 Sekunden mit einer Strahlungsenergie von 10-50 mJ/cm2.
Vitamin D2:
Chemische Bezeichnung: (5Z,7E,22E)-3S-9,10-Secoergosta-5,7,10(19),22-tetraen-3-ol
Synonym: Ergocalciferol
CAS-Nr.: 50-14-6
Molmasse: 396,65 g/mol
Gehalt:
Vitamin D2 (Ergocalciferol) im Enderzeugnis: 0,75-3 µg/100 g1
Hefe im Teig: 1-5 g/100 g2
___
1) EN 12821, 2009, Europäische Norm.
2) Rezeptberechnung. |
| UV-behandelte Milch |
Beschreibung/Definition:
UV-behandelte Milch: Kuhmilch (Vollmilch und teilentrahmte Milch), die nach der Pasteurisierung einer Behandlung mit ultravioletter Strahlung (UV-Strahlung) durch Turbulenzströmung unterzogen wird. Die Behandlung der pasteurisierten Milch mit UV-Strahlen führt zu einer Erhöhung der Vitamin-D3-Konzentration (Cholecalciferol) durch die Umwandlung von 7-Dehydrocholesterol in Vitamin D3.
UV-Strahlung: ein Verfahren der Bestrahlung mit ultraviolettem Licht innerhalb des Wellenlängebereichs von 200-310 nm mit einer Strahlungsenergie von 1.045 J/l.
Vitamin D3:
Chemische Bezeichnung: (1S,3Z)-3-[(2E)-2-[(1R,3aS,7aR)-7a-Methyl-1-[(2R)-6-methylheptan-2-yl]-2,3,3a,5,6,7-hexahydro-1H-inden-4-ylidene]ethyliden]-4-methylidencyclohexan-1-ol
Synonym: Cholecalciferol
CAS-Nr.: 67-97-0
Molmasse: 384,6377 g/mol
Gehalt:
Vitamin-D3 im Enderzeugnis:
Vollmilch1: 0,5-3,2 µg/100 g 2
Teilentrahmte Milch(1): 0,1-1,5 µg/100 g2
___
1) Gemäß der Definition in der Verordnung (EU) Nr. 1308/2013 des Europäischen Parlaments und des Rates vom 17. Dezember 2013 über eine gemeinsame Marktorganisation für landwirtschaftliche Erzeugnisse und zur Aufhebung der Verordnungen (EWG) Nr 922/72, (EWG) Nr 234/79, (EG) Nr. 1037/2001 und (EG) Nr. 1234/2007 (ABl. Nr. L 347 vom 20.12.2013 S. 671).
2) HPLC |
| Vitamin D2-Pilzpulver
Stand: VO (EU) 2020/1163 |
Beschreibung/Definition
Vitamin D2-Pilzpulver ist ein körniges Pulver aus homogenisiertenAgaricus bisporus-Pilzen, die mit UV-Licht bestrahlt wurden.
Die Pilze werden gewaschen, homogenisiert und in Wasser suspendiert, um eine dünnflüssige Pilzmasse herzustellen. Die dünnflüssige Pilzmasse wird mit einer UV-Lampe bestrahlt. Anschließend wird die dünnflüssige Masse gefiltert, getrocknet und gemahlen, wodurch Vitamin D2-Pilzpulver entsteht.
UV-Bestrahlung: Bestrahlung mit ultraviolettem Licht innerhalb eines ähnlichen Wellenlängebereichs wie bei den nach der Verordnung über neuartige Lebensmittel zugelassenen UV-behandelten neuartigen Lebensmitteln.
Merkmale/Zusammensetzung
Vitamin D2-Gehalt: 1.000-1.300 μg/g Pilzpulver *
Feuchtigkeitsgehalt: ≤ 10,0 %
Asche: ≤ 13,5 %
Schwermetalle
Blei (als Pb): ≤ 0,5 mg/kg
Cadmium: ≤ 0,5 mg/kg
Quecksilber: ≤ 0,1 mg/kg
Arsen: ≤ 0,3 mg/kg
Mykotoxine
Aflatoxine (Summe aus B1 + B2 + G1 + G2): < 4 μg/kg
Mikrobiologische Kriterien
Gesamtkeimzahl: ≤ 5.000 KBE **/g
Hefen und Schimmelpilze: ≤ 100 KBE/g
Salmonella-Arten: In 25 g nicht nachweisbar
Staphylococcus aureus: ≤ 10 KBE/g
Escherichia coli: ≤ 10 KBE/g
Coliforme: ≤ 10 KBE/g
Enterobacteriaceae: ≤ 10 KBE/g
Listeria monocytogenes: In 25 g nicht nachweisbar
____
*) aus internationalen Einheiten (IE) umgerechnet, unter Verwendung des Umrechnungsfaktors 0,025 μg = 1 IE
**) KBE: koloniebildende Einheiten |
| Vitamin D2-Pilzpulver
Stand: VO (EU) 2021/2079 |
Beschreibung/Definition:
Bei dem neuartigen Lebensmittel handelt es sich um Pilzpulver, das aus ganzen getrockneten Pilzen von Agaricus bisporus hergestellt wird. Das Verfahren umfasst das Trocknen, Mahlen und die kontrollierte UV-Bestrahlung des Pilzpulvers.
UV-Bestrahlung: Bestrahlung mit ultraviolettem Licht innerhalb eines ähnlichen Wellenlängebereichs wie bei den nach der Verordnung (EU) 2015/2283 zugelassenen UV-behandelten neuartigen Lebensmitteln.
Merkmale/Zusammensetzung:
Vitamin D2-Gehalt: 580-595 μg/g Pilzpulver
Asche: ≤ 13,5 %
Wasseraktivität: < 0,5
Feuchtigkeitsgehalt: ≤ 7,5 %
Kohlenhydrate: ≤ 35,0 %
Ballaststoffe insgesamt: ≥ 15 %
Rohprotein (N × 6,25): ≥ 22 %
Fett: ≤ 4,5 %
Schwermetalle:
Blei: ≤ 0,5 mg/kg
Cadmium ≤ 0,5 mg/kg
Quecksilber: ≤ 0,1 mg/kg
Arsen: ≤ 0,3 mg/kg
Mykotoxine:
Aflatoxin B1: ≤ 0,10 μg/kg
Aflatoxine (Summe aus B1 + B2 + G1 + G2): < 4 μg/kg
Mikrobiologische Kriterien:
Gesamtkeimzahl: ≤ 5.000 KBE a
Hefen und Schimmelpilze insgesamt: < 100 KBE/g
E. coli: < 10 KBE/g
Salmonella spp.: in 25 g nicht nachweisbar
Staphylococcus aureus: ≤ 10 KBE/g
Coliforme: ≤ 10 KBE/g
Listeria spp.: in 25 g nicht nachweisbar
Enterobakterien: < 10 KBE/g
______
a) KBE: koloniebildende Einheiten. |
| Vitamin-D2-Pilzpulver
Stand: VO (EU) 2023/4 |
Beschreibung/Definition:
Das neuartige Lebensmittel wird erzeugt, indem in Scheiben/Würfel geschnittene Pilze der Art Agaricus bisporus kontrolliert mit UV-Licht bestrahlt und daraufhin dehydriert und zu einem Pulver zermahlen werden.
UV-Bestrahlung: Bestrahlung mit ultraviolettem Licht innerhalb eines ähnlichen Wellenlängebereichs wie bei den nach der Verordnung (EU) 2015/2283 zugelassenen UV-behandelten neuartigen Lebensmitteln.
Merkmale/Zusammensetzung:
Vitamin-D2-Gehalt: 125-375 μg/g
Feuchtigkeit: ≤ 7 %
Asche: ≤ 13,5 %
Wasseraktivität: < 0,5
Fett: ≤ 4,5 %
Gesamtkohlenhydrate: ≤ 60 %
Protein: ≤ 40 %
Schwermetalle:
Blei: ≤ 0,5 mg/kg
Cadmium: ≤ 0,5 mg/kg
Quecksilber: ≤ 0,1 mg/kg
Arsen: ≤ 0,3 mg/kg
Mykotoxine:
Aflatoxin B1: ≤ 2 μg/kg
Aflatoxine (Summe aus B1 + B2 + G1 + G2): < 4 μg/kg
Mikrobiologische Kriterien:
Gesamtzahl der aeroben Bakterien: ≤ 5.000 KBE/g
Hefen und Schimmelpilze insgesamt: < 100 KBE/g
Coliforme: < 100 MPN/g
Salmonella spp.: in 25 g nicht nachweisbar
Staphylococcus aureus: in 10 g nicht nachweisbar
Escherichia coli: in 10 g nicht nachweisbar
Listeria monocytogenes: in 25 g nicht nachweisbar
KBE: koloniebildende Einheiten. MPN: wahrscheinlichste Zahl. |
| Vitamin K2 (Menachinon) |
Dieses neuartige Lebensmittel wird durch einen synthetischen oder mikrobiologischen Prozess gewonnen.
Bei Vitamin K2 (2-Methyl-3-all-trans-polyprenyl-1,4-naphthochinon) bzw. der Menachinon-Reihe handelt es sich um eine Gruppe von prenylierten Naphthochinon-Derivaten. Die Zahl der Isoprenreste (eine Isopreneinheit hat fünf Kohlenstoffatome) in der Seitenkette dient zur Unterscheidung der verschiedenen Menachinon-Formen, die vor allem MK-7 und in geringerem Maße MK-6 enthalten.
Vitamin K2 (Menachinon)-Reihe mit Menachinon-7 (MK-7)(n = 6), d. h. C46H64O2, Menachinon-6 (MK-6)(n = 5), d. h. C41H56O2, und Menachinon-4 (MK-4)(n = 3), d. h. C31H40O2.
Chemische Bezeichnung: (all-E)-2-(3,7,11,15,19,23,27-Heptamethyl-2,6,10,14,18,22,26-octacosaheptaenyl)-3-methyl-1,4-naphtalindion
CAS-Nummer: 2124-57-4
Summenformel: C46H64O2
Molmasse: 649 g/mol
Spezifikation für synthetisches Vitamin K2 (Menachinon-7)
Aussehen: Gelbes Pulver
Reinheit: max. 6,0 %cis-Isomer, max. 2,0 % sonstige Verunreinigungen
Gehalt: 97-102 % Menachinon-7 (einschließlich mindestens 92 % all-trans Menachinon-7)
Spezifikation für mikrobiologisch hergestelltes Vitamin K2 (Menachinon-7)
Quelle:Bacillus subtilis spp. natto undBacillus licheniformis
Aussehen: Gelbes Pulver oder Ölsuspension |
| Extrakt aus Weizenkleie |
Beschreibung/Definition:
Weißes, kristallines Pulver, das durch Enzymextraktion aus Kleie vonTriticum aestivum L. gewonnen wird und reich an Arabinoxylanoligosacchariden ist.
Trockenmasse: mind. 94 %
Arabinoxylanoligosaccharide: mind. 70 %, bezogen auf die Trockenmasse
Durchschnittlicher Polymerisationsgrad der Arabinoxylanoligosaccharide: 3-8
Ferulasäure (an Arabinoxylanoligosaccharide gebunden): 1-3 %, bezogen auf die Trockenmasse
Gesamtanteil Poly-/Oligosaccharide: mind. 90 %
Protein: max. 2 % bezogen auf die Trockenmasse
Asche: max. 2 %, bezogen auf die Trockenmasse
Mikrobiologische Parameter:
Mesophile Gesamtkeimzahl: max. 10.000/g
Hefen: max. 100/g
Pilze: max. 100/g
Salmonellen: in 25 g nicht nachweisbar
Bacillus cereus: max. 1.000/g
Clostridium perfringens: max. 1.000/g |