 Für einen individuellen Ausdruck passen Sie bitte die
Für einen individuellen Ausdruck passen Sie bitte dieEinstellungen in der Druckvorschau Ihres Browsers an. Regelwerk, EU 2012, Lebensmittel - EU Bund

 Für einen individuellen Ausdruck passen Sie bitte die Für einen individuellen Ausdruck passen Sie bitte dieEinstellungen in der Druckvorschau Ihres Browsers an. Regelwerk, EU 2012, Lebensmittel - EU Bund |
 |
Verordnung (EU) Nr. 252/2012 der Kommission vom 21. März 2012 zur Festlegung der Probenahmeverfahren und Analysemethoden für die amtliche Kontrolle der Gehalte an Dioxinen, dioxinähnlichen PCB und nicht dioxinähnlichen PCB in bestimmten Lebensmitteln sowie zur Aufhebung der Verordnung (EG) Nr. 1883/2006
(Text von Bedeutung für den EWR)
(ABl. Nr. L 84 vom 23.03.2012 S. 1;
VO (EU) 589/2014 - ABl. Nr. L 164 vom 03.06.2014 S. 18 Inkrafttretenaufgehoben)
aufgehoben/ersetzt gem. Art. 5 der VO (EU) 589/2014
Neufassung -Ersetzt VO (EG) 1883/2006
Die Europäische Kommission -
gestützt auf den Vertrag über die Arbeitsweise der Europäischen Union,
gestützt auf die Verordnung (EG) Nr. 882/2004 des Europäischen Parlaments und des Rates vom 29. April 2004 über amtliche Kontrollen zur Überprüfung der Einhaltung des Lebensmittel- und Futtermittelrechts sowie der Bestimmungen über Tiergesundheit und Tierschutz 1, insbesondere auf Artikel 11 Absatz 4,
in Erwägung nachstehender Gründe:
(1) In der Verordnung (EG) Nr. 1881/2006 der Kommission vom 19. Dezember 2006 zur Festsetzung der Höchstgehalte für bestimmte Kontaminanten in Lebensmitteln 2 sind Höchstgehalte für nicht dioxinähnliche PCB, Dioxine und Furane sowie für die Summe der Dioxine, Furane und dioxinähnlichen PCB in bestimmten Lebensmitteln festgelegt.
(2) In der Empfehlung 2011/516/EU der Kommission vom 23. August 2011 zur Reduzierung des Anteils von Dioxinen, Furanen und PCB in Futtermitteln und Lebensmitteln 3 werden Auslösewerte vorgegeben, durch die ein proaktives Vorgehen zur Reduzierung des Vorhandenseins von polychlorierten Dibenzoparadioxinen und polychlorierten Dibenzofuranen (PCDD/F) sowie von dioxinähnlichen PCB in Lebensmitteln angeregt werden soll. Bei diesen Auslösewerten handelt es sich um ein Instrument für die zuständigen Behörden und Unternehmen, mit dem diejenigen Fälle ermittelt werden, in denen eine Kontaminationsquelle gefunden werden muss und Maßnahmen zu deren Eindämmung oder Beseitigung getroffen werden müssen.
(3) In der Verordnung (EG) Nr. 1883/2006 der Kommission vom 19. Dezember 2006 zur Festlegung der Probenahmeverfahren und Analysemethoden für die amtliche Kontrolle der Gehalte von Dioxinen und dioxinähnlichen PCB in bestimmten Lebensmitteln 4 sind spezifische Bestimmungen für das Probenahme- und Analyseverfahren für die amtliche Kontrolle festgelegt.
(4) Die Anwendung der neuen Höchstgehalte für nicht dioxinähnliche PCB, die infolge eines wissenschaftlichen Gutachtens der Europäischen Behörde für Lebensmittelsicherheit (EFSA) über nicht dioxinähnliche PCB und zur Harmonisierung auf Unionsebene festgelegt wurden, sowie die Aktualisierung der Kriterien für Screening-Verfahren machen grundlegende Änderungen erforderlich. Aus Gründen der Klarheit sollte daher die Verordnung (EG) Nr. 1883/2006 durch die vorliegende Verordnung ersetzt werden.
(5) Die Bestimmungen dieser Verordnung gelten nur für die Probenahme und Analyse von Dioxinen, dioxinähnlichen PCB und nicht dioxinähnlichen PCB zur Durchführung der Verordnung (EG) Nr. 1881/2006. Sie betreffen nicht das Probenahmeverfahren, den Umfang und die Häufigkeit der Proben gemäß den Anhängen III und IV der Richtlinie 96/23/EG des Rates vom 29. April 1996 über Kontrollmaßnahmen hinsichtlich bestimmter Stoffe und ihrer Rückstände in lebenden Tieren und tierischen Erzeugnissen und zur Aufhebung der Richtlinien 85/358/EWG und 86/469/EWG und der Entscheidungen 89/187/EWG und 91/664/EWG 5. Sie betreffen auch nicht die in der Entscheidung 98/179/EG der Kommission vom 23. Februar 1998 mit Durchführungsvorschriften für die amtlichen Probenahmen zur Kontrolle von lebenden Tieren und tierischen Erzeugnissen auf bestimmte Stoffe und ihre Rückstände 6 festgelegten Kriterien für die zielorientierte Probenahme.
(6) Zur Auswahl von Proben mit einem signifikanten Gehalt an PCDD/F und dioxinähnlichen PCB kann ein Screening- Verfahren mit allgemein akzeptabler Validierung und großem Durchsatz verwendet werden (dabei sollten vorzugsweise Proben mit Gehalten oberhalb der Auslösewerte, jedenfalls jedoch mit Gehalten oberhalb der Höchstgehalte ausgewählt werden). Die Gehalte an PCDD/F und dioxinähnlichen PCB in diesen Proben müssen durch ein Bestätigungsverfahren bestimmt werden. Daher sollten für Screening-Verfahren Anforderungen festgelegt werden, die geeignet sind, sicherzustellen, dass die Falsch-Negativ-Rate bezüglich der Höchstgehalte unter 5 % liegt, sowie strenge Anforderungen für die Bestätigungsverfahren. Des Weiteren ermöglichen Bestätigungsverfahren die Bestimmung von Gehalten auch im Bereich der niedrigen Hintergrundbelastung. Dies ist wichtig für die Verfolgung zeitlicher Entwicklungen, die Expositionsbewertung und die Neubewertung der Höchstgehalte und Auslösewerte.
(7) Für sehr große Fische muss ein spezifisches Probenahmeverfahren festgelegt werden, damit eine harmonisierte Vorgehensweise in der gesamten EU gewährleistet ist.
(8) Der Gehalt an Dioxinen, dioxinähnlichen PCB und nicht dioxinähnlichen PCB kann innerhalb derselben Art und derselben Region je nach Größe und/oder Alter des Fischs verschieden sein. Zudem ist der Gehalt an Dioxinen, dioxinähnlichen PCB und nicht dioxinähnlichen PCB nicht unbedingt in allen Teilen eines Fisches gleich. Daher müssen die Probenahme und -vorbereitung festgelegt sein, damit eine harmonisierte Vorgehensweise in der gesamten EU gewährleistet ist.
(9) Zur Gewährleistung einer harmonisierten Vorgehensweise bei der Durchsetzung in der gesamten EU ist es wichtig, dass Analyseergebnisse in einheitlicher Form mitgeteilt und ausgewertet werden.
(10) Die in dieser Verordnung vorgesehenen Maßnahmen entsprechen der Stellungnahme des Ständigen Ausschusses für die Lebensmittelkette und Tiergesundheit und weder das Europäische Parlament noch der Rat haben ihnen widersprochen
- hat folgende Verordnung erlassen:
Für die Zwecke dieser Verordnung gelten die Begriffsbestimmungen und Abkürzungen in Anhang I.
Die Probenahme für die amtliche Kontrolle der Gehalte an Dioxinen, Furanen, dioxinähnlichen PCB und nicht dioxinähnlichen PCB in Lebensmitteln, die in Abschnitt 5 des Anhangs der Verordnung (EG) Nr. 1881/2006 aufgeführt sind, erfolgt nach den in Anhang II dieser Verordnung beschriebenen Verfahren.
Die Vorbereitung und Analyse der Proben für die amtliche Kontrolle der Gehalte von Dioxinen, Furanen und dioxinähnlichen PCB in Lebensmitteln, die in Abschnitt 5 des Anhangs der Verordnung (EG) Nr. 1881/2006 aufgeführt sind, erfolgt nach den in Anhang III dieser Verordnung beschriebenen Verfahren.
Die Analyse für die amtliche Kontrolle der Gehalte an nicht dioxinähnlichen PCB in Lebensmitteln, die in Abschnitt 5 des Anhangs der Verordnung (EG) Nr. 1881/2006 aufgeführt sind, erfolgt gemäß den in Anhang IV dieser Verordnung beschriebenen Anforderungen an die Analyseverfahren.
Die Verordnung (EG) Nr. 1883/2006 wird aufgehoben.
Verweise auf die aufgehobene Verordnung gelten als Verweise auf diese Verordnung.
Diese Verordnung tritt am zwanzigsten Tag nach ihrer Veröffentlichung im Amtsblatt der Europäischen Union in Kraft.
Sie gilt ab dem Datum des Inkrafttretens.
Diese Verordnung ist in allen ihren Teilen verbindlich und gilt unmittelbar in jedem Mitgliedstaat.
Brüssel, den 21. März 2012
2) ABl. Nr. L 364 vom 20.12.2006 S. 5.
3) ABl. Nr. L 218 vom 24.08.2011 S. 23.
4) ABl. Nr. L 364 vom 20.12.2006 S. 32.
5) ABl. Nr. L 125 vom 23.05.1996 S. 10.
6) ABl. Nr. L 65 vom 05.03.1998 S. 31.
| Begriffsbestimmungen und Abkürzungen | Anhang I |
I. Begriffsbestimmungen
Für die Zwecke dieser Verordnung gelten die Begriffsbestimmungen in Anhang I der Entscheidung 2002/657/EG der Kommission vom 14. August 2002 zur Umsetzung der Richtlinie 96/23/EG des Rates betreffend die Durchführung von Analysemethoden und die Auswertung von Ergebnissen 1.
Drüber hinaus gelten für die Zwecke dieser Verordnung folgende Begriffsbestimmungen:
1.1. "Auslösewert": Der Gehalt an einem bestimmten Stoff gemäß dem Anhang der Empfehlung 2011/516/EU, ab dem Untersuchungen zur Bestimmung der Quelle der Kontamination eingeleitet werden müssen, wenn erhöhte Werte dieses Stoffes festgestellt werden.
1.2. "Bioanalytische Methoden": Verfahren, die auf der Anwendung biologischer Grundsätze beruhen, beispielsweise zellbasierte Assays, Rezeptor-Assays oder Immunoassays. Man erhält damit kein Ergebnis auf Ebene der Kongeneren, sondern lediglich einen Hinweis 2 auf den TEQ-Gehalt, ausgedrückt in bioanalytischen Äquivalenten (BEQ), wodurch der Tatsache Rechnung getragen wird, dass möglicherweise nicht alle ein Signal erzeugenden Verbindungen, die in einem Probenextrakt vorliegen, allen Vorraussetzungen des TEQ-Prinzips genügen.
1.3. "Beobachtete Bioassay-Wiederfindung": BEQ-Gehalt, berechnet anhand einer TCDD-Kalibrierkurve oder einer PCB- 126-Kalibrierkurve nach Korrektur um den Blindwert, geteilt durch den mittels GC/HRMS-Verfahren bestimmten TEQ-Wert. Dadurch sollen Faktoren wie der Verlust von PCDD/PCDF und dioxinähnlichen Verbindungen während der einzelnen Extraktions- bzw. Reinigungsschritte, die Verstärkung oder Abschwächung des Signals durch mitextrahierte Verbindungen (agonistische bzw. antagonistische Wirkung), die Qualität der Kurvenanpassung oder Unterschiede zwischen TEF- und REP-Werten möglichst korrigiert werden. Die beobachtete Bioassay-Wiederfindung wird anhand geeigneter Referenzproben berechnet, die im Bereich der interessierenden Konzentration liegen und repräsentative Kongeneren-Muster aufweisen.
1.4. "Semiquantitative Methoden": Verfahren, mit denen die ungefähre Konzentration eines vermuteten Analyten angegeben werden kann, bei denen aber das numerische Ergebnis den Anforderungen an quantitative Methoden nicht genügt.
1.5. "Akzeptierte spezifische Bestimmungsgrenze eines einzelnen Kongeners": die Konzentration eines Analyts in einem Probenextrakt, die ein Signal des Messgeräts bei zwei verschiedenen Ionen (Fragmentionen) hervorruft, die mit einem Signal-Rausch-Verhältnis von 3:1 bei dem weniger empfindlichen Signal verbunden sind; weiterhin müssen die Identifizierungskriterien, wie sie beispielsweise in der Norm prEN 16215 (Futtermittel - Bestimmung von Dioxinen und dioxinähnlichen PCB mittels GC/HRMS und von Indikator-PCB mittels GC/HRMS) und/oder in der EPA-Methode 1613 Revision B beschrieben sind, erfüllt sein.
1.6. "Obergrenze" ("upperbound"): Konzept, nach dem der Beitrag jedes nicht quantifizierten Kongeners der Bestimmungsgrenze gleichzusetzen ist.
1.7. "Untergrenze" ("lowerbound"): Konzept, nach dem der Beitrag jedes nicht quantifizierten Kongeners mit Null gleichzusetzen ist.
1.8. "Mittelwert" ("mediumbound"): Konzept, nach dem der Beitrag jedes nicht quantifizierten Kongeners mit der Hälfte der Bestimmungsgrenze gleichzusetzen ist.
1.9. "Partie": Unterscheidbare Menge eines in einer Sendung angelieferten Lebensmittels, das gemäß der amtlichen Prüfung einheitliche Merkmale wie Ursprung, Sorte, Art der Verpackung, Verpacker, Absender oder Kennzeichnung aufweist. Bei Fischen und Fischereierzeugnissen muss auch die Größe der Fische vergleichbar sein. Sind Größe und/oder Gewicht der Fische in einer Sendung nicht vergleichbar, gilt die Sendung zwar als Partie, aber es ist ein spezifisches Probenahmeverfahren anzuwenden.
1.10. "Teilpartie": Bestimmter Teil einer großen Partie, der dem Probenahmeverfahren zu unterziehen ist. Jede Teilpartie muss physisch getrennt und identifizierbar sein.
1.11. "Einzelprobe": An einer einzigen Stelle der Partie bzw. Teilpartie entnommene Menge.
1.12. "Sammelprobe": Summe der einer Partie oder Teilpartie entnommenen Einzelproben.
1.13. "Laborprobe": Für das Labor bestimmte(r) repräsentative(r) Teil/Menge der Sammelprobe.
II. Verwendete Abkürzungen
BEQ Bioanalytische ÄquivalenteGC Gaschromatografie
HRMS Hochauflösende Massenspektrometrie
LRMS Niedrigauflösende Massenspektrometrie
PCB Polychlorierte Biphenyle
PCDD Polychlorierte Dibenzo-pdioxine
PCDF Polychlorierte Dibenzofurane
QC Qualitätssicherung
REP Relative Wirksamkeit
TEF Toxizitätsäquivalenzfaktor
TEQ Toxizitätsäquivalente
TCDD Tetrachlordibenzodioxin
U Erweiterte Messunsicherheit
__________
1) ABl. Nr. L 221 vom 17.08.2002 S. 8.
2) Bioanalytische Methoden sind nicht spezifisch für diejenigen Kongenere, die in das TEF-Schema fallen. Im Probenextrakt können auch andere, strukturverwandte AhR-aktive Verbindungen vorliegen, die zur Gesamt-Zellantwort beitragen. Daher erlauben bioanalytische Ergebnisse keine Schätzung des TEQ-Gehalts, sondern stellen eher einen Hinweis auf den TEQ-Gehalt in einer Probe dar.
| Probenahmeverfahren für die amtliche Kontrolle des Gehalts an Dioxinen (PCDD/PCDF), dioxinähnlichen PCB und nicht dioxinähnlichen PCB in bestimmten Lebensmitteln | Anhang II |
I. Geltungsbereich
Proben für die amtliche Kontrolle des Gehalts an Dioxinen (PCDD/PCDF), dioxinähnlichen PCB und nicht dioxinähnlichen PCB, nachstehend "Dioxine und PCB" genannt, in Lebensmitteln werden nach den in diesem Anhang beschriebenen Verfahren genommen. Die mit diesem Verfahren gewonnenen Sammelproben sind als repräsentativ für die betreffenden Partien bzw. Teilpartien anzusehen. Anhand der in den Laborproben bestimmten Gehalte wird festgestellt, ob die in der Verordnung (EG) Nr. 1881/2006 zur Festsetzung der Höchstgehalte für bestimmte Kontaminanten in Lebensmitteln festgelegten Höchstgehalte eingehalten wurden.
II. Allgemeine Bestimmungen
1. Personal
Die Probenahme wird von einer durch den Mitgliedstaat bevollmächtigten Person vorgenommen.
2. Zu beprobendes Material
Jede zu kontrollierende Partie oder Teilpartie ist einzeln zu beproben.
3. Vorsichtsmaßnahmen
Bei der Probenahme und der Vorbereitung der Proben sind Vorsichtsmaßnahmen zu treffen, um Veränderungen zu verhindern, die sich auf den Gehalt an Dioxinen und PCB auswirken, die analytische Bestimmung beeinträchtigen oder die Repräsentativität der Sammelproben zunichte machen könnten.
4. Einzelproben
Einzelproben sind - soweit möglich - an verschiedenen, über die gesamte Partie oder Teilpartie verteilten Stellen zu entnehmen. Abweichungen von dieser Regel sind in dem unter Nummer II.8 dieses Anhangs genannten Protokoll festzuhalten.
5. Herstellung der Sammelprobe
Die Sammelprobe wird durch Vereinigung der Einzelproben hergestellt. Sie besteht aus mindestens 1 kg, außer wenn dies praktisch nicht möglich ist, z.B. wenn eine einzige Packung beprobt wurde oder das Erzeugnis einen sehr hohen Marktwert hat.
6. Parallelproben
Parallelproben für Vollzugs-, Handels- (Rechtfertigungs-) und Referenz- (Schieds) zwecke sind von der homogenisierten Sammelprobe zu nehmen, sofern dies nicht gegen die Vorschriften der Mitgliedstaaten über die Rechte des Lebensmittelunternehmers verstößt. Die Laborproben für die Überwachung müssen ausreichend groß sein, um zumindest eine zweite Analyse zu ermöglichen.
7. Verpackung und Versand der Proben
Jede Probe ist in einem sauberen, inerten Behältnis aufzubewahren, das angemessenen Schutz gegen Kontamination, Verlust von Analyten durch Adsorption an der inneren Wand des Behältnisses sowie gegen Beschädigung beim Transport bietet. Es sind alle notwendigen Vorkehrungen zu treffen, um zu verhindern, dass sich die Zusammensetzung der Probe während des Transports oder der Lagerung ändert.
8. Versiegelung und Kennzeichnung der Proben
Jede amtliche Probe wird am Ort der Entnahme versiegelt und gemäß den Vorschriften der Mitgliedstaaten gekennzeichnet.
Über jede Probenahme ist ein Protokoll zu führen, aus dem die Identität der Partie eindeutig hervorgeht, wobei Datum und Ort der Probenahme sowie alle zusätzlichen Informationen, die für die durchzuführende Analyse von Nutzen sein können, zu vermerken sind.
III. Probenahmeplan
Mit dem verwendeten Probenahmeverfahren muss gewährleistet sein, dass die Sammelprobe für die zu kontrollierende (Teil-) Partie repräsentativ ist.
1. Aufteilung von Partien in Teilpartien
Größere Partien werden in Teilpartien aufgeteilt, wenn dies physisch möglich ist. Für als Massengut gehandelte Erzeugnisse (z.B. Pflanzenöle) gilt Tabelle 1. Für andere Erzeugnisse gilt Tabelle 2. Da das Gewicht der Partie nicht immer ein exaktes Vielfaches des Gewichts der Teilpartien ist, darf das Gewicht der Teilpartien das genannte Gewicht um bis zu 20 % überschreiten.
Tabelle 1: Aufteilung von Partien in Teilpartien bei Massengütern
| Gewicht der Partie (t) | Gewicht oder Anzahl der Teil partien |
| ≥ 1500 | 500 t |
| > 300 und < 1500 | 3 Teilpartien |
| ≥ 50 und ≤ 300 | 100 t |
| < 50 | - |
Tabelle 2: Aufteilung von Partien in Teilpartien bei anderen Erzeugnissen
| Gewicht der Partie (t) | Gewicht oder Anzahl der Teil partien |
| ≥ 15 | 15-30 t |
| < 15 | - |
2. Anzahl der Einzelproben
Die Sammelprobe, in der alle Einzelproben vereinigt sind, muss mindestens 1 kg wiegen (siehe Nummer II.5 dieses Anhangs).
Die Mindestanzahl der einer Partie oder Teilpartie zu entnehmenden Einzelproben muss den Angaben in den Tabellen 3 und 4 entsprechen.
Bei flüssigen Massengütern ist die Partie oder Teilpartie unmittelbar vor der Probenahme manuell oder mechanisch möglichst gründlich zu vermischen, sofern dies die Qualität des Erzeugnisses nicht beeinträchtigt. In diesem Fall kann von einer homogenen Verteilung der Kontaminanten in der jeweiligen Partie oder Teilpartie ausgegangen werden. Daher reichen drei Einzelproben aus einer Partie oder Teilpartie für eine Sammelprobe aus.
Das Gewicht der Einzelproben muss annähernd gleich sein. Eine Einzelprobe muss mindestens 100 g wiegen.
Abweichungen von dieser Regel sind in dem unter Nummer II.8 dieses Anhangs genannten Protokoll festzuhalten. Entsprechend den Bestimmungen der Entscheidung 97/747/EG der Kommission vom 27. Oktober 1997 über Umfang und Häufigkeit der in der Richtlinie 96/23/EG des Rates vorgesehenen Probenahmen zum Zweck der Untersuchung in Bezug auf bestimmte Stoffe und ihre Rückstände in bestimmten tierischen Erzeugnissen 1 beträgt der Umfang einer Sammelprobe bei Hühnereiern mindestens 12 Eier (bei loser Ware ebenso wie bei Partien aus einzelnen Verpackungen; es gelten die Tabellen 3 und 4).
Tabelle 3: Mindestzahl der Einzelproben, die der Partie oder Teilpartie zu entnehmen sind
| Gewicht oder Volumen der Partie/Teilpartie (kg oder l) |
Mindestanzahl der zu entnehmenden Einzelproben |
| < 50 | 3 |
| 50-500 | 5 |
| > 500 | 10 |
Besteht die Partie oder Teilpartie aus einzelnen Packungen oder Einheiten, ist die Zahl der Packungen oder Einheiten, die die Sammelprobe bildet, gemäß Tabelle 4 zu wählen.
Tabelle 4: Zahl der Packungen oder Einheiten (Einzelproben), die die Sammelprobe bilden, wenn die Partie oder Teilpartie aus einzelnen Packungen oder Einheiten besteht
| Zahl der Packungen oder Einheiten in der Partie/Teilpartie | Zahl der zu entnehmenden Packungen oder Einheiten |
| 1-25 | mindestens 1 Packung oder Einheit |
| 26-100 | etwa 5 %, mindestens 2 Packungen oder Einheiten |
| > 100 | etwa 5 %, höchstens 10 Packungen oder Einheiten |
3. Spezifische Bestimmungen für die Probenahme von Partien ganzer Fische mit vergleichbarer Größe und vergleichbarem Gewicht
Fische gelten als vergleichbar groß und schwer, wenn die entsprechenden Werte nicht um mehr als 50 % voneinander abweichen.
Die Anzahl der einer Partie zu entnehmenden Einzelproben muss den Angaben in Tabelle 3 entsprechen. Die Sammelprobe, in der alle Einzelproben vereinigt sind, muss mindestens 1 kg wiegen (siehe Nummer II.5).
Der mittlere Teil befindet sich im Schwerpunkt der Fische, in der Regel im Bereich der Rückenflosse (sofern vorhanden) oder in der Mitte zwischen Kiemenöffnung und Darmausgang.
Bei Fischen mittlerer Größe (ungefähr 1-6 kg) wird die Einzelprobe vom Mittelteil als Scheibe im Querschnitt entnommen.
Bei sehr großen Fischen (> ungefähr 6 kg) wird die Einzelprobe im Mittelteil rechtsseitig (von vorne gesehen) aus dem Muskelfleisch der Rückenpartie entnommen. Würde die Entnahme eines Stückes aus dem mittleren Teil des Fisches einen beträchtlichen wirtschaftlichen Schaden nach sich ziehen, kann die Entnahme von drei Einzelproben von jeweils mindestens 350 g als ausreichend angesehen werden, unabhängig von der Größe der Partie. Alternativ dazu kann für die Einzelprobe, die für den Dioxingehalt in dem Fisch insgesamt repräsentativ ist, auch ein gleich großer Teil aus Muskelfleisch im Schwanz- oder Kopfbereich entnommen werden.
4. Probenahme von Partien ganzer Fische mit unterschiedlicher Größe und/oder von unterschiedlichem Gewicht
5. Probenahme im Einzelhandel
Die Probenahme von Lebensmitteln im Einzelhandel muss, soweit möglich, gemäß den unter Nummer III.2 dieses Anhangs beschriebenen Probenahmebestimmungen durchgeführt werden.
Ist dies nicht möglich, können im Einzelhandel andere geeignete Probenahmeverfahren angewandt werden, vorausgesetzt, dass die nach diesen Verfahren genommenen Sammelproben ausreichend repräsentativ für die beprobten Partien oder Teilpartien sind.
IV. Übereinstimmung der Partie bzw. Teilpartie mit den Vorgaben
1. Nicht dioxinähnliche PCB
Die Partie wird akzeptiert, wenn das Ergebnis der Untersuchung den in der Verordnung (EG) Nr. 1881/2006 für nicht dioxinähnliche PCB festgelegten Höchstgehalt unter Berücksichtigung der Messunsicherheit nicht überschreitet.
Die Partie entspricht nicht dem in der Verordnung (EG) Nr. 1881/2006 festgelegten Höchstgehalt, wenn die Obergrenze ("upperbound") des Untersuchungsergebnisses, bestätigt durch eine Zweitanalyse 3, unter Berücksichtigung der Messunsicherheit den Höchstgehalt zweifelsfrei überschreitet.
Die Messunsicherheit kann auf eine der beiden folgenden Arten berücksichtigt werden:
Die genannten Bestimmungen gelten für das Untersuchungsergebnis der für die amtliche Kontrolle entnommenen Probe. Im Falle einer Analyse für Rechtfertigungs- oder Referenzwecke gelten die einzelstaatlichen Bestimmungen.
2. Dioxine (PCDD/PCDF) und dioxinähnliche PCB
Die Partie wird akzeptiert, wenn das Ergebnis einer einzelnen Untersuchung,
Für Screening-Assays ist ein Cutoff-Wert festzulegen, anhand dessen entschieden wird, ob die jeweils relevanten Gehalte für PCDD/F bzw. die Summe von PCDD/F und dioxinähnlichen PCB eingehalten werden.
Die Partie entspricht nicht dem in der Verordnung (EG) Nr. 1881/2006 festgelegten Höchstgehalt, wenn die Obergrenze ("upperbound") des mit einem Bestätigungsverfahren erlangten Untersuchungsergebnisses, bestätigt durch eine Zweitanalyse 3, unter Berücksichtigung der Messunsicherheit den Höchstgehalt zweifelsfrei überschreitet.
Die Messunsicherheit kann auf eine der beiden folgenden Arten berücksichtigt werden:
Die genannten Bestimmungen gelten für das Untersuchungsergebnis der für die amtliche Kontrolle entnommenen Probe. Im Falle einer Analyse für Rechtfertigungs- oder Referenzwecke gelten die einzelstaatlichen Bestimmungen.
(3) Eine Zweitanalyse ist erforderlich, um eine interne Kreuzkontamination oder eine versehentliche Vermischung der Proben auszuschließen. Mit der Erstanalyse, welche die Messunsicherheit berücksichtigt, wird die Einhaltung der Höchstgehalte überprüft. Bei einer Untersuchung im Rahmen eines Kontaminationsfalls kann auf die Bestätigung durch Zweitanalyse verzichtet werden, wenn sich die untersuchten Proben auf den Kontaminationsfall zurückverfolgen lassen.
V. Überschreiten der Auslösewerte
Auslösewerte dienen als Instrument zur Auswahl der Proben in Fällen, in denen eine Kontaminationsquelle gefunden werden muss und Maßnahmen zu deren Eindämmung oder Beseitigung getroffen werden müssen. Durch Screening- Verfahren sind geeignete Cutoff-Werte für die Auswahl dieser Proben festzulegen. Die zur Bestimmung einer Kontaminationsquelle, deren Eindämmung oder Beseitigung notwendigen Maßnahmen werden nur dann getroffen, wenn die Überschreitung der Auslösewerte durch eine im Bestätigungsverfahren erfolgte Zweitanalyse unter Berücksichtigung der Messunsicherheit bestätigt wird 4.
______________
1) ABl. Nr. L 303 vom 06.11.1997, S. 12.
2) http://ec.europa.eu/food/food/chemicalsafety/contaminants/dioxins_en.htm
3) Eine Zweitanalyse ist erforderlich, um eine interne Kreuzkontamination oder eine versehentliche Vermischung der Proben auszuschließen. Mit der Erstanalyse, welche die Messunsicherheit berücksichtigt, wird die Einhaltung der Höchstgehalte überprüft. Bei eine Untersuchung im Rahmen eines Kontaminationsfalls kann auf die Bestätigung durch Zweitanalyse verzichtet werden, wenn sich die untersuchten Proben auf den Kontaminationsfall zurückverfolgen lassen.
4) Für Zweitanalysen zur Kontrolle der Auslösewerte gelten die gleichen Erklärungen und Anforderungen wie die für Höchstgehalte in Fußnote 3 genannten.
| Probenvorbereitung und Anforderungen an Untersuchungsverfahren zur amtlichen Kontrolle des Gehalts an Dioxinen (PCDD/PCDF) und dioxinähnlichen PCB in bestimmten Lebensmitteln | Anhang III |
1. Anwendungsbereich
Die in diesem Anhang beschriebenen Anforderungen gelten, wenn Lebensmittel zur amtlichen Kontrolle des Gehalts an 2,3,7,8-substituierten polychlorierten Dibenzo-pdioxinen und polychlorierten Dibenzofuranen (PCDD/F) und dioxinähnlichen polychlorierten Biphenylen (dioxinähnlichen PCB) untersucht werden.
Die Überwachung des Vorhandenseins von PCDD/F und dioxinähnlichen PCB in Lebensmitteln kann zwei verschiedenen Zwecken dienen:
2. Lassifikation der Verfahren nach dem Quantifizierungs-Grad 1
"Qualitative Methoden" zeigen an, ob die interessierenden Analyten vorliegen oder nicht, ohne dabei Hinweise auf die Konzentration des vermuteten Analyten zu geben. Potenziell könnten mit diesen Verfahren auch semiquantitative Ergebnisse erzielt werden, sie werden jedoch ausschließlich dazu verwendet, die Frage, ob Gehalte über oder unter bestimmten Werten (beispielsweise Nachweisgrenze, Bestimmungsgrenze oder Cutoff-Werte) vorliegen oder nicht, mit ja oder nein zu beantworten.
Zur Kontrolle der Höchstgehalte und Auslösewerte für PCDD/F und dioxinähnliche Verbindungen in Lebensmitteln können Screening-Verfahren verwendet werden, die auf einem Vergleich der Untersuchungsergebnisse mit einem Cutoff-Wert basieren und angeben, ob die interessierende Konzentration möglicherweise überschritten wird oder nicht. Hierfür wurden bioanalytische Methoden entwickelt. Generell könnten auch physikalisch-chemische Methoden entwickelt werden; aufgrund der auf TEQ basierenden Höchstgehalte und Auslösewerte und der komplexen Analyse mit Bestimmung der relevanten einzelnen Kongenere gibt es hierfür jedoch keine praktischen Beispiele.
"Semiquantitative Methoden" geben die ungefähre Konzentration an, als ein nützlicher Hinweis auf den Konzentrationsbereich des Analyten, der es dem Analytiker erleichtert, den Kalibrierbereich für die nachfolgend durchzuführende Bestätigungsuntersuchung festzulegen, sowie zur Qualitätssicherung. Beispiele hierfür sind:
"Quantitative Methoden" entsprechen den gleichen Anforderungen hinsichtlich Genauigkeit, Messbereich und Präzision wie die Bestätigungsverfahren. Ist eine Quantifizierung erforderlich, müssen diese Methoden als Bestätigungsverfahren so, wie in diesem Dokument für PCDD/F und dioxinähnliche PCB vorgeschrieben, validiert werden.
3. Hintergrund
Zur Berechnung der Toxizitätsäquivalente (TEQ) werden die Konzentrationen der einzelnen Substanzen in einer bestimmten Probe mit den jeweiligen Toxizitätsäquivalenzfaktoren (TEF) der Weltgesundheitsorganisation, die in der Anlage zu diesem Anhang aufgeführt sind, multipliziert und dann addiert, woraus sich die Gesamtkonzentration an dioxinähnlichen Verbindungen, ausgedrückt in TEQ, ergibt.
Screening- und Bestätigungsverfahren dürfen nur dann zur Kontrolle einer bestimmten Probenmatrix verwendet werden, wenn sie empfindlich genug sind, Gehalte im interessierenden Bereich (Auslösewerte oder Höchstgehalte) zuverlässig zu bestimmen.
4. Anforderungen an die Qualitätssicherung
5. Anforderungen an Laboratorien
6. Grundlegende Anforderungen an Verfahren zur Untersuchung auf Dioxine (PCDD/F) und Dioxinähnliche PCB
6.1. Niedriger Arbeitsbereich und niedrige Bestimmungsgrenzen
6.2. Hohe Selektivität (Spezifizität)
6.3. Hohe Genauigkeit (Richtigkeit und Präzision, beobachtete Bioassay-Wiederfindung)
6.4. Validierung im interessierenden Bereich und allgemeine Qualitätssicherungsmaßnahmen
6.5. Bestimmungsgrenze
6.6. Analysekriterien
| Screening mit bioanalytischen oder physikalisch- chemischen Verfahren |
Bestätigungsverfahren | |
| Falsch-Negativ-Rate * | < 5 % | |
| Richtigkeit | - 20 % bis + 20 % | |
| Wiederholbarkeit (RSDr): | < 20 % | |
| Laborinterne Reproduzierbarkeit (RSDR) | < 25 % | < 15 % |
| *) bezogen auf die Höchstgehalte | ||
6.7. Besondere Anforderungen an Screening-Verfahren
Etwa 2-10 % der konformen Proben sind, je nach Probenmatrix und Laborerfahrung, mittels GC/HRMS zu bestätigen.
Die Rate falschnegativer Ergebnisse beim Screening von Proben unter- und oberhalb der Höchstgehalte oder Auslösewerte ist zu bestimmen. Der tatsächliche Anteil der falschnegativen Ergebnisse muss unter 5 % liegen.
Nachdem im Rahmen der Qualitätssicherung je Matrix/Matrixgruppe mindestens 20 Proben bestätigt wurden, ist aus dieser Datenbasis die Falsch-Negativ-Rate zu ermitteln. Die zur Ermittlung der Falsch-Negativ-Rate mindestens erforderlichen 20 Ergebnisse können auch die Ergebnisse von in Ringversuchen oder im Rahmen eines Kontaminationsereignisses untersuchten Proben mit einschließen, die einen Konzentrationsbereich von beispielsweise bis zum doppelten Höchstgehalt abdecken. Die Proben müssen die häufigsten Kongeneren- Muster abdecken, die verschiedene Kontaminationsquellen repräsentieren.
Obwohl Screening-Verfahren hauptsächlich auf die Ermittlung derjenigen Proben abzielen, in denen der Auslösewert überschritten wird, ist das ausschlaggebende Kriterium zur Bestimmung der Falsch-Negativ- Rate der Höchstgehalt, unter Berücksichtigung der Messunsicherheit des Bestätigungsverfahrens.
7. Besondere Anforderungen an GC/HRMS-Verfahren für Screening- oder Bestätigungszwecke
7.1. Allgemeine Anforderungen
7.2. Kontrolle der Wiederfindungsrate
7.3. Entfernung interferierender Stoffe
7.4. Kalibrierung mittels Standardkurve
8. Besondere Anforderungen an Bioanalytische Methoden
Bioanalytische Methoden sind Verfahren, die auf der Anwendung biologischer Grundsätze beruhen, beispielsweise zellbasierte Assays, Rezeptor-Assays oder Immunoassays. In Nummer 8 werden allgemeine Anforderungen an bioanalytische Methoden festgelegt.
Mit einem Screening-Verfahren wird eine Probe prinzipiell entweder als konform oder als vermutlich nicht konform eingestuft. Dazu wird der berechnete BEQ-Wert mit dem Cutoff-Wert verglichen (siehe Nummer 8.3). Proben, die unter dem Cutoff-Wert liegen, gelten als konform, Proben die dem Cutoff-Wert entsprechen oder diesen überschreiten, gelten als vermutlich nicht konform und müssen mit einem Bestätigungsverfahren untersucht werden. In der Praxis kann ein BEQ-Gehalt, der 2/3 des Höchstgehalts entspricht, als geeignetester Cutoff- Wert dienen, mit dem eine Falsch-Negativ-Rate von unter 5 % sowie eine annehmbare Rate von falschpositiven Ergebnissen gewährleistet wird. Da für PCDD/F und für die Summe von PCDD/F und dioxinähnliche PCB unterschiedliche Höchstgehalte gelten, ist zur Prüfung der Konformität der Proben ohne Fraktionierung ein geeigneter Bioassay-Cutoff-Wert für PCDD/F erforderlich. Zur Überprüfung von Proben, in denen die Auslösewerte überschritten werden, würde sich ein entsprechender Prozentsatz der interessierenden Konzentration als Cutoff-Wert eignen.
Außerdem kann bei bestimmten bioanalytischen Methoden ein ungefährer Gehalt, ausgedrückt in BEQ, für solche Proben angegeben werden, die im Arbeitsbereich liegen und den Meldewert überschreiten (siehe Nummern 8.1.1 und 8.1.6).
8.1. Signalauswertung
8.1.1. Allgemeine Anforderungen
8.1.2. Kalibrierung
8.1.2.1. Kalibrierungmittels Standardkurve
8.1.2.2. Kalibrierung anhand von Referenzproben
Alternativ kann eine Kalibrierkurve auf Grundlage von mindestens 4 Referenzproben im Bereich der interessierenden Konzentration verwendet werden (siehe Nummer 8.2: eine Matrixleerwert-Probe sowie drei Referenzproben, die jeweils 0,5 ×, 1,0 × und 2,0 × die interessierende Konzentration enthalten), wodurch keine Notwendigkeit zur Korrektur um Blindwerte und Wiederfindung besteht. In diesem Fall kann das Signal, das 2/3 des Höchstgehalts entspricht (siehe Nummer 8.3), direkt auf Grundlage dieser Proben berechnet und als Cutoff-Wert verwendet werden. Zur Überprüfung von Proben, in denen die Auslösewerte überschritten werden, würde sich ein entsprechender Prozentsatz dieser Auslösewerte als Cutoff-Wert eignen.
8.1.3. Separate Bestimmung von PCDD/F und dioxinähnlichen PCB
Extrakte können in Fraktionen, welche PCDD/F und dioxinähnliche PCB enthalten, aufgetrennt werden, so dass PCDD/F-TEQ und TEQ der dioxinähnlichen Verbindungen (jeweils als BEQ) getrennt angegeben werden können. Zur Bewertung der Ergebnisse für die Fraktion, die dioxinähnliche PCB enthält, ist vorzugsweise eine PCB-126- Kalibrierkurve zu verwenden.
8.1.4. Beobachtete Bioassay-Wiederfindung
Die beobachtete Bioassay-Wiederfindung ist auf Grundlage geeigneter Referenzproben mit repräsentativen Kongeneren-Mustern im Bereich der interessierenden Konzentration zu berechnen und wird als Prozentsatz des BEQ- Gehalts im Vergleich zum TEQ-Gehalt ausgedrückt. Je nachdem, welche Art von Assay oder TEF 2 verwendet wird, können die Unterschiede zwischen TEF- und REP-Faktoren in dioxinähnlichen PCB zu niedrigeren Wiederfindungswerten für dioxinähnliche PCB im Vergleich zu PCDD/F führen. Daher muss die beobachtete Bioassay- Wiederfindung bei einer getrennten Bestimmung von PCDD/F und dioxinähnlichen PCB für dioxinähnliche PCB 25 bis 60 % und für PCDD/F 50 bis 130 % betragen (bei Verwendung einer TCDD-Kalibrierkurve). Der Beitrag der dioxinähnlichen PCB zur Summe der PCDD/F und dioxinähnlichen PCB kann je nach Matrices und Proben unterschiedlich sein; dies spiegelt sich in der beobachteten Bioassay-Wiederfindung für den Summen-Parameter wider, die zwischen 30 und 130 % liegen muss.
8.1.5. Kontrolle der Wiederfindung nach Reinigung der Probenextrakte
8.1.6. Meldegrenze
8.2. Verwendung von Referenzproben
8.3. Bestimmung der Cutoff-Werte
Die Beziehung zwischen den in BEQ ausgedrückten Ergebnissen der bioanalytischen Methode und den in TEQ ausgedrückten Ergebnissen des GC/HRMS-Verfahrens ist zu ermitteln (z.B. durch Matrixbezogene Kalibrierexperimente unter Verwendung von Referenzproben, die mit 0, 0,5 ×, 1 × und 2 × dem Höchstgehalt dotiert sind und auf jeder Konzentrationsstufe jeweils 6 Mal untersucht werden (n=24) ). Korrekturfaktoren (für Leerwert und Wiederfindung) können auf der Grundlage dieses Verhältnisses geschätzt werden, müssen jedoch in jeder Test-Serie durch Einbeziehung von Methoden-/Matrixleerwert-Proben und Wiederfindungsproben (vgl. Nummer 8.2) überprüft werden.
Für die Entscheidung, ob eine Probe den Höchstgehalten entspricht, oder zur Überprüfung der Auslösewerte, falls von Interesse, sind Cutoff-Werte zu ermitteln, wobei die interessierenden Konzentrationen entweder einzeln für PCDD/F und dioxinähnliche PCB, oder aber für die Summe von PCDD/F und dioxinähnlichen PCB festgelegt sein können. Sie stellen denunteren Endpunkt der Verteilung bioanalytischer Ergebnisse (korrigiert um Leerwert und Wiederfindung) von Proben dar, die Gehalte an der Entscheidungsgrenze des GC/HRMS-Verfahrens aufweisen, berechnet auf Grundlage eines Vertrauensniveaus von 95 %, was eine Falsch-Negativ-Rate von < 5 % impliziert, und auf Basis einer RSDR unter 25 %. Die GC/HRMS-Entscheidungsgrenze entspricht dem Höchstgehalt zuzüglich der Messunsicherheit.
In der Praxis kann der Cutoff-Wert (in BEQ) gemäß folgenden Ansätzen berechnet werden (Abbildung 1):
8.3.1. Verwendung des unteren Bands des Prognoseintervalls von 95 % an der GC/HRMS-Entscheidungsgrenze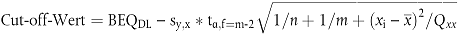
| Dabei ist | |
| BEQ DL | der BEQ-Wert, der der GC/HRMS-Entscheidungsgrenze entspricht, die wiederum dem Höchstgzuzüglich der Messunsicherheit entspricht. |
| sy,x | die Reststandardabweichung |
| tα,f=m-2 | der Student-t-Faktor (α = 5 %, f = Freiheitsgrade, einseitig) |
| m | die Gesamtzahl der Kalibrierpunkte (Laufzahl j) |
| n | die Anzahl der Wiederholungen auf jeder Ebene |
| xi | die GC/HRMS-Probenkonzentration (in TEQ) des Kalibrierpunktes i |
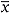 |
der Mittelwert der Konzentrationen (in TEQ) aller Kalibrierproben |
 |
|
8.3.2. Berechnung aus bioanalytischen Ergebnissen (korrigiert um Leerwert und Wiederfindung) aus der Mehrfachuntersuchung (n ≥ 6) von Proben, die Gehalte an der GC/HRMS-Entscheidungsgrenze aufweisen, alsunterer Endpunkt der Datenverteilung am entsprechenden BEQ-Mittelwert:
Cutoff-Wert = BEQDL - 1,64 × SDR Dabei ist
SDR die Standardabweichung der Bioassay-Ergebnisse am BEQDL, gemessen unter laborinternen Reproduzierbarkeitsbedingungen
8.3.3. Berechnung als Mittelwert bioanalytischer Ergebnisse (in BEQ, korrigiert um Blindwert und Wiederfindung) aus der Mehrfachuntersuchung (n ≥ 6) von Proben, die mit 2/3 der interessierenden Konzentration kontaminiert sind. Dieses Verfahren beruht auf der Beobachtung, dass dieser Wert in der Nähe des gemäß Nummer 8.3.1 oder 8.3.2 bestimmten Cutoff-Wertes liegt.
Berechnung der Cutoff-Werte auf der Grundlage eines Vertrauensniveaus von 95 %, was eine Falsch-Negativ-Rate von < 5 % impliziert, und auf Basis einer RSDR unter 25 %. 1. vom unteren Band des 95 %igen Prognoseintervalls an der HRGC/HRMS-Entscheidungsgrenze, 2. aus Mehrfachuntersuchungen (n³ 6) von Proben mit Gehalten an der HRGC/HRMS-Entscheidungsgrenze, als unterer Endpunkt der Datenverteilung (in der Abbildung durch eine glockenförmige Kurve dargestellt) am entsprechenden BEQ-Mittelwert.
8.3.4. Beschränkungen der Cutoff-Werte:
Auf BEQ basierende Cutoff-Werte, die anhand der im Rahmen der Validierung und unter Verwendung einer begrenzten Anzahl von Proben mit unterschiedlichen Matrix-/Kongeneren-Mustern erzielten RSDR berechnet wurden, können höher sein als die auf TEQ basierenden interessierenden Konzentrationen, da hier die Präzision höher ist, als es in einer Routine möglich ist, in der ein unbekanntes Spektrum möglicher Kongeneren-Muster überprüft werden muss. In solchen Fällen ist der Berechnung der Cutoff-Werte eine RSDR = 25 % zugrunde zu legen, oder aber es sind zwei Drittel der interessierenden Konzentration als Cutoff-Wert zu verwenden.
8.4. Leistungsmerkmale
9. Bericht über die Ergebnisse
Bestätigungsverfahren
Bioanalytische Screening-Verfahren
____________________
1) Nach dem Muster der "Guidelines for the validation of screening methods for residues of veterinary medicines" (Leitlinien für die Validierung von Screening-Verfahren für Rückstände von Tierarzneimitteln), EU-Referenzlaboratorien für Rückstände von Tierarzneimitteln und Kontaminanten in Lebensmitteln tierischen Ursprungs in Fougères, Berlin und Bilthoven, 20. Januar 2010, http://ec.europa. eu/food/food/chemicalsafety/residuesßab_analysis_en.htm, angepasst für PCDD/F und dioxinähnliche PCB.
2) Die derzeitigen Anforderungen basieren auf den in M. Van den Berg et al, Toxicol. Sci. 93 (2), 223-241 (2006) veröffentlichten TEF.
| Anlage zu Anhang III |
TEF der WHO zur Bewertung des Risikos beim Menschen auf Grundlage der Schlussfolgerungen der Experten-Sitzung der Weltgesundheitsorganisation und des Internationalen Programms für Chemikaliensicherheit (IPCS - International Programme on Chemical Safety) in Genf im Juni 2005 (Martin van den Berg et al., The 2005 World Health Organization Reevaluation of Human and Mammalian Toxic Equivalency Factors for Dioxins and Dioxinlike Compounds. Toxicological Sciences 93(2), 223-241 (2006) )
| Kongener | TEF-Wert | Kongener | TEF-Wert |
| Dibenzo-pdioxine (PCDD) | Dioxinähnliche PCB: Nonortho- PCB + Monoortho-PCB | ||
| 2, 3, 7,8-TCDD | 1 | ||
| 1,2,3,7,8-PeCDD | 1 | Nonortho PCB | |
| 1,2,3,4,7,8-HxCDD | 0,1 | PCB 77 | 0,0001 |
| 1,2,3,6,7,8-HxCDD | 0,1 | PCB 81 | 0,0003 |
| 1,2,3,7,8,9-HxCDD | 0,1 | PCB 126 | 0,1 |
| 1,2,3,4,6,7,8-HpCDD | 0,01 | PCB 169 | 0,03 |
| OCDD | 0,0003 | ||
| Dibenzofurane (PCDF) | Monoortho PCB | ||
| 2,3,7,8-TCDF | 0,1 | PCB 105 | 0,00003 |
| 1,2,3,7,8-PeCDF | 0,03 | PCB 114 | 0,00003 |
| 2,3,4,7,8-PeCDF | 0,3 | PCB 118 | 0,00003 |
| 1,2,3,4,7,8-HxCDF | 0,1 | PCB 123 | 0,00003 |
| 1,2,3,6,7,8-HxCDF | 0,1 | PCB 156 | 0,00003 |
| 1,2,3,7,8,9-HxCDF | 0,1 | PCB 157 | 0,00003 |
| 2,3,4,6,7,8-HxCDF | 0,1 | PCB 167 | 0,00003 |
| 1,2,3,4,6,7,8-HpCDF | 0,01 | PCB 189 | 0,00003 |
| 1,2,3,4,7,8,9-HpCDF | 0,01 | ||
| OCDF | 0,0003 | ||
| Abkürzungen: "T" = tetra; "Pe" = penta; "Hx" = hexa; "Hp" = hepta; "O" = octa; "CDD" = Chlordibenzodioxin; "CDF" = Chlordibenzofuran; "CB" = Chlorbiphenyl. | |||
| Probenvorbereitung und Anforderungen an Untersuchungsverfahren zur amtlichen Kontrolle des Gehalts an nicht dioxinähnlichen PCB (PCB Nrn. 28, 52, 101, 138, 153, 180) in bestimmten Lebensmitteln | Anhang IV |
1. Anzuwendende Nachweisverfahren
Gaschromatografie/Elektroneneinfangdetektor (GC/ECD), GC/LRMS, GC/MS-MS, GC/HRMS oder gleichwertige Verfahren.
2. Bestimmung und Bestätigung der interessierenden Analyten
Anmerkung: Kongenere, die oft koeluieren, sind beispielsweise PCB 28/31, PCB 52/69 und PCB 138/163/164. Bei GC/MS-Verfahren muss auch die Möglichkeit von Störungen durch Fragmente höher chlorierter Kongenere berücksichtigt werden.
Relative Abweichung des Isotopenhäufigkeitsverhältnisses ausgewählter Massenfragmente von der theoretischen Häufigkeit oder dem Kalibrierstandard für das Zielion (das am häufigsten vorkommende Ion) und das/die Qualifizier-Ion/en.
| Relative Intensität des/der Qualifizier-Ions/-Ionen im Vergleich zum Zielion | GC-EI-MS (relative Abweichung) |
GC-CI-MS, GC-MS n (relative Abweichung) |
| > 50 % | ± 10 % | ± 20 % |
| > 20 bis 50 % | ± 15 % | ± 25 % |
| > 10 bis 20 % | ± 20 % | ± 30 % |
| £ 10 % | ± 50 % * | ± 50 % * |
| *) Ausreichende Anzahl von Massenfragmenten mit relativer Intensität > 10 % verfügbar, daher ist es nicht empfehlenswert, Qualifizier-Ionen mit einer relativen Intensität von weniger als 10 % im Vergleich zum Zielion zu verwenden. | ||
Bestätigung der Ergebnisse, die die Toleranzgrenze überschreiten, anhand von zwei GC-Säulen mit stationären Phasen unterschiedlicher Polarität.
3. Nachweis der Leistungsfähigkeit des Verfahrens
Validierung im interessierenden Bereich (0,5 bis 2 Mal interessierende Konzentration) mit einem akzeptablen Variationskoeffizienten für wiederholte Analysen (siehe Anforderungen an die Laborpräzision unter Nummer 8).
4. Bestimmungsgrenze
Die Methodenleerwerte dürfen nicht höher sein als 30 % des Kontaminationswerts, der dem Höchstgehalt entspricht 1.
5. Qualitätssicherung
Regelmäßige Methodenleerwert-Kontrollen, Analysen dotierter Proben, Qualitätssicherungsproben, Teilnahme an Laborvergleichsuntersuchungen zu relevanten Matrices.
6. Kontrolle der Wiederfindungsrate
7. Anforderungen an Laboratorien
Gemäß den Bestimmungen der Verordnung (EG) Nr. 882/2004 müssen die Laboratorien von einer anerkannten Stelle akkreditiert sein, die nach ISO Guide 58 arbeitet, damit sichergestellt ist, dass die Laboratorien bei der Untersuchung Qualitätssicherungsverfahren anwenden. Die Laboratorien müssen gemäß der Norm ISO/IEC/17025 akkreditiert sein.
8. Leistungsmerkmale: Kriterien für die Summe der sechs Indikator-PCB im interessierenden Bereich
| Richtigkeit | - 30 bis + 30 % |
| Laborpräzision (RSD%) | ≤ 20 % |
| Differenz zwischen berechneter Obergrenze ("upperbound") und Untergrenze ("lowerbound") | ≤ 20 % |
9. Bericht über die Ergebnisse
_______________
1) Ein geringerer Beitrag der Methodenleerwerte zum Kontaminationsgehalt der Probe ist äußerst empfehlenswert. Das Labor ist dafür zuständig, die Variation der Methodenleerwerte zu überwachen, insbesondere, wenn die Methodenleerwerte abgezogen werden.
 |
ENDE |  |
(Stand: 14.04.2025)
Alle vollständigen Texte in der aktuellen Fassung im Jahresabonnement
Nutzungsgebühr: ab 105.- € netto
(derzeit ca. 7200 Titel s.Übersicht - keine Unterteilung in Fachbereiche)
Die Zugangskennung wird kurzfristig übermittelt
? Fragen ?
Abonnentenzugang/Volltextversion