

umwelt-online: Bestimmung der Toxizität
 |
zurück |  |
| Methoden zur Bestimmung der Toxizität
B.4. Akute Toxizität: Hautreizung/-Verätzung |
Anhang V zur RL 67/548/EWG |
B.4. 1. Methode
Diese Prüfmethode entspricht der OECD TG 404 (2002).
B.4. 1.1 Einleitung
Bei der Erarbeitung dieser aktualisierten Methode wurde besonderes Augenmerk auf mögliche Verbesserungen im Hinblick auf Belange des Tierschutzes und auf die Auswertung aller bereits vorhandenen Angaben über den Stoff gelegt, um unnötige Prüfungen an Labortieren zu vermeiden. Die vorliegende Methode beinhaltet die Empfehlung, vor der Durchführung des beschriebenen In-vivo-Tests zur Ermittlung des Verätzungs-/Reizungspotenzials des Stoffs eine kritische Analyse der vorhandenen einschlägigen Daten vorzunehmen. Sofern dazu nicht genügend Daten zur Verfügung stehen, können diese mit Hilfe sequenzieller Tests erzeugt werden (1). Die empfohlene Prüfstrategie enthält die Durchführung validierter und anerkannter In-vitro-Tests und wird im Anhang zu dieser Methode ausführlich dargestellt. Zudem wird empfohlen, beim In-vivo-Vorversuch nach Möglichkeit die drei Mullläppchen, mit denen die Prüfsubstanz aufgetragen wird, nacheinander und nicht gleichzeitig am Körper des Tiers zu fixieren.
Im Interesse wissenschaftlicher Verlässlichkeit und des Tierschutzes sollen In-vivo-Tests erst dann durchgeführt werden, wenn alle für das Hautverätzungs/-reizungspotenzial des Stoffs zur Verfügung stehenden einschlägigen Daten im Rahmen einer kritischen Analyse ausgewertet worden sind. Zu diesen Daten gehören unter anderem Erkenntnisse aus bereits durchgeführten Untersuchungen am Menschen und/oder an Labortieren; Hinweise auf Verätzungen/Reizungen durch strukturell verwandte Substanzen bzw. Gemische aus diesen Substanzen; Daten, die eine starke Azidität oder Alkalinität der Substanz belegen (2)(3), und die Ergebnisse validierter und anerkannter In-vitro- und Ex-vivo-Tests (4)(5)(5x). Diese Analyse soll dazu führen, dass weniger In-vivo-Untersuchungen zum Hautverätzungs-/-reizungspotenzial von Stoffen durchgeführt werden, wenn bereits andere Studien zu diesen beiden Endpunkten ausreichende Belege geliefert haben.
Im Anhang zu dieser Methode wird eine bevorzugte sequenzielle Prüfstrategie vorgestellt, welche die Durchführung validierter und anerkannter In-vitro- und Ex-vivo-Tests auf Verätzungs-/Reizungswirkungen einbezieht. Diese Strategie wurde während eines OECD-Workshops (6) entwickelt und von den Teilnehmern einmütig empfohlen. Sie wurde als empfohlene Prüfstrategie für das Globale Harmonisierte System der Einstufung und Kennzeichnung Chemischer Stoffe (Globally Harmonised System for the Classification of Chemical Substances = GHS) (7) angenommen. Es wird empfohlen, dass diese sequenzielle vor einem In-vivo-Test durchgeführt wird. Bei neuen Substanzen wird sie als stufenweiser Prüfansatz empfohlen, mit dessen Hilfe verlässliche wissenschaftliche Daten über die durch die Prüfsubstanz hervorgerufene Verätzung/Reizung erzielt werden können. Bei bereits bekannten Stoffen, für die nicht genügend Daten zum Hautvrätzungs-/reizungspotenzial vorliegen, soll die Strategie genutzt werden, um Datenlücken zu schließen. Der Einsatz einer anderen Prüfstrategie bzw. eines anderen Prüfverfahrens oder die Entscheidung gegen einen stufenweisen Prüfansatz sollgerechtfertigt werden.
Falls das Verätzungs-/Reizungspotenzial anhand einer gewichteten Analyse nicht ermittelt werden kann, die den Anforderungen der sequenziellen Prüfstrategie gerecht wird, soll ein In-vivo-Test ins Auge gefasst werden (siehe Anhang).
B.4. 1.2 Definitionen
Hautreizung: ist das Auslösen einer reversiblen Hautschädigung nach Applikation einer Prüfsubstanz für die Dauer von bis zu 4 Stunden.
Hautverätzung: ist das Auslösen einer irreversiblen Hautschädigung, d. h. einer sichtbaren, bis in das Corium reichenden Nekrose der Epidermis nach Applikation einer Prüfsubstanz für die Dauer von bis zu 4 Stunden. Verätzungsreaktionen sind gekennzeichnet durch Geschwüre, Blutungen, blutige Verschorfungen und am Ende des Beobachtungszeitraums von 14 Tagen durch eine auf ein Ausbleichen der Haut zurückzuführende Verfärbung, komplett haarlose Bereiche und Narben. Bei unklaren Schädigungen sollen histopathologische Untersuchungen in Erwägung gezogen werden.
B.4. 1.3 Prinzip der Prüfmethode
Die Prüfsubstanz wird in einer einmaligen Dosierung auf die Haut eines Versuchstiers aufgetragen; nicht behandelte Hautareale dienen als Kontrolle. Der Grad der Reizung/Verätzung wird in zuvor festgelegten Zeitabständen bestimmt und bewertet und anschließend beschrieben, um eine umfassende Beurteilung der Wirkung vornehmen zu können. Die Beobachtungsdauer soll ausreichend sein, um die Reversibilität bzw. Irreversibilität der Wirkungen vollständig zu erfassen.
Tiere mit starken und anhaltenden Anzeichen von Leiden und/oder Schmerzen können jederzeit während des Versuchs human getötet werden, wobei die Substanz entsprechend einzustufen ist. Kriterien für die humane Tötung moribunder Tiere mit starken Anzeichen von Leiden sind dem Literaturhinweis (8) zu entnehmen.
B.4. 1.4 Beschreibung der Prüfmethode
B.4. 1.4.1 Vorbereitung des In-vivo-Tests
B.4. 1.4.1.1 Auswahl der Tierspezies
Das bevorzugte Labortier ist das Albino-Kaninchen, wobei für den Test gesunde junge erwachsene Kaninchen verwendet werden. Die Verwendung anderer Spezies ist zu begründen.
B.4. 1.4.1.2 Vorbereitung der Versuchstiere
Etwa 24 Stunden vor dem Versuch wird das Fell auf dem Rücken der Versuchstiere gründlich geschoren. Dabei ist darauf zu achten, dass die Haut nicht verletzt wird. Es sind nur Tiere mit einer gesunden, unverletzten Haut zu verwenden.
Einige Kaninchenrassen haben Stellen mit dichtem Fellbewuchs, die zu bestimmten Zeiten im Jahr deutlicher hervortreten. An diesen Stellen soll keine Prüfung durchgeführt werden.
B.4. 1.4.1.3 Haltungs- und Fütterungsbedingungen
Die Tiere sollen einzeln gehalten werden. Die Temperatur im Versuchstierraum soll für Kaninchen 20°C (±3°C) betragen. Obwohl die relative Luftfeuchtigkeit mindestens 30% betragen und zu anderen Zeiten als während der Reinigung vorzugsweise nicht über 70% liegen sollte, ist ein Wert von 50-60% anzustreben. Der Raum soll künstlich beleuchtet sein, wobei die Beleuchtung im 12-Stunden-Rhythmus ein- und ausgeschaltet werden soll. An die Versuchstiere kann herkömmliches Laborfutter verfüttert werden, wobei eine unbegrenzte Trinkwasserversorgung zu gewährleisten ist.
B.4. 1.4.2 Prüfverfahren
B.4. 1.4.2.1 Applikation der Prüfsubstanz
Die Prüfsubstanz soll auf eine kleine Hautfläche (etwa 6 cm2) aufgetragen und mit einem Mullläppchen abgedeckt werden, das mit einem nicht reizenden Pflaster fixiert wird. Sofern eine direkte Applikation nicht möglich ist (z.B. bei Flüssigkeiten oder bestimmten Pasten), soll die Prüfsubstanz zunächst auf das Mullläppchen gegeben werden, das anschließend auf der Haut fixiert wird. Für die Dauer der Exposition soll das Läppchen mit einem geeigneten Okklusiv- oder Semi-Okklusiv-Verband lose auf der Haut gehalten werden. Wird die Prüfsubstanz auf ein Läppchen aufgebracht, so ist dieses so auf der Haut zu fixieren, dass ein guter Hautkontakt und die gleichmäßige Verteilung der Substanz auf der Haut gewährleistet ist. Es ist zu vermeiden, dass das Tier an das Mullläppchen gelangt und die Prüfsubstanz oral aufnehmen bzw. inhalieren kann.
Flüssige Prüfsubstanzen werden im Allgemeinen unverdünnt angewendet. Wird der Versuch mit Feststoffen durchgeführt (die im Bedarfsfall pulverisiert werden können), dann soll die Prüfsubstanz mit gerade so viel Wasser (bzw. gegebenenfalls mit einem anderen geeigneten Vehikel) angefeuchtet werden, dass ein guter Kontakt mit der Haut sichergestellt ist. Bei Verwendung eines anderen Vehikels als Wasser soll dessen möglicher Einfluss auf eine Reizung der Haut minimal sein.
Nach Ablauf der Expositionszeit, die in der Regel 4 Stunden beträgt, wird die restliche Prüfsubstanz möglichst mit Wasser oder einem geeigneten Lösungsmittel entfernt, ohne dass die bestehende Reaktion oder die Integrität der Epidermis beeinträchtigt wird.
B.4. 1.4.2.2 Dosierungen
Im Falle von Flüssigkeiten werden 0,5 ml und im Falle von Feststoffen oder Pasten 0,5 g auf die vorbereitete Hautstelle aufgetragen.
B.4. 1.4.2.3 Vorversuch (In-vivo-Test au Hautreizung/-verätzung an einem Tier)
Es empfiehlt sich dringend, den In-vivo-Test zunächst nur an einem Tier durchzuführen. Dies gilt insbesondere, wenn der Verdacht besteht, dass der Stoff ein Verätzungspotenzial hat. Damit wird den Anforderungen der sequenziellen Prüfstrategie entsprochen (siehe Anhang 1).
Sofern ein Stoff anhand einer kritischen Analyse vorhandener Daten als ätzend eingestuft wurde, brauchen keine weiteren Tierversuche durchgeführt zu werden. Bei den meisten Stoffen mit einer vermuteten Ätzungswirkung erübrigen sich in der Regel In-vivo-Tests. Allerdings können in den Fällen, in denen angesichts einer unzureichenden Datenlage die Ermittlung zusätzlicher Daten gerechtfertigt scheint, in begrenztem Umfang Tierversuche durchgeführt werden, wobei folgendermaßen vorzugehen ist: Bis zu drei Läppchen werden nacheinander appliziert. Das erste Läppchen wird nach drei Minuten entfernt. Wird keine schwere Hautreaktion festgestellt, erfolgt die Applikation eines zweiten Läppchens, das nach einer Stunde entfernt wird. Lassen die Beobachtungen zu diesem Zeitpunkt den Schluss zu, dass eine Exposition für die Dauer von vier Stunden ethisch verantwortbar ist, wird ein drittes Läppchen appliziert und nach vier Stunden entfernt. Anschließend wird die Reaktion bewertet.
Der Versuch wird sofort abgebrochen, falls nach einem der drei sequenziellen Expositionen eine ätzende Wirkung beobachtet wird. Ist nach der Entfernung des letzten Läppchens keine Verätzung feststellbar, wird das Tier 14 Tage lang beobachtet, sofern nicht vor Ablauf dieser Zeit Verätzungen auftreten.
Geht man davon aus, dass die Prüfsubstanz zwar keine ätzende Wirkung hat, aber Hautreizungen hervorrufen kann, sollte nur ein Tier verwendet werden, dem ein einziges Läppchen für die Dauer von vier Stunden appliziert wird.
B.4. 1.4.2.4 Bestätigungstest (In-vivo-Test auf hautreizende Wirkungen an zusätzlichen Tieren)
Wird im Vorversuch keine ätzende Wirkung beobachtet, dann soll die Reizungsreaktion bzw. die negative Reaktion an bis zu zwei weiteren Tieren mit jeweils einem Läppchen bei einer Expositionsdauer von vier Stunden bestätigt werden. Ergibt der Vorversuch eine Reizungswirkung, kann der Bestätigungstest als sequenzieller Versuch bzw. durch gleichzeitige Exposition von zwei weiteren Tieren durchgeführt werden. Findet ausnahmsweise kein Vorversuch statt, können zwei bzw. drei Tiere mit einem Läppchen behandelt werden, das nach vier Stunden entfernt wird. Bei Verwendung von zwei Versuchstieren, die beide die gleiche Reaktion zeigen, erübrigen sich weitere Untersuchungen. Andernfalls wird auch das dritte Tier getestet. Unklare Reaktionen könnten möglicherweise bewertet werden, indem Versuche mit weiteren Tieren durchgeführt werden.
B.4. 1.4.2.5 Beobachtungszeitraum
Die Beobachtungszeit soll so bemessen sein, dass die Reversibilität der festgestellten Wirkungen vollständig bewertet werden kann. Allerdings sollte der Versuch abgebrochen werden, sobald das Tier starke und anhaltende Anzeichen von Leiden und Schmerzen zeigt. Um feststellen zu können, ob die Wirkungen reversibel sind, sollen die Tiere für die Dauer von bis zu 14 Tagen nach Entfernung der Läppchen beobachtet werden. Bilden sich die Schäden vor Ablauf dieser 14 Tage zurück, soll der Versuch zu dem betreffenden Zeitpunkt beendet werden.
B.4. 1.4.2.6 Klinische Beobachtungen und Bewertung von Hautreaktionen
Die Tiere sind auf Anzeichen von Hautrötungen und Ödemen zu untersuchen, wobei die Reaktion 60 Minuten sowie 24, 48 und 72 Stunden nach Entfernen des Läppchens bewertet wird. Beim Vorversuch an einem Tier wird die behandelte Stelle auch unmittelbar nach Entfernen des Läppchens untersucht. Die Hautreaktionen werden bewertet und anhand der Punkteskala in der unten stehenden Tabelle dokumentiert. Im Falle von Hautschädigungen, die nach 72 Stunden weder als Reizung noch als Verätzung eingestuft werden können, ist unter Umständen die Beobachtung bis zum 14. Tag erforderlich, um Aussagen zur Reversibilität der Wirkungen treffen zu können. Neben Hautreizungen sollen alle örtlich begrenzten toxischen Wirkungen (z.B. Entfettung der Haut), und alle negativen systemischen Wirkungen (z.B. klinische Anzeichen für Toxizität und Veränderungen des Körpergewichts) vollständig beschrieben und dokumentiert werden. Unklare Reaktionen sollen gegebenenfalls durch eine histopathologische Untersuchung abgeklärt werden.
Die Bewertung von Hautreaktionen ist zwangsläufig subjektiv. Um die Einstufung von Hautreaktionen stärker zu vereinheitlichen und den Prüflabors und allen an den Versuchen und an der Interpretation der Versuchsergebnisse Beteiligten die Arbeit zu erleichtern, müssen die Prüfer im Umgang mit der Bewertungsskala (siehe unten stehende Tabelle) entsprechend geschult werden. Dabei könnte sich ein Leitfaden mit Abbildungen zur Bewertung von Hautreizungen und anderen Schädigungen als hilfreich erweisen (9).
B.4. 2. Daten
B.4. 2.1 Ergebnisdarstellung
Die Untersuchungsergebnisse sollen im Abschlussbericht in Tabellenform dargestellt werden und alle in Abschnitt 3.1 genannten Punkte umfassen.
B.4. 2.2 Ergebnisbewertung
Die Bewertung der Hautreizung soll anhand der Art und des Schweregrads der Schädigung und deren Reversibilität bzw. Irreversibilität vorgenommen werden. Die einzelnen ermittelten Schweregrade stellen keinen allein gültigen Maßstab für die hautreizenden Eigenschaften eines Stoffs dar, denn es werden auch andere Effekte der Prüfsubstanz beurteilt. Vielmehr sollten diese einzelnen Graduierungswerte als Referenzwerte betrachtet werden, die zusammen mit allen anderen Ergebnissen der Studie zu beurteilen sind.
Bei der Bewertung von hautreizenden Reaktionen spielt auch die Reversibilität der Hautschädigung eine Rolle. Bestehen Reaktionen wie (begrenzter) Haarausfall, Hyperkeratose, Hyperplasie und Schuppung bis zum Ende des 14-tägigen Beobachtungszeitraums, soll die Prüfsubstanz als hautreizender Stoffbetrachtet werden.
B.4. 3. Berichterstattung
B.4. 3.1 Prüfbericht
Der Prüfbericht muss folgende Angaben enthalten:
Begründung für den In-vivo-Test: Kritische Analyse von Daten aus früheren Versuchen unter Einbeziehung von Ergebnissen aus der sequenziellen Prüfstrategie:
Prüfsubstanz:
Angaben zur Identität (z.B. CAS-Nummer, Bezugsquelle, Reinheit, bekannte Verunreinigungen; Chargennummer);
Vehikel:
Versuchstiere:
verwendete Spezies/Rasse, Begründung für den Verzicht auf die Verwendung von Albino-Kaninchen und die Nutzung anderer Tiere;
Prüfbedingungen:
Ergebnisse:
tabellarische Erfassung der Bewertung des Schweregrades von Hautreizungs-/-verätzungsreaktionen zu allen Messzeitpunkten für jedes einzelne Versuchstier; Beschreibung aller beobachteten Schädigungen;
Diskussion der Ergebnisse
B.4. 4. Literaturhinweise
(1) Barratt, M.D., Castell, J.V., Chamberlain, M., Combes, R.D., Dearden, J.C., Fentem, J.H., Gerner, 1., Giuliani, A., Gray, T.J.B., Livingston, D.J., Provan, W.M., Rutten, F.A.J.J.L., Verhaar, H.J.M., Zbinden, P. (1995) The Integrated Use of Alternative Approaches for Predicting Toxic Hazard. ECVAM Workshop Report B. ATLa 23, 410 - 429.
(2) Young, J.R., How, M.J., Walker, A.P., Worth, W.M.H. (1988) Classification as Corrosive or Irritant to Skin of Preparations Containing Acidic or Alkaline Substances Without Testing an Animals. Toxicol. /n Vitro, 2, 19 - 26.
(3) Worth, A.P., Fentem, J.H., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Esdaile, D.J., Liebsch, M. (1998) Evaluation of the proposed OECD Testing Strategy for Skin corrosion. ATLa 26, 709-720.
(4) ECETOC (1990) Monographie Nr. 15, "Skin Irritation" (Hautreizung), Umwelt- und Technologiezentrum der Europäischen Chemischen Industrie, Brüssel.
(5) Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., , Esdaile, D.J., Holzhutter, H.G., und Liebsch, M. (1998) The ECVAM international validation study an in vitro tests for Skin corrosivity. 2. Results and evaluation by the Management Team. Toxicology in Vitro 12, S. 483 - 524.
(5a) Prüfmethode B.40: Hautverätzung.
(6) OECD (1996) OECD Test Guidelines Programme: Final Report of the OECD Workshop an Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods. Solna, Schweden, 22. - 24. Januar 1996 (http://wwwl.oecd.org/ehs/test/background.htm).
(7) OECD (1998) Harmonized Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances, bestätigt auf der 28. Gemeinsamen Tagung des Chemikalien-Ausschusses und der Arbeitsgruppe Chemikalien, November 1998 (http://www 1.oecd.org/ehs/Class/HCL6.htm).
(8) OECD (2000). Guidance Document an the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation. OECD Environmental Health and Safety Publications. Series an Testing and Assessment No. 19 (http://wwwl.oecd.org/ehs/test/monos.htm).
(9) EPa (1990). Atlas of Dermal Lesions, (201-2004). United States Environmental Protection Agency, Office of Pesticides and Toxic Substances, Washington, DC, August 1990. lauf Anfrage beim OECD-Sekretariat erhältlich].
Tabelle 1: Bewertung von Hautreaktionen
Bildung von Erythemen und Schorf
| Kein Erythem | 0 |
| Sehr leichtes Erythem (kaum wahrnehmbar) | 1 |
| Klar abgegrenztes Erythem | 2 |
| Mäßiges bis ausgeprägtes Erythem | 3 |
| Ausgeprägtes Erythem (dunkelrot) bis hin zur Schortbildung, so dass eine Bewertung nicht möglich ist | 4 |
Höchstmögliche Punktzahl: 4
Bildung von Ödemen
| Kein Ödem | 0 |
| Sehr leichtes Ödem (kaum wahrnehmbar) | 1 |
| Leichtes Ödem (Ränder des betroffenen Areals durch deutliche Schwellung klar abgegrenzt) | 2 |
| Mäßiges Ödem (Schwellung etwa 1 mm) | 3 |
| Ausgeprägtes Ödem (Schwellung mehr als 1 mm und über den Expositionsbereich hinaus) | 4 |
Höchstmögliche Punktzahl: 4
Zur Klärung unklarer Reaktionen kann eine histopathologische Untersuchung erfolgen.
Anhang
Sequenzielle Prüfstrategie für Hautreizungen und -verätzungen
Allgemeine Überlegungen
Im Interesse wissenschaftlicher Verlässlichkeit und des Tierschutzes muss die unnötige Verwendung von Versuchstieren verhindert und die Durchführung von Versuchen, die bei den Tieren wahrscheinlich schwere Reaktionen hervorrufen, auf ein Mindestmaß beschränkt werden. Bevor ein In-vivo-Test ins Auge gefasst wird, sollen zunächst alle einschlägigen Informationen über die potenziell hautätzenden/-reizenden Wirkungen eines Stoffs bewertet werden. Möglicherweise liegen bereits genügend Kriterien für die Einstufung einer Prüfsubstanz anhand ihres Hautätzungs-/-reizungspotenzials vor, so dass sich Versuche an Labortieren erübrigen. Folglich schränkt die Durchführung einer kritischen Analyse bereits vorliegender Daten und die Anwendung einer sequenziellen Prüfstrategie die Notwendigkeit von In-vivo-Tests deutlich ein. Dies gilt umso mehr, wenn davon auszugehen ist, dass der Stoff schwere Reaktionen hervorruft.
Zur Beurteilung bereits vorhandener Informationen über die hautreizenden/-ätzenden Wirkungen von Substanzen soll das Instrument der Gewichtungsanalyse herangezogen werden. Ausgehend davon ist zu entscheiden, ob zusätzliche Studien, bei denen es sich nicht um In-vivo-Hautuntersuchungen handelt, als Beitrag zur Charakterisierung dieses Potenzials erfolgen sollen. Sofern weitere Studien durchgeführt werden müssen, empfiehlt es sich, zur Erzeugung der sachdienlichen Versuchsdaten die sequenzielle Prüfstrategie zu nutzen. Bei noch nicht geprüften Stoffen soll die sequenzielle Prüfstrategie herangezogen werden, um die Datensätze zu erzeugen, die für die Beurteilung des hautätzenden/-reizenden Potenzials benötigt werden. Die in diesem Anhang beschriebene Prüfstrategie wurde während eines OECD-Workshops (1) entwickelt Sie wurde im Rahmen des "Harmonised Integrated Hazard Classification System for Human Health arid Environmental Effects of Chemical Substances" bestätigt und weiter ausgebaut, das im November 1998 von den Teilnehmern der 28. Gemeinsamen Tagung des Chemikalien-Ausschusses und der Arbeitsgruppe Chemikalien gebilligt wurde (2).
Diese sequenzielle Prüfstrategie gehört zwar nicht zu den integralen Bestandteilen von Prüfmethode B.4, sie stellt aber den empfohlenen Ansatz zur Ermittlung von hautreizenden/-ätzenden Merkmalen dar. In diesem Ansatz spiegelt sich zum einen die beste Praxis wider. Zum anderen ist er ein ethischer Richtwert für In-vivo-Tests auf hautreizende/-ätzende Wirkungen. Die Prüfmethode bietet nicht nur eine Anleitung zur Durchführung des In-vivo-Tests, sondern auch eine Übersicht über die Faktoren, die vor der Durchführung eines solchen Versuchs überprüft werden sollen. Die Strategie liefert einen Ansatz für die Bewertung bereits vorhandener Daten über die hautreizenden/-ätzenden Eigenschaften von Prüfsubstanzen und einen stufenweisen Ansatz für die Erzeugung sachdienlicher Daten über Stoffe, die im Rahmen zusätzlicher Studien untersucht werden müssen bzw. noch gar nicht untersucht wurden. Zudem wird empfohlen, in bestimmten Fällen validierte und anerkannte In-vitro- und Ex-vivo-Tests auf hautreizende/-ätzende Wirkungen durchzuführen.
Beschreibung der Bewertungs- und Prüfstrategie
Vor der Durchführung von Versuchen im Rahmen der sequenziellen Prüfstrategie (Fließbild) sollen sämtliche vorhandenen Informationen ausgewertet werden, um die Notwendigkeit von In-vivo-Hauttests zu klären. Auch wenn wichtige Informationen aus der Beurteilung einzelner Parameter (z.B. extreme pH-Werte) gewonnen werden können, sollten die bereits vorliegenden Angaben in ihrer Gesamtheit betrachtet werden. Alle relevanten Daten über die Wirkungen des betreffenden Stoffs oder seiner Analoge sollen mit Hilfe einer Gewichtungsanalyse bewertet werden, und diese Entscheidung soll begründet werden. Dabei sollten bereits vorliegende Angaben zur Wirkung der Substanz auf Mensch und Tier im Vordergrund stehen, gefolgt von den Ergebnissen von In-vitro- und Ex-vivo-Tests. In-vivo-Studien mit hautätzenden Substanzen sollten nach Möglichkeit immer vermieden werden. Folgende Faktoren werden in der Prüfstrategie erörtert:
Beurteilung bereits vorliegender Angaben zur Wirkung der Substanz auf Mensch und Tier (Stufe 1). Zunächst sollen bereits vorhandene Informationen über die Wirkung auf den Menschen, z.B. klinische Studien oder Studien zur Exposition am Arbeitsplatz, sowie Fallberichte und/oder Ergebnisse von Tierversuchen, beispielsweise von Untersuchungen zur Toxizität nach einmaliger oder mehrmaliger Hautexposition, bewertet werden, denn sie liefern Hinweise, die unmittelbar die Hautwirkungen betreffen. Bei Stoffen mit bekannter hautätzender/-reizender Wirkung und Substanzen, die nachweislich weder Hautreizungen noch -verätzungen hervorrufen, brauchen keine In-vivo-Studien durchgeführt zu werden.
Analyse der Zusammenhänge zwischen Struktur und Aktivität (SAR) (Stufe 2). Die gegebenenfalls vorhandenen Ergebnisse von Untersuchungen an strukturell verwandten Substanzen sollen berücksichtigt werden. Liegen genügend Daten über das hautätzende/-reizende Potenzial von strukturell verwandten Substanzen oder Gemischen aus diesen Substanzen bei Mensch und/oder Tier vor, kann davon ausgegangen werden, dass die zu beurteilende Prüfsubstanz die gleichen Reaktionen hervorrufen wird. In diesen Fällen braucht die Prüfsubstanz möglicherweise nicht getestet zu werden. Für die Zwecke der sequenziellen Prüfstrategie reichen negative Daten aus Untersuchungen an strukturell verwandten Substanzen oder Gemischen als Nachweis für ein Nichtvorhandensein hautätzender/-reizender Wirkungen nicht aus. Zur Ermittlung des hautätzenden und -reizenden Potenzials sollen validierte und anerkannte SAR-Verfahren herangezogen werden
Physikalisch-chemische Eigenschaften und chemische Reaktivität (Stube 3). Stoffe mit extremen pH-Werten (< 2,0 bzw.> 11,5) können starke lokale Reaktionen induzieren. Gilt ein extremer pH-Wert als Anhaltspunkt für die ätzende Wirkung eines Stoffs, so kann dessen Potenzial zur Veränderung der Azidität/Alkalinität (bzw. das Pufferungsvermögen) ebenfalls berücksichtigt werden (3)(4). Lässt das Pufferungsvermögen darauf schließen, dass eine Substanz möglicherweise keine hautätzende Wirkung hat, sollen weitere Prüfungen zur Bestätigung dieser Vermutung durchgeführt worden. Dafür sollten wenn möglich validierte und anerkannte In-vitro- oder Ex-vivo-Tests genutzt werden (siehe Stufen 5 und 6).
Dermale Toxizität (Stufe 4). Hat sich ein chemischer Stoff als sehr giftig bei Hautkontakt erwiesen, ist eine In-vivo-Studie zur Hautreizung/-verätzung unter Umständen nicht angezeigt, weil bei Applikation der Prüfsubstanz in der üblichen Menge die sehr toxische Dosis überschritten wird, was letztlich dazu führt, dass die Tiere sterben oder ihnen schwere Leiden zugefügt werden. Wenn darüber hinaus bereits Studien zur dermalen Toxizität mit Dosierungen von bis zu 2000 mg/kg Körpergewicht oder darüber an Albino-Kaninchen durchgeführt wurden, ohne dass Hautreizungen oder -verätzungen feststellbar waren, sind zusätzliche Prüfungen auf hautreizende/-ätzende Wirkungen möglicherweise nicht vonnöten. In die Bewertung der akuten dermalen Toxizität anhand der Ergebnisse früherer Studien sollen mehrere Überlegungen einbezogen werden. So können die Angaben über Hautschädigungen unvollständig sein. Die Prüfungen und Beobachtungen können an anderen Tierarten erfolgt sein, und die Reaktionen der verschiedenen Arten weisen eventuell große Unterschiede auf. Überdies war die applizierte Prüfsubstanz für eine Bewertung der Hautreizung/-verätzung unter Umständen nicht geeignet (z.B. Verdünnung der Substanzen zur Untersuchung der dermalen Toxizität) (5). Wurden jedoch sorgfältig geplante Studien zur dermalen Toxizität an Kaninchen durchgeführt, die negative Ergebnisse erbrachten, reicht dies gegebenenfalls als Nachweis für das Nichtvorhandensein eines hautreizenden/-ätzenden Potenzials aus.
Ergebnisse von In vitro- und Ex-vivo-Tests (Stufen 5 und 6). Substanzen, deren ätzende oder schwer hautreizende Eigenschaften in validierten und anerkannten, auf die Ermittlung dieser bestimmten Wirkungen ausgerichteten In-vitro- oder Ex-vivo-Tests (6)(7) nachgewiesen wurden, brauchen nicht an Tieren geprüft zu werden. Man kann davon ausgehen, dass diese Substanzen in vivo vergleichbare schwere Wirkungen hervorrufen.
In-vivo-Tests an Kaninchen (Stufen 7 und 8). Beruht die Entscheidung, einen In-vivo-Test durchzuführen, auf einer Gewichtungsanalyse, sollte zunächst ein Vorversuch an nur einem Tier stattfinden. Es sollen keine weiteren Tests erfolgen, wenn der Vorversuch ergibt, dass die Substanz ätzend auf die Haut wirkt. Liefert der Vorversuch keine Anhaltspunkte für eine ätzende Wirkung, soll die reizende oder negative Reaktion durch Tests an bis zu zwei weiteren Tieren bei einer Expositionsdauer von vier Stunden bestätigt werden. Wenn im Vorversuch eine hautreizende Wirkung beobachtet wird, kann der Bestätigungstest entweder sequenziell oder durch gleichzeitige Exposition von zwei weiteren Tieren erfolgen.
Literaturhinweise
(1) OECD (1996). Test Guidelines Programme: Final Report an the OECD Workshop an Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods. Solna, Schweden, 22.-24. Januar 1996 (http://wwwl.oecd.org/ehs/tests/background.htm).
(2) OECD (1998). Harmonized Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances, bestätigt auf der 28. Gemeinsamen Tagung des Chemikalien-Ausschusses und der Arbeitsgruppe Chemikalien, November 1998 (http://wwwl.oecd.org/ehs/Class/HCL6.htm).
(3) Worth, A.P., Fentem, J.H., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Esdaile, D.J., Liebsch, M. (1998). An Evaluation of the Proposed OECD Testing Strategy for Skin Corrosion. ATLa 26, 709-720.
(4) Young, J.R., How, M.J., Walker, A.P., Worth, W.M.H. (1988). Classification as Corrosive or Irritant to Skin of Preparations Containing Acidic or Alkaline Substances, Without Testing an Animals. Toxic In Vitro, 2 (1) S. 19-26.
(5) Patil, S.M., Patrick, E., Maibach, H.I. (1996) Animal, Human, and In Vitro Test Methods for Predicting Skin Irritation, in: Francis N. Marzulli und Howard I. Maibach (Herausgeber): Dermatotoxicology. 5. Auflage, ISBN 1-56032-356-6, Kapitel 31, 411-436.
(6) Prüfmethode B.40.
(7) Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Esdaile, D.J., Holzhutter, H.G., und Liebsch, M. (1998) The ECVAM international validation study an in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxicology in Vitro 12, S. 483 - 524.
Fliessbild Prüf- und Bewertungsstrategie: Hautreizung/-Verätzung
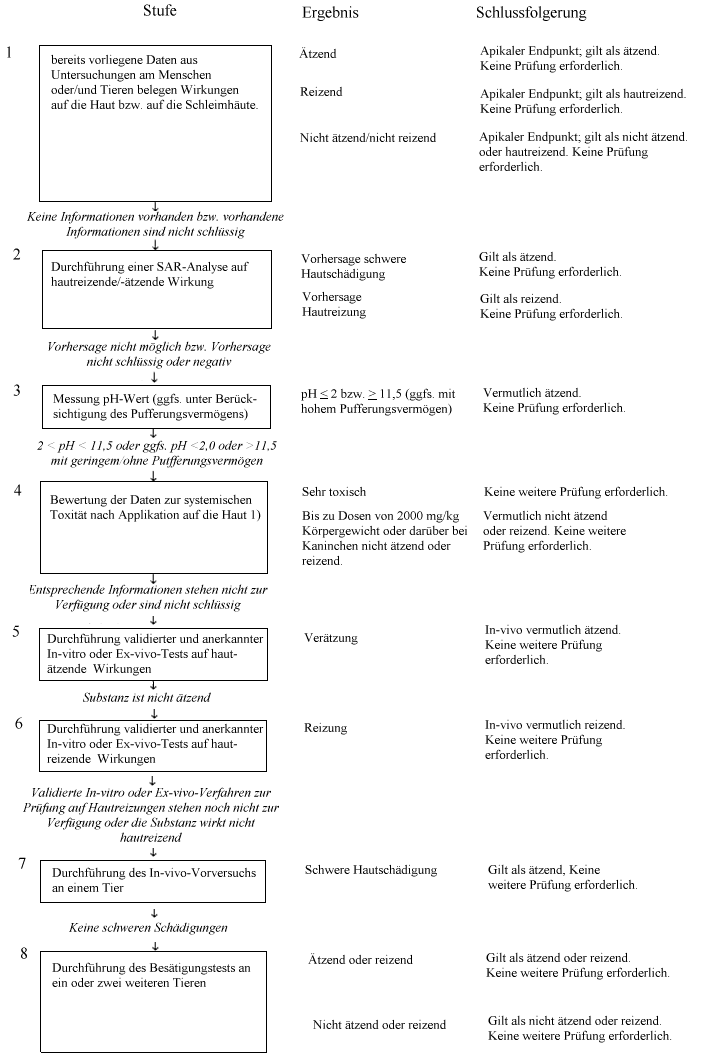
(1) Kann vor den Stufen 2 und 3 erfolgen.
 |
weiter . |  |
(Stand: 04.08.2022)
Alle vollständigen Texte in der aktuellen Fassung im Jahresabonnement
Nutzungsgebühr: ab 105.- € netto
(derzeit ca. 7200 Titel s.Übersicht - keine Unterteilung in Fachbereiche)
Die Zugangskennung wird kurzfristig übermittelt
? Fragen ?
Abonnentenzugang/Volltextversion