

 |
zurück |  |
| Bestimmung der Ökotoxizität C.15. Fische, kurzfristige Toxizitätsprüfung an Embryonen und Jungfischen mit Dottersack Stand RL 2001/59/EG |
Anhang V zur RL 67/548/EWG |
C.15. 1. Methode
Diese Methode zur kurzfristigen Toxizitätsprüfung entspricht der OECD TG 212 (1998).
C.15. 1.1. Einleitung
Diese kurzfristige Toxizitätsprüfung an Fischembryonen und Jungfischen mit Dottersack stellt eine kurzfristige Prüfung dar, bei der die Entwicklungsstadien vom frisch befruchteten Ei bis zum Ende des Dottersackstadiums exponiert werden. Bei der Prüfung an Fischembryonen und Jungfischen mit Dottersack erfolgt keine Fütterung, daher sollte die Prüfung abgeschlossen sein, solange sich die Larven noch aus dem Dottersack ernähren.
Die Prüfung soll zur Ermittlung der letalen und - in gewissem Umfang - auch der subletalen Auswirkungen von Chemikalien auf die spezifischen Entwicklungsstadien und geprüften Fischarten dienen. Sie soll insofern nützliche Informationen liefern, als sie a) eine Brücke zwischen letalen und subletalen Prüfungen schlagen, b) als Screening-Test für eine Durchführung des vollständigen Early Life-Stage Tests oder für einen chronischen Toxizitätstest verwendet und c) für die Prüfung von Fischarten herangezogen werden könnte, bei denen die Zuchtverfahren noch nicht hinreichend weit entwickelt sind, um die Zeit der Umstellung von der endogenen auf die exogene Fütterung abzudecken.
Nicht vergessen werden sollte, dass nur Prüfungen, die alle Entwicklungsstadien von Fischen umfassen, im Allgemeinen eine korrekte Schätzung der chronischen Toxizität von Chemikalien für Fische ermöglichen und dass eine verkürzte Exposition in bezug auf Entwicklungsstadien unter Umständen zu einer Herabsetzung der Empfindlichkeit und damit zu einer Unterschätzung der chronischen Toxizität führen kann. Es wird daher erwartet, dass die Empfindlichkeit bei der Prüfung an Fischembryonen und Jungfischen mit Dottersack geringer als in einer vollständigen Prüfung des frühen Entwicklungsstadiums ist, insbesondere bei Chemikalien mit einer hohen Lipophilizität (log Pow > 4) und Chemikalien mit einer spezifischen toxischen Wirkungsweise. Kleinere Unterschiede in der Empfindlichkeit zwischen zwei Tests dürften allerdings bei Chemikalien mit einer unspezifischen narkotischen Wirkungsweise (1) zu erwarten sein.
Vor der Veröffentlichung dieser Prüfung lagen die meisten Erfahrungen mit Fischembryonen und Dottersackjungfischen des Süßwasserfischs Danio rerio Hamilton-Buchanan (Teleostei, Cyprinidae - allgemeinsprachlicher Name: Zebrabärbling) vor. Detailliertere Angaben zur Versuchsdurchführung bei dieser Fischart finden sich daher in Anlage 1. Dadurch wird die Verwendung von anderen Fischarten, mit denen ebenfalls Erfahrungen vorliegen (Tabellen 1a und 1B), nicht ausgeschlossen.
C.15. 1.2. Definitionen
Lowest Observed Effect Concentration (LOEC): Dies ist die niedrigste geprüfte Konzentration einer Prüfsubstanz, bei der sich im Vergleich zu der Kontrolle eine signifikante Wirkung beobachten lässt (bei p < 0,05). Alle Prüfkonzentrationen oberhalb der LOEC müssen jedoch eine schädigende Wirkung haben, die gleich den bei der LOEC beobachteten Wirkungen oder größer als diese ist.
No Observed Effect Concentration (NOEC): Dies ist die Prüfkonzentration unmittelbar unterhalb der LOEC.
C.15. 1.3. Prinzip der Methode
Die Fischembryonen und Jungfische mit Dottersack werden einem Bereich von Konzentrationen der in Wasser gelösten Prüfsubstanz ausgesetzt. Im Rahmen des Protokolls kann zwischen einem semistatischen und einem Durchflussverfahren gewählt werden. Die Entscheidung über das Verfahren hängt dabei von der Art der Prüfsubstanz ab. Die Prüfung beginnt damit, dass befruchtete Eier in die Prüfkammern gesetzt werden, und sie endet kurz bevor der Dottersack von Larven in einer der Prüfkammern vollständig aufgezehrt ist beziehungsweise bevor die Tiere in den Kontrollen zu verhungern anfangen. Letale und subletale Auswirkungen werden bewertet und mit Kontrollwerten zur Bestimmung der niedrigsten beobachteten Wirkkonzentration (LOEC) und damit auch der höchsten Konzentration ohne Wirkung (NOEC) verglichen. Alternativ können sie auch mit Hilfe eines Regressionsmodells analysiert werden, um die Konzentrationen zu schätzen, die zu einer Wirkung mit einem bestimmten prozentualen Anteil führen würden (d. h., LC/ECx, wobei x für den prozentualen Anteil, der von der Wirkung betroffen ist, steht).
C.15. 1.4. Informationen über die Prüfsubstanz
Ergebnisse einer akuten Toxizitätsprüfung (siehe Methode C.1), die möglichst an der für diese Prüfung gewählten Fischart durchgeführt wurde, sollten zur Verfügung stehen. Die Ergebnisse können bei der Auswahl eines geeigneten Bereichs an Prüfkonzentrationen bei der Prüfung in den frühen Entwicklungsstadien hilfreich sein. Die Wasserlöslichkeit (einschließlich Löslichkeit im Prüfwasser) und der Dampfdruck der Prüfsubstanz sollten bekannt sein. Ein zuverlässiges analytisches Verfahren für die Quantifizierung der Substanz in den Prüflösungen mit bekannter und protokollierter Genauigkeit und Nachweisgrenze sollte verfügbar sein.
Zu den Informationen über die Prüfsubstanz, die bei der Festlegung der Prüfbedingungen von Nutzen sein können, gehören die Strukturformel, die Reinheit der Substanz, die Lichtstabilität, die Stabilität unter den Versuchsbedingungen, pKa, Pow und die Ergebnisse einer Prüfung zur leichten biologischen Abbaubarkeit (siehe Methode C.4).
C.15. 1.5. Validitätskriterien
Damit die Validität einer Prüfung gegeben ist, gelten die folgenden Bedingungen:
C.15. 1.6. Beschreibung der Methode
C.15. 1.6.1. Prüfkammern
Verwendet werden können beliebige Gefäße aus Glas oder einem anderen chemisch inerten Werkstoff. Die Abmessungen der Gefäße sollten der Besatzrate entsprechend groß genug sein (siehe 1.7.1.2). Es wird empfohlen, die Prüfkammern nach dem Zufallsprinzip in dem Prüfbereich anzuordnen. Einem randomisierten Blockkonzept, bei dem jede Behandlung in jedem Block vorhanden ist, ist der Vorzug vor einem vollständig randomisierten Konzept zu geben, wenn systemische Wirkungen in der Prüfeinrichtung vorhanden sind, die durch die Blockbildung kontrolliert werden können. Der Blockbildung sollte, sofern sie zum Tragen kommt, bei der anschließenden Datenauswertung Rechnung getragen werden. Die Prüfkammern sind vor ungewollten Störungen zu schützen.
C.15. 1.6.2. Auswahl der Fischarten
Empfohlene Fischarten werden in Tabelle 1a genannt. Dies schließt die Verwendung anderer Fischarten (Beispiele hierzu finden sich in Tabelle 1B) zwar nicht aus, doch ist das Prüfverfahren unter Umständen anzupassen, um geeignete Prüfbedingungen zu schaffen. In diesem Fall sollten die Beweggründe für die Auswahl der Fischart und das Versuchsverfahren protokolliert werden.
C.15. 1.6.3. Haltung der Zuchtfische
Nähere Angaben, wie man die Zuchtfische unter zufriedenstellenden Bedingungen hält, lassen sich in der OECD TG 2101) und in den Literaturhinweisen (2)(3)(4)(5)(6) finden.
C.15. 1.6.4. Handhabung von Embryonen und Larven
Embryonen und Larven können innerhalb des Hauptgefäßes in kleineren Behältern exponiert werden, die mit Siebseiten oder -enden versehen sind, damit die Prüflösung durch das Gefäß hindurchfließen kann. Einen wirbelfreien Durchfluss durch diese kleinen Gefäße kann man dadurch herbeiführen, dass man diese an einen Arm aufhängt, der das Gefäß auf- und abbewegt, dabei jedoch die Organismen immer mit der Prüflösung bedeckt hält; ebenfalls verwendet werden kann ein Siphonspülsystem. Befruchtete Eier von Salmonidfischen können auf Einschüben oder Gittern gehältert werden, deren Öffnungen groß genug sind, so dass die Larven nach dem Schlüpfen hindurchfallen können. Pasteurpipetten eignen sich, um die Embryonen und Larven in den semistatischen Prüfungen mit vollständigem täglichem Wechsel des Prüfmediums zu entfernen (siehe 1.6.6).
Werden Eierbehälter, Gitter oder Siebe verwendet, um die Eier innerhalb des Hauptprüfgefäßes zu halten, sollten diese Rückhaltevorrichtungen nach dem Schlüpfen der Larven entfernt werden (1); Siebe sollten nur bleiben, um die Fische an der Flucht zu hindern. Sofern die Larven umgesetzt werden müssen, sollten sie nicht der Luft ausgesetzt werden, und es sollten keine Netze verwendet werden, um Fische aus Eierbehältern herauszuholen (derartige Vorsicht ist bei weniger anfälligen Arten wie beispielsweise Karpfen gegebenenfalls nicht erforderlich). Der Zeitpunkt für diese Umsetzung ist von Art zu Art unterschiedlich, und ein Umsetzen ist auch nicht immer erforderlich. Für das semistatische Verfahren können Bechergläser oder flache Behälter verwendet werden, die bei Bedarf mit einem leicht über dem Boden des Becherglases erhöhten Sieb versehen sind. Ist das Fassungsvermögen dieser Behälter für die Besatzanforderungen (siehe 1.7.1.2) ausreichend, brauchen die Embryonen oder Larven gegebenenfalls nicht umgesetzt zu werden.
C.15. 1.6.5. Wasser
Jedes Wasser, das die chemischen Eigenschaften eines annehmbaren Verdünnungswassers entsprechend der Auflistung in Anlage 4 erfüllt und bei dem die zu prüfende Fischart eine Kontrollüberlebensrate aufweist, die zumindest so gut wie in den Anlagen 2 und 3 beschrieben ist, kommt als Prüfwasser in Frage. Das Wasser sollte während des Prüfzeitraums von gleichbleibender Qualität sein. Der pH-Wert sollte in einem Bereich von ± 0,5 pH-Einheiten bleiben. Um sicherzustellen, dass das Verdünnungswasser das Prüfergebnis nicht übermäßig beeinflusst (beispielsweise durch Komplexbildung mit der Prüfsubstanz) oder sich nachteilig auf die Leistung des Zuchtbestands auswirkt, sollten in Abständen Proben zur Analyse entnommen werden. Messungen von Schwermetallen (z.B. Cu, Pb, Zn, Hg, Cd und Ni), größeren Anionen und Kationen (z.B. Ca, Mg, Na, K, Cl und SO4 ), Pestiziden (z.B. gesamte phosphororganische und gesamte chlororganische Pestizide), des gesamten organischen Kohlenstoffs (TOC) und der Schwebstoffe sollten beispielsweise alle drei Monate ermittelt werden, wenn bekanntermaßen ein Verdünnungswasser von relativ gleichbleibender Qualität vorliegt. Hat sich die Wasserqualität über einen Zeitraum von mindestens einem Jahr als relativ konstant erwiesen, können Bestimmungen seltener durchgeführt und die Abstände verlängert werden (z.B. alle sechs Monate).
C.15. 1.6.6. Prüflösungen
Prüflösungen der gewählten Konzentrationen werden durch Verdünnung eines Stammansatzes hergestellt.
Der Stammansatz sollte möglichst durch einfaches Mischen oder Hin- und Herbewegen der Prüfsubstanz in dem Verdünnungswasser auf mechanischem Wege hergestellt werden (z.B. Rühren und Ultraschalldispersion).
Sättigungskolonnen (Löslichkeitskolonnen) können verwendet werden, um einen Stammansatz von geeigneter Konzentration zu erzielen. Soweit möglich, sollte der Einsatz von Löse- oder Dispersionsmitteln (Lösungsmittel) vermieden werden; allerdings können derartige Verbindungen in einigen Fällen erforderlich sein, um einen Stammansatz von geeigneter Konzentration herzustellen. Beispiele für geeignete Lösemittel sind Aceton, Ethanol, Methanol, Dimethylformamid und Triethylenglycol. Beispiele für geeignete Dispersionsmittel sind Cremophor RH40, Tween 80, Methylcellulose 0,01 % und HCO-40. Vorsicht ist bei leicht biologisch abbaubaren (z.B. Aceton) und/oder hochflüchtigen Stoffen geboten, da diese Probleme mit einer Anreicherung von Bakterien in Durchflussprüfungen bereiten können. Wird ein Löslichkeitshilfsmittel verwendet, darf dieses weder eine signifikante Auswirkung auf das Überleben noch erkennbare negative Auswirkungen auf frühe Entwicklungsphasen haben, was durch eine Kontrolle, bei der nur das Lösemittel verwendet wird, nachgewiesen wird. Es sollten jedoch alle Anstrengungen unternommen werden, um den Einsatz derartiger Stoffe zu vermeiden.
Bei dem semistatischen Verfahren können zwei verschiedene Verfahren zur Erneuerung des Prüfmediums eingesetzt werden; entweder i) werden neue Prüflösungen in sauberen Gefäßen hergestellt und überlebende Eier und Larven vorsichtig zusammen mit einer kleinen Menge der alten Lösung in die neuen Behälter umgesetzt, wobei eine Exposition gegenüber Luft vermieden wird, oder ii) die Prüforganismen bleiben in den Gefäßen, während ein Teil (mindestens drei Viertel) des Prüfwassers ausgetauscht wird. Die Häufigkeit der Erneuerung des Prüfmediums hängt zwar von der Stabilität der Prüfsubstanz ab, jedoch wird ein täglicher Austausch des Wassers empfohlen. Wenn aus vorausgehenden Stabilitätsprüfungen (siehe 1.4) bekannt ist, dass die Konzentration der Prüfsubstanz während des Zeitraums, in dem das Prüfmedium gewechselt wird, nicht stabil ist (d. h., außerhalb des Bereichs von 80 bis 120 % der nominalen Konzentration oder Unterschreitung von 80 % der gemessenen anfänglichen Konzentration), sollte der Einsatz einer Durchflussprüfung in Erwägung gezogen werden. In jedem Fall sollte darauf geachtet werden, dass während des Wasserwechsels Stress für die Larven vermieden wird.
Bei Durchflussprüfungen ist ein System erforderlich, das einen Stammansatz der Prüfsubstanz kontinuierlich abgibt und verdünnt (z.B. Dosierpumpe, Proportionalverdünnungsvorrichtung, Sättigersystem), um den Prüfkammern eine Reihe von Konzentrationen zuzuführen. Die Durchsatzraten der Stammansätze und des Verdünnungswassers sollten in Abständen, möglichst einmal pro Tag, überprüft werden und während der gesamten Prüfung um nicht mehr als 10 % schwanken. Eine Durchsatzrate, die zumindest dem fünffachen Kammervolumen in 24 Stunden entspricht, hat sich als geeignet erwiesen (2).
C.15. 1.7. Vorgehensweise
Nützliche Informationen über die Durchführung von Toxizitätsprüfungen an Fischembryonen und Jungtieren mit Dottersack finden sich in der Fachliteratur, einige Beispiele hierfür sind im Abschnitt Literaturhinweise dieses Texts enthalten (7) (8) (9).
C.15. 1.7.1. Expositionsbedingungen
C.15. 1.7.1.1. Dauer
Die Prüfung sollte möglichst innerhalb von 30 Minuten nach der Befruchtung der Eier beginnen. Die Embryonen werden vor oder so bald wie möglich nach Beginn des Stadiums der Blastulascheiben-Spaltung und auf jeden Fall vor Einsetzen des Gastrula-Stadiums in die Prüflösung eingetaucht. Bei Eiern von kommerziellen Lieferanten ist es unter Umständen nicht möglich, die Prüfung unmittelbar nach der Befruchtung zu beginnen. Da die Empfindlichkeit der Prüfung durch einen verzögerten Prüfbeginn gravierend beeinflusst werden kann, sollte die Prüfung innerhalb von 8 Stunden nach der Befruchtung eingeleitet werden. Da die Larven während des Expositionszeitraums nicht gefüttert werden, sollte die Prüfung kurz bevor der Dottersack von Larven in einer der Prüfkammern vollständig aufgezehrt ist beziehungsweise bevor in den Kontrollen Tiere zu verhungern anfangen, beendet sein. Die Dauer hängt dabei von der verwendeten Art ab. Einige Empfehlungen zur Dauer finden sich in den Anlagen 2 und 3.
C.15. 1.7.1.2. Besatz
Die Anzahl an befruchteten Eiern bei Beginn der Prüfung sollte zur Erfüllung von statistischen Anforderungen hinreichend groß sein. Die Eier sollten nach dem Zufallsprinzip auf die Behandlungen verteilt werden, und mindestens 30 befruchtete Eier sollten, zu gleichen Teilen (oder so gleich wie möglich, da es bei Einsatz von einigen Arten schwierig sein kann, gleiche Chargen zu bekommen) auf mindestens drei parallele Prüfkammern aufgeteilt, je Konzentration verwendet werden. Die Besatzrate (Biomasse je Volumen an Prüflösung) sollte gering genug sein, so daß eine Konzentration an gelöstem Sauerstoff von mindestens 60 % des Luftsauerstoff-Sättigungswerts ohne Belüftung aufrechterhalten werden kann. Bei Durchflussprüfungen wurde eine Besatzrate von nicht mehr als 0,5 g/l je 24 Stunden und nicht mehr als 5 g/l Lösung zu jeder Zeit empfohlen (2).
C.15. 1.7.1.3. Licht und Temperatur
Die Belichtungsdauer und die Prüfwassertemperatur sollten für die geprüfte Fischart angemessen sein (Anlagen 2 und 3). Zur Überwachung der Temperatur kann die Verwendung eines weiteren Prüfgefäßes angebracht sein.
C.15. 1.7.2. Prüfkonzentrationen
Im Normalfall sind fünf Konzentrationen der Prüfsubstanz, die sich durch einen konstanten Faktor von nicht mehr als 3,2 voneinander unterscheiden, erforderlich. Die Kurve, in der die LC50 gegen den Expositionszeitraum in der akuten Prüfung aufgetragen ist, sollte bei der Auswahl des Bereichs an Prüfkonzentrationen berücksichtigt werden. Die Verwendung von weniger als fünf Konzentrationen, beispielsweise in Limit-Tests, und ein engerer Konzentrationsbereich können unter gewissen Umständen angebracht sein. Werden weniger als fünf Konzentrationen verwendet, sollte dies begründet werden. Konzentrationen der Substanz, die höher als die LC50 über 96 Stunden beziehungsweise 100 mg/l sind, je nachdem, welcher Wert der niedrigere ist, brauchen nicht geprüft zu werden. Substanzen sollten nicht oberhalb ihrer Löslichkeitsgrenze im Prüfwasser geprüft werden.
Wird ein Lösungsmittel bei der Herstellung der Prüflösungen verwendet (siehe 1.6.6), sollte dessen Endkonzentration in den Prüfgefäßen nicht mehr als 0,1 ml/l betragen und in allen Prüfgefäßen gleich sein.
C.15. 1.7.3. Kontrollen
Eine Kontrolle mit Verdünnungswasser (mit der entsprechenden Anzahl von Wiederholungen) und ebenfalls, soweit relevant, eine Kontrolle mit dem Lösungsmittel (mit der entsprechenden Anzahl von Wiederholungen) sollten zusätzlich zu der Testreihe durchgeführt werden.
C.15. 1.7.4. Häufigkeit von analytischen Bestimmungen und Messungen
Während der Prüfung werden die Konzentrationen der Prüfsubstanz in regelmäßigen Abständen bestimmt.
Bei semistatischen Prüfungen, bei denen erwartet wird, daß die Konzentration der Prüfsubstanz innerhalb von ± 20 % der Nominalkonzentration konstant bleibt (d. h. innerhalb des Bereichs von 80 bis 120 %; siehe 1.4 und 1.6.6), wird empfohlen, dass zumindest die höchste und die niedrigste Prüfkonzentration analysiert werden, wenn diese frisch hergestellt ist und unmittelbar vor dem Austausch, und zwar zu mindestens drei gleichmäßig über die Prüfung verteilten Zeitpunkten sind (d. h., Analysen sollten anhand einer Probe derselben Lösung erfolgen - wenn diese frisch hergestellt ist und beim Austausch).
Bei Prüfungen, bei denen nicht damit zu rechnen ist, dass die Konzentration der Prüfsubstanz innerhalb von ± 20 % der Nominalkonzentration (d. h., der Grundlage von Stabilitätsdaten der Substanz) konstant bleibt, ist es notwendig, alle Prüfkonzentrationen, frisch hergestellt und beim Austausch, zu analysieren, jedoch unter gleichen Verhältnissen (d. h. bei mindestens drei Gelegenheiten, die gleichmäßig über die Prüfung verteilt sind).
Die Bestimmung von Konzentrationen der Prüfsubstanz vor dem Austausch braucht nur an einem Wiederholungsgefäß bei jeder Prüfkonzentration durchgeführt zu werden. Konzentrationen sollten im Abstand von nicht mehr als sieben Tagen bestimmt werden. Es wird empfohlen, dass Ergebnisse dabei auf gemessenen Konzentrationen basieren. Kann jedoch nachgewiesen werden, dass die Konzentration der Prüfsubstanz während der gesamten Prüfung zufriedenstellend innerhalb von ± 20 % der nominalen Konzentration oder gemessenen Anfangskonzentration gehalten wurde, dann können Ergebnisse auf nominalen oder gemessenen Anfangswerten basieren.
Bei Durchflussprüfungen ist ein ähnliches Probenahmeverfahren, wie für semistatische Prüfungen beschrieben, angebracht (die Messung der "alten" Lösungen gilt in diesem Falle jedoch nicht). Dauert die Prüfung allerdings länger als sieben Tage, ist es unter Umständen ratsam, die Anzahl an Probenahmen in der ersten Woche zu erhöhen (d. h. drei Messreihen), um sicherzugehen, dass die Prüfkonzentrationen stabil bleiben.
Proben müssen gegebenenfalls zentrifugiert oder gefiltert werden (z.B. mit einer Porengröße von 0,45 µm). Da jedoch weder die Zentrifugation noch die Filtration stets den nichtbioverfügbaren Teil der Prüfsubstanz von dem bioverfügbaren Teil trennt, brauchen die Proben diesen Behandlungen nicht unterzogen zu werden.
Während der Prüfung sollten in allen Prüfgefäßen der gelöste Sauerstoff, der pH-Wert und die Temperatur gemessen werden. Die Gesamthärte und der Salzgehalt (soweit relevant) sollten in den Kontrollen und einem Gefäß mit der höchsten Konzentration gemessen werden. Der gelöste Sauerstoff und der Salzgehalt (soweit relevant) sollten mindestens dreimal (zu Beginn, in der Mitte und am Ende der Prüfung) gemessen werden. Bei semistatischen Prüfungen wird empfohlen, den gelösten Sauerstoff häufiger zu messen, möglichst vor und nach jedem Wasseraustausch, oder zumindest einmal pro Woche. Der pH-Wert sollte zu Beginn und am Ende eines jeden Wasserwechsels bei semistatischen Prüfungen und mindestens einmal pro Woche bei Durchflussprüfungen gemessen werden. Die Härte sollte jeweils einmal pro Prüfung gemessen werden. Die Temperatur sollte einmal pro Tag gemessen und zumindest in einem Prüfgefäß kontinuierlich überwacht werden.
C.15. 1.7.5. Beobachtungen
C.15. 1.7.5.1. Stadium der Embryonalentwicklung
Das Embryonalstadium (d. h. Gastrula-Stadium) zu Beginn der Exposition gegenüber der Prüfsubstanz sollte so genau wie möglich überprüft werden. Dies kann mit Hilfe einer repräsentativen Probe von Eiern, die in geeigneter Form aufbewahrt und gereinigt wurden, erfolgen. Zur Beschreibung und Darstellung von Embryonalstadien kann auch die Fachliteratur herangezogen werden (2)(5)(10)(11).
C.15. 1.7.5.2. Schlüpfen und Überleben
Beobachtungen zum Schlüpfen und Überleben sollten zumindest einmal pro Tag erfolgen, und die jeweiligen Zahlen sollten protokolliert werden. Zu Beginn der Prüfung können häufigere Beobachtungen (z.B. alle 30 Minuten in den ersten drei Stunden) wünschenswert sein, da in einigen Fällen Überlebenszeiten aussagefähiger sein können als nur die Anzahl von Todesfällen (z.B. bei akuten toxischen Wirkungen). Sobald tote Embryonen und Larven festgestellt werden, sollten diese unmittelbar entfernt werden, da sie sich rasch zersetzen können. Äußerste Sorgfalt sollte bei der Entfernung von einzelnen toten Individuen aufgewendet werden, um benachbarte Eier/Larven nicht zu stoßen oder körperlich zu beschädigen, da diese äußerst zart und empfindlich sind. Je nach Entwicklungsstadium gelten unterschiedliche Kriterien zur Bestimmung des Todes:
C.15. 1.7.5.3. Abnormes Aussehen
Die Anzahl der Larven, die eine abnorme Körperform und/oder Pigmentierung aufweisen, und das Stadium der Dottersackaufzehrung sollten in angemessenen Abständen in Abhängigkeit der Dauer der Prüfung und der Art der beschriebenen Abnormität protokolliert werden. Zu beachten ist, dass abnorme Embryonen und Larven auch von Natur aus auftreten und bei einigen Arten in der Größenordnung von mehreren Prozent bei der/den Kontrolle(n) liegen können. Abnorme Tiere sollten aus den Prüfgefäßen nur dann entfernt werden, wenn sie tot sind.
C.15. 1.7.5.4. Abnormes Verhalten
Abnormitäten, z.B. Hyperventilation, unkoordiniertes Schwimmen und atypische Ruhe, sollten in angemessenen Abständen in Abhängigkeit der Dauer der Prüfung protokolliert werden. Auch wenn sich diese Auswirkungen nur schwer quantifizieren lassen, können sie, sofern sie beobachtet werden, bei der Interpretation von Mortalitätsdaten helfen, d. h., Informationen über die toxische Wirkungsweise der Substanz liefern.
C.15. 1.7.5.5. Länge
Am Ende der Prüfung wird eine Messung der Einzellängen empfohlen; dabei kann die Standard-, die Gabelungs- oder die Gesamtlänge verwendet werden. Kommt es jedoch zu Schwanzflossenfäule oder Flossenerosion, sollten Standardlängen herangezogen werden. Im allgemeinen sollte in einer ordentlich durchgeführten Prüfung der Variationskoeffizient für die Länge unter den Wiederholungen in den Kontrollen 20 % sein.
C.15. 1.7.5.6. Gewicht
Am Ende der Prüfung können die einzelnen Gewichte bestimmt werden; dabei sollten möglichst Trockengewichte (24 Stunden bei 60 °C) vor Nassgewichten (trocken getupft) gemessen werden. Im allgemeinen sollte in einer ordentlich durchgeführten Prüfung der Variationskoeffizient für das Gewicht unter den Wiederholungen in den Kontrollen< 20 % sein.
Diese Beobachtungen führen zu einigen oder allen der folgenden Daten, die zur statistischen Auswertung zur Verfügung stehen:
C.15. 2. Daten und Berichterstattung
C.15. 2.1. Auswertung der Ergebnisse
Es wird empfohlen, einen Statistiker sowohl an der Auslegung als auch an der Auswertung der Prüfung zu beteiligen, da die Methode eine beträchtliche Bandbreite im Versuchskonzept zulässt, beispielsweise bei der Anzahl an Prüfkammern, der Anzahl an Prüfkonzentrationen, der Ausgangszahl an befruchteten Eiern und der gemessenen Parameter. In Anbetracht der für die Auslegung der Prüfung zur Verfügung stehenden Möglichkeiten wird an dieser Stelle keine konkrete Orientierung zu den statistischen Verfahren gegeben.
Sind LOEC/NOEC-Werte zu bestimmen, wird die Notwendigkeit bestehen, Streuungen innerhalb jeder Wiederholungsreihe durch eine Varianzanalyse (ANOVA) oder Kontingenztabellenverfahren zu analysieren. Für einen Mehrfachvergleich zwischen den Ergebnissen bei den einzelnen Konzentrationen und den Ergebnissen der Kontrollen ist möglicherweise die Dunnetsche Methode von Nutzen (12) (13). Weitere hilfreiche Beispiele sind ebenfalls verfügbar (14) (15). Der Umfang der Wirkung, der mit ANOVa oder anderen Verfahren nachweisbar ist (d. h. die Aussagefähigkeit der Prüfung) sollte berechnet und protokolliert werden. Zu beachten ist, dass sich nicht alle in Abschnitt 1.7.5.6 aufgeführten Beobachtungen für eine statistische Auswertung mittels einer ANOVa eignen. Die kumulative Mortalität und die Anzahl an gesunden Larven am Ende der Prüfung könnten beispielsweise mit Hilfe von Probit-Methoden analysiert werden.
Sind LC/EC x -Werte zu bestimmen, sollte(n) (eine) geeignete Kurve(n) wie beispielsweise die logistische Kurve an die Daten von Interesse mittels eines statistischen Verfahrens wie der Methode der kleinsten Quadrate oder der nichtlinearen kleinsten Quadrate angepasst werden. Die Kurve(n) sollte(n) so parametriert werden, dass die LC/ECx von Interesse und deren Standardfehler direkt abgeschätzt werden können. Dies wird die Berechnung des Vertrauensbereichs rund um die LC/ECx deutlich erleichtern. Soweit keine guten Gründe dafür vorliegen, anderen Vertrauensbereichen den Vorzug zu geben, sollte der zweiseitige 95 % Vertrauensbereich angegeben werden. Das Anpassungsverfahren sollte möglichst einen Weg bieten, um die Signifikanz der mangelnden Anpassung zu bewerten. Für die Anpassung von Kurven können graphische Methoden eingesetzt werden. Für alle in Abschnitt 1.7.5.6 aufgeführten Beobachtungen kommt eine Regressionsanalyse in Frage.
C.15. 2.2. Interpretation der Ergebnisse
Die Ergebnisse sollten mit Vorsicht interpretiert werden, wenn gemessene toxische Konzentrationen in Prüflösungen in der Nähe der Nachweisgrenze des analytischen Verfahrens liegen. Die Interpretation von Ergebnissen für Konzentrationen oberhalb der Wasserlöslichkeit der Substanz sollte ebenfalls mit Vorsicht erfolgen.
C.15. 2.3. Abschlussbericht
Der Prüfbericht muss die folgenden Angaben enthalten:
C.15. 2.3.1. Prüfsubstanz
C.15. 2.3.2. Geprüfte Fischart
C.15. 2.3.3. Prüfbedingungen
C.15. 2.3.4. Ergebnisse
C.15. 3. Literaturhinweise
(1) Kristensen P. (1990) Evaluation of the Sensitivity of Short Term Fish Early Life Stage Tests in Relation to other FELS Test Methods. Final report to the Commission of the European Communities, 60 pp. June 1990.
(2) ASTM (1988). Standard Guide for Conducting Early Life-Stage Toxicity Tests with Fishes. American Society for Testing and Materials. E 1241-88. 26 pp.
(3) Brauhn J. L. and Schoettger R. A. (1975). Acquisition and Culture of Research Fish: Rainbow trout, Fathead minnows, Channel Catfish and Bluegills. p. 54, Ecological Research Series, EPA-660/3-75-011, Duluth, Minnesota.
(4) Brungs W. A. and Jones B. R. (1977). Temperature Criteria for Freshwater Fish: Protocol and Procedures. p. 128, Ecological Research Series EPA-600/3-77-061, Duluth, Minnesota.
(5) Laale H. W. (1977). The Biology and Use of the Zebrafish (Brachydanio rerio) in Fisheries Research. a Literature Review. J. Biol. 10, pp. 121-173.
(6) Legault R. (1958). a Technique for Controlling the Time of Daily Spawning and Collecting Eggs of the Zebrafish, Brachydanio rerio (Hamilton-Buchanan) Copeia, 4, pp. 328-330.
(7) Dave G., Damgaard B., Grande M., Martelin J. E., Rosander B. and Viktor T. (1987). Ring Test of an Embryo-larval Toxicity Test with Zebrafish (Brachydanio rerio) Using Chromium and Zinc as Toxicants. Environmental Toxicology and Chemistry, 6, pp. 61-71.
(8) Birge J. W., Black J. A. and Westerman A. G. (1985). Short-term Fish and Amphibian Embryo-larval Tests for Determining the Effects of Toxicant Stress on Early Life Stages and Estimating Chronic Values for Single Compounds and Complex Effluents. Environmental Toxicology and Chemistry 4, pp. 807-821.
(9) Van Leeuwen C. J., Espeldoorn A. and Mol F. (1986). Aquatic Toxicological Aspects of Dithiocarbamates and Related Compounds. III. Embryolarval Studies with Rainbow Trout (Salmo gairdneri). J. Aquatic Toxicology, 9, pp. 129-145.
(10) Kirchen R. V. and W. R. West (1969). Teleostean Development. Carolina Tips 32(4): 1-4. Carolina Biological Supply Company.
(11) Kirchen R. V. and W. R. West (1976). The Japanese Medaka. Its care and Development. Carolina Biological Supply Company, North Carolina. 36 pp.
(12) Dunnett C. W. (1955). a Multiple Comparisons Procedure for Comparing Several Treatments with Control. J. Amer. Statist. Assoc., 50, pp. 1096-1121.
(13) Dunnett C. W. (1964). New tables for Multiple Comparisons with a Control. Biometrics, 20, pp. 482-491.
(14) Mc Clave J. T., Sullivan J. H. and Pearson J.G. (1980). Statistical Analysis of Fish Chronic Toxicity Test Data. Proceedings of 4th Aquatic Toxicology Symposium, ASTM, Philadelphia.
(15) Van Leeuwen C. J., Adema D. M. M. and Hermes J. (1990). Quantitative Structure-Activity Relationships for Fish Early Life Stage Toxicity. Aquatic Toxicology, 16, pp. 321-334.
(16) Environment Canada. (1992). Toxicity Tests Using Early Life Stages of Salmonid Fish (Rainbow Trout, Coho Salmon or Atlantic Salmon). Biological Test Method Series. Report EPS 1/RM/28, December 1992, 81 pp.
(17) Dave G. and Xiu R. (1991). Toxicity of Mercury, Nickel, Lead and Cobalt to Embryos and Larvae of Zebrafish, Brachydanio rerio. Arch. of Environmental Contamination and Toxicology, 21, pp. 126-134.
(18) Meyer A., Bierman C. H. and Orti G. (1993). The phylogenetic position of the Zebrafish (Danio rerio), a model system in developmental biology - an invitation to the comperative methods. Proc. Royal Society of London, Series B, 252: pp. 231-236.
(19) Ghillebaert F., Chaillou C., Deschamps F. and Roubaud P. (1995). Toxic Effects, at Three pH Levels, of Two Reference Molecules on Common Carp Embryo. Ecotoxicology and Environmental Safety 32, pp. 19-28.
21.8.2001 L 225/183 Amtsblatt der Europäischen Gemeinschaften DE.(20) US EPA, (1991). Guidelines for Culturing the Japanese Medaka, Oryzias latipes. EPa report EPA/600/3-91/064, Dec. 1991, EPA, Duluth.
(21) US EPA, (1991). Guidelines for Conducting Early Life Stage Toxicity Tests with Japanese Medaka, (Oryzias latipes). EPa report EPA/600/3-91/063, Dec. 1991, EPA, Duluth.
(22) De Graeve G. M., Cooney J. D., McIntyre D. O., Poccocic T. L., Reichenbach N. G., Dean J. H. and Marcus M. D. (1991). Validity in the performance of the seven-day Fathead minnow (Pimephales promelas) larval survival and growth test: an intra- and interlaboratory study. Environ. Tox. Chem. 10, pp. 1189-1203.
(23) Calow P. (1993). Handbook of Ecotoxicology, Blackwells, Oxford. Vol. 1, Chapter 10: Methods for spawning, culturing and conducting toxicity tests with Early Life stages of Estuarine and Marine fish.
(24) Balon E. K. (1985). Early life history of fishes: New developmental, ecological and evolutionary perspectives, Junk Publ., Dordrecht, 280 pp.
(25) Blaxter J. H. S. (1988). Pattern and variety in development, in: W. S. Hoar and D. J. Randall eds., Fish Physiology, Vol. XIA, Academic press, pp. 1-58.
1 ) OECD, Paris, 1992, Test Guideline 210, Fish, Early-life Stage Toxicity Test.
Tabelle 1A:
Für die Prüfung empfohlene Fischarten
| Süßwasserfische |
| Oncorhynchus mykiss Regenbogenforelle (9) (16) |
| Danio rerio Zebrabärbling (7) (17) (18) |
| Cyprinus caprio Gemeiner Karpfen (8) (19) |
| Oryzias latipes Japankärpfling/Medaka (20) (21) |
| Pimephales promelas Dickkopfelritze (8) (22) |
Tabelle 1B:
Beispiele für andere hinreichend dokumentierte Arten, die ebenfalls verwendet wurden
| Süßwasserfische | Salzwasserfische |
| Carassius auratus Goldfisch (8) |
Menidia peninsulae Gezeiten-Ährenfisch (23) (24) (25) |
| Lepomis macrochirus Blauer Sonnenbarsch (8) |
Clupea harengus Hering (24) (25) |
| Gadus morhua Kabeljau (24) (25) |
|
| Cyprinodon variegatus Edelsteinkärpfling (23) (24) (25) |
C.15. Anlage 1
Anleitung zur Durchführung einer Toxizitätsprüfung an Embryonen und Jungtieren mit Dottersack des Zebrabärblings (Brachydanio Rerio)
Einführung
Der Zebrabärbling stammt von der Koromandelküste in Indien, wo er in schnellfließenden Strömen lebt. Er ist ein verbreiteter Aquarienfisch und gehört zur Familie der Karpfen; Informationen über seine Pflege und Kultur sind in Standardnachschlagewerken über tropische Fische zu finden. Die Biologie und die Verwendung des Zebrabärblings in der Fischforschung wurden von Laale (1) besprochen.
Nur in seltenen Fällen erreicht der Fisch eine Länge von mehr als 45 mm. Sein Körper ist zylindrisch geformt mit 7 bis 9 dunkelblauen, waagerecht verlaufenden silbernen Streifen. Diese Streifen reichen bis in die Schwanz- und Afterflossen. Der Rücken ist olivgrün gefärbt. Männchen sind schlanker als Weibchen. Bei Weibchen ist die silberne Färbung stärker ausgeprägt, und ihr Bauch ist gebläht, vor allem vor dem Laichen.
Erwachsene Fische können große Schwankungen von Temperatur, pH-Wert und Härte vertragen. Um jedoch gesunde Fische zu erhalten, die Eier von guter Qualität produzieren, sollte für optimale Bedingungen gesorgt werden.
Beim Laichen verfolgt und begattet das Männchen das Weibchen, und im Ausstoßen werden die Eier befruchtet. Die Eier, die transparent sind und keinen klebrigen Stoff enthalten, fallen auf den Grund, wo sie von den Eltern aufgefressen werden können. Das Laichen wird durch Licht beeinflusst. Bei entsprechendem Morgenlicht laichen die Fische im allgemeinen in den ersten Stunden nach Tagesanbruch.
Ein Weibchen kann im Abstand von einer Woche Chargen von mehreren Hundert Eiern produzieren.
Bedingungen für Elternfische, Fortpflanzung und frühe Entwicklungsstadien
Eine geeignete Anzahl von gesunden Fischen auswählen und mindestens 2 Wochen vor dem beabsichtigten Laichen in geeignetem Wasser (z.B. Anlage 4) halten. Man sollte die Fischgruppe zumindest einmal brüten lassen, bevor sie die für die Prüfung zu verwendende Charge an Eiern produzieren. Die Fischdichte sollte in diesem Zeitraum 1 Gramm Fische je Liter nicht übersteigen. Durch einen regelmäßigen Wechsel des Wassers oder den Einsatz von Reinigungssystemen läßt sich eine höhere Dichte erreichen. Die Temperatur in den Hälterungsbehältern sollte bei 25 ± 2 °C gehalten werden. Den Fischen sollte abwechslungsreiche Nahrung geboten werden, die beispielsweise aus entsprechendem handelsüblichem Trockenfutter, lebenden frischgeschlüpften Arthemien, Chironomiden, Daphnien oder weißen Würmern (Enchytraeiden) bestehen kann.
Im Folgenden werden zwei Verfahren in groben Zügen beschrieben, die in der Praxis eine ausreichende Charge von gesunden befruchteten Eiern für eine durchzuführende Prüfung ergeben haben:
Die Eier sollten mit Hilfe von Glasröhrchen (mit einem Innendurchmesser von nicht weniger als 4 mm), die mit einem flexiblen Saugkolben ausgestattet sind, in die Prüfgefäße umgesetzt werden. Dabei sollte die Menge Wasser, die zusammen mit den Eiern umgelagert wird, so gering wie möglich sein. Die Eier sind schwerer als Wasser und sinken aus dem Röhrchen. Vorsicht ist geboten, damit die Eier (und Larven) nicht mit Luft in Berührung kommen. Es sollte eine mikroskopische Untersuchung von einer oder mehreren Proben von der/den Charge(n) durchgeführt werden, um sicherzugehen, dass in den ersten Entwicklungsstadien keine Unregelmäßigkeiten vorliegen. Eine Desinfektion der Eier ist nicht zulässig.
Die Mortalitätsrate der Eier ist in den ersten 24 Stunden nach der Befruchtung am höchsten. In dieser Zeit ist häufig eine Mortalität von 5 bis 40 Prozent zu beobachten. Infolge einer erfolglosen Befruchtung oder aufgrund von Entwicklungsfehlern kommt es zur Degeneration von Eiern. Die Qualität der Eiercharge scheint dabei vom Fischweibchen abzuhängen; einige Weibchen produzieren gleichbleibend Eier von guter Qualität, andere tun das niemals. Auch die Entwicklungs- und Schlüpfrate ist von Charge zu Charge unterschiedlich. Erfolgreich befruchtete Eier und Dottersacklarven überleben gut, normalerweise in einer Größenordnung von mehr als 90 Prozent. Bei einer Temperatur von 25 °C schlüpfen die Eier 3 bis 5 Tage nach der Befruchtung, und der Dottersack ist etwa 13 Tage nach der Befruchtung aufgezehrt.
Die Embryonalentwicklung wurde von Hisaoka und Battle (2) gut bestimmt. Aufgrund der Transparenz der Eier und der Larven nach dem Schlüpfen kann die Entwicklung der Fische verfolgt werden und lassen sich vorhandene Missbildungen beobachten. Etwa 4 Stunden nach dem Laichen können unbefruchtete Eier von befruchteten unterschieden werden (3).
Zu dieser Untersuchung werden Eier und Larven in Prüfgefäße mit geringem Fassungsvermögen gesetzt und unter dem Mikroskop untersucht.
Die für die frühen Entwicklungsstufen geltenden Prüfbedingungen sind in Anlage 2 aufgeführt. Optimal als pH-Wert und Härte für das Verdünnungswasser sind 7,8 beziehungsweise 250 mg CaCO3 /l.
Berechnungen und Statistik
Vorgeschlagen wird eine zweistufige Vorgehensweise. In einem ersten Schritt werden Daten zu Mortalität, abnormer Entwicklung und Schlüpfzeit statistisch ausgewertet. Dann wird bei denjenigen Konzentrationen, bei denen keine negativen Auswirkungen auf einen dieser Parameter festgestellt wurden, die Körperlänge statistisch bewertet. Diese Vorgehensweise ist ratsam, da der toxische Stoff kleinere Fisch selektiv töten, die Schlüpfzeit verlängern und grobe Mißbildungen hervorrufen und somit zu einseitigen Längenmessungen führen kann. Außerdem soll in etwa die gleiche Anzahl von Fischen für jede Behandlung vermessen werden, um die Validität der Prüfstatistik sicherzustellen.
Bestimmung der LC50 und EC50
Der prozentuale Anteil an überlebenden Eiern und Larven wird berechnet und um die Mortalität in den Kontrollen nach der Abbottschen Formel korrigiert (4):
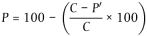
Dabei gilt:
| P | = korrigierter prozentualer Anteil an überlebenden Eiern und Larven |
| P' | = beobachteter prozentualer Anteil an überlebenden Eiern und Larven in der Prüfkonzentration, |
| C | = prozentualer Anteil an überlebenden Eiern und Larven in der Kontrolle. |
Soweit möglich, wird die LC50 am Ende der Prüfung mittels einer geeigneten Methode bestimmt.
Wird die Berücksichtigung von morphologischen Abnormitäten in der EC50 -Statistik gewünscht, finden sich dazu bei Stephan (5) entsprechende Hinweise.
Schätzung der LOEC und NOEC
Eine Zielsetzung, die mit der Prüfung an Eiern und Jungfischen im Dottersack verfolgt wird, besteht darin, die Konzentrationen, die nicht wirkungslos sind, mit der Kontrolle zu vergleichen, das heißt, die LOEC zu bestimmen. Aus diesem Grunde sollten Mehrfachvergleichsverfahren zum Einsatz kommen (6) (7) (8) (9) (10).
Literaturhinweise
(1) Laale H. W. (1977). The Biology and Use of the Zebrafish (Brachydanio rerio) in Fisheries Research. a Literature Review. J. Fish Biol. 10, pp. 121-173.
(2) Hisaoka K. K. and Battle H. I. (1958). The Normal Development Stages of the Zebrafish Brachydanio rerio (Hamilton-Buchanan) J. Morph., 102, 311 pp.
(3) Nagel R. (1986). Untersuchungen zur Eiproduktion beim Zebrabärbling (Brachydanio rerio Hamilton-Buchanan). Journal of Applied Ichthyology, 2, pp. 173-181.
(4) Finney D. J. (1971). Probit Analysis, 3rd ed., Cambridge University Press, Great Britain, pp. 1-333.
(5) Stephan C. E. (1982). Increasing the Usefulness of Acute Toxicity Tests. Aquatic Toxicology and Hazard Assessment: Fifth Conference, ASTM STP 766, J. G. Pearson, R. B. Foster and W. E. Bishop, Eds., American Society for Testing and Materials, pp. 69-81.
(6) Dunnett C. W. (1955). a Multiple Comparisons Procedure for Comparing Several Treatments with a Control. J. Amer. Statist. Assoc., 50, pp. 1096-1121.
(7) Dunnett C. W. (1964). New tables for Multiple Comparisons with a Control. Biometrics, 20, pp. 482-491.
(8) Williams D. A. (1971). a Test for Differences Between Treatment Means when Several Dose Levels are Compared with a Zero Dose Control. Biometrics, 27, pp. 103-117.
(9) Williams D. A. (1972). The Comparison of Several Dose Levels with a Zero Dose Control. Biometrics 28, pp. 519-531.
(10) Sokal R. R. and Rohlf F. J. (1981). Biometry, the Principles and Practice of Statistics in Biological Research, W. H. Freeman and Co., San Francisco.
C.15. Anlage 2
Prüfbedingungen, Dauer und Überlebenskriterien für empfohlene Fischarten
| Fischart | Temperatur (°C) | Salzgehalt (0/00) | Belichtungsdauer(Std.) | Dauer der Stadien (Tage) |
Typische Dauer der Prüfung | Überlebensrate in der Kontrolle (min.-%) | ||
| Embryonen | Jungfische mit Dottersack | Schlüpfer- folg |
Nach dem Schlüpfen | |||||
| Süsswasserfische | ||||||||
| Brachydanio rerio Zebrabärbling | 25 ± 1 | - | 12-16 | 3-5 | 8-10 | So bald wie möglich nach der Befruchtung (frühes Gastrula Stadium) bis 5 Tage nach dem Schlüpfen (8-10 Tage). | 80 | 90 |
| Oncorhynchus mykiss Regenbogenforelle | 10 ± 11 12 ± 12 |
- | 03 | 30-35 | 25-30 | So bald wie möglich nachder Befruchtung (frühes Gastrula-Stadium) bis 20 Tage nach dem Schlüpfen (50-55 Tage). | 66 | 70 |
| Cyprinus carpio GemeinerKarpfen | 21-25 | - | 12-16 | 5 | > 4 | So bald wie möglich nach der Befruchtung (frühes Gastrula- Stadium) bis 4 Tage nach dem Schlüpfen (8-9 Tage). | 80 | 75 |
| Oryzias latipes Japan kärpfling/-Medaka | 24 ± 11 23 ± 12 |
- | 12-16 | 8-11 | 4-8 | So bald wie möglich nach der Befruchtung (frühes Gastrula-Stadium) bis 5 Tage nach dem Schlüpfen (13-16 Tage). | 80 | 80 |
| Pimephales promelas Fett-köpfige Elritze | 25 ± 2 | - | 16 | 4-5 | 5 | So bald wie möglich nach der Befruchtung (frühes Gastrula-Stadium) bis 4 Tage nach dem Schlüpfen (8-9 Tage). | 60 | 70 |
| 1 ) Für Embryonen 2 ) Für Larven 3 ) Dunkelheit für Embryonen und Larven bis eine Woche nach dem Schlüpfen, ausgenommen diese werden kontrolliert. Dann gedämpfte Beleuchtung während der gesamten Prüfung. |
||||||||
C.15. Anlage 3
Prüfbedingungen, Dauer und Überlebenskriterien für andere hinreichend dokumentierte Fischarten
| Fischart | Temperatur (°C) | Salzgehalt (0/00) | Belichtungsdauer (Std.) |
Dauer der Stadien (Tage) | Typische Dauer der Prüfung an Embryonen und Jungfischen mit Dottersack | Überlebensrate in der Kontrolle (min.-%) | ||
| Embryonen | Jungfische mit Dottersack | Schlüpferfolg | Nach dem Schlüpfen | |||||
| Süsswasserfische | ||||||||
| Carassius auratus Goldfisch | 24 ± 1 | - | - | 3-4 | > 4 | So bald wie möglich nach der Befruchtung (frühes Gastrula- Stadium) bis 4 Tage nach dem Schlüpfen (7 Tage). | - | 80 |
| Leopomis macro- chirus Blauer Sonnen-barsch | 21 ± 1 | - | 16 | 3 | > 4 | So bald wie möglich nach der Befruchtung (frühes Gastrula-Stadium) bis 4 Tage nach dem Schlüpfen (7 Tage). | - | 75 |
| Salzwasserfische | ||||||||
| Menidia peninsulae Gezeiten-Ährenfisch | 22-25 | 15-22 | 12 | 1,5 | 10 | So bald wie möglich nach der Befruchtung (frühes Gastrula- Stadium) bis 5 Tage nach dem Schlüpfen (6-7 Tage). | 80 | 60 |
| Clupea harengus Hering | 10 ± 1 | 8-15 | 12 | 20-25 | 3-5 | So bald wie möglich nach der Befruchtung (frühes Gastrula- Stadium) bis 3 Tage nach dem Schlüpfen (23-27 Tage). | 60 | 80 |
| Gadus morhua Kabeljau | 5 ± 1 | 5-30 | 12 | 14-16 | 3-5 | So bald wie möglich nach der Befruchtung (frühes Gastrula-Stadium) bis 3 Tage nach dem Schlüpfen (18 Tage). | 60 | 80 |
| Cyprinodon variegatus Edelsteinkärpfling | 25 ± 1 | 15-30 | 12 | - | - | So bald wie möglich nach der Befruchtung (frühes Gastrula-Stadium) 4/7 Tage nach dem Schlüpfen (28 Tage). | > 75 | 80 |
C.15. Anlage 4
Verschiedene chemische Eigenschaften eines annehmbaren Verdünnungswassers
| Substanz | Konzentrationen |
| Partikelgehalt | < 20 mg/l |
| Gesamter organischer Kohlenstoff (TOC) | < 2 mg/l |
| Nichtionisierter Ammoniak | < 1 µg/l |
| Restchlor | < 10 µg/l |
| Gesamte phosphororganische Pestizide | < 50 ng/l |
| Gesamte chlororganische Pestizide plus polychlorierte Biphenyle | < 50 ng/l |
| Gesamtes organisches Chlor | < 25 ng/l |
 |
weiter . |  |
(Stand: 04.08.2022)
Alle vollständigen Texte in der aktuellen Fassung im Jahresabonnement
Nutzungsgebühr: ab 105.- € netto
(derzeit ca. 7200 Titel s.Übersicht - keine Unterteilung in Fachbereiche)
Die Zugangskennung wird kurzfristig übermittelt
? Fragen ?
Abonnentenzugang/Volltextversion