

 |
zurück |  |
| Bestimmung der Ökotoxizität C.20. Daphnia magna, Reproduktionstest Stand RL 2001/59/EG |
Anhang V zur RL 67/548/EWG |
C.20. 1. Methode
Diese Methode zur Prüfung der Reproduktionstoxizität entspricht der OECD TG 211 (1998).
C.20. 1.1. Einleitung
Die primäre Zielsetzung der Prüfung besteht darin, die Wirkung von Chemikalien auf die Reproduktionsleistung der Daphnia magna zu bestimmen.
C.20. 1.2. Definitionen und Einheiten
Elterntiere: Dies sind diejenigen weiblichen Daphnien, die zu Beginn der Prüfung vorhanden sind und deren Reproduktionsleistung in der Prüfung untersucht werden soll.
Nachkommen: Dies sind die jungen Daphnien, die von den Elterntieren im Verlauf der Prüfung produziert werden.
Lowest Observed Effect Concentration (LOEC): Dies ist die niedrigste geprüfte Dosiskonzentration, bei der sich eine statistisch signifikante Wirkung auf die Reproduktion und die Mortalität der Elterntiere (bei p < 0,05) im Vergleich zu der Kontrolle innerhalb eines angegebenen Expositionszeitraums beobachten lässt. Alle Prüfkonzentrationen oberhalb der LOEC müssen jedoch eine schädigende Wirkung haben, die gleich den bei der LOEC beobachteten Wirkungen oder größer als diese ist. Können diese beiden Bedingungen nicht erfüllt werden, muss ausführlich erklärt werden, wie die LOEC (und damit auch die NOEC) ausgewählt wurde.
No Observed Effect Concentration (NOEC): Dies ist die Prüfkonzentration unmittelbar unterhalb der LOEC, bei der im Vergleich zu der Kontrolle innerhalb eines angegebenen Expositionszeitraums keine statistisch signifikante Wirkung (p < 0,05) vorliegt.
ECx : Dies ist die Konzentration der in Wasser gelösten Prüfsubstanz, die zu einer Verringerung der Reproduktion der Daphnia magna um x Prozent innerhalb eines angegebenen Expositionszeitraums führt.
Immanente Wachstumsrate: Dies ist ein Maß für das Wachstum der Population, welches die Reproduktionsleistung und die altersspezifische Mortalität mit einbezieht (20) (21) (22). In stabilen Populationen ist die immanente Wachstumsrate gleich null. Bei wachsenden Populationen ist sie positiv, und bei schrumpfenden Populationen ist sie negativ. Letztere kann eindeutig keine Erhaltung der Art ermöglichen und führt schließlich zum Aussterben.
Nachweisgrenze: Dies ist die niedrigste Konzentration, die nachgewiesen, aber nicht quantifiziert werden kann.
Bestimmungsgrenze: Dies ist die niedrigste Konzentration, die quantitativ gemessen werden kann.
Mortalität: Ein Tier wird als tot protokolliert, wenn es unbeweglich ist, d. h., wenn es nicht schwimmen kann oder sich keine Bewegungen von Anhängseln oder Postabdomen innerhalb von 15 Sekunden nach vorsichtigem Hin- und Herbewegen des Prüfbehälters beobachten lassen. (Wird eine andere Definition herangezogen, muss diese zusammen mit dem dazugehörigen Literaturhinweis angegeben werden.)
C.20. 1.3. Prinzip der Methode
Junge weibliche Daphnien (die Elterntiere), die zu Beginn der Prüfung weniger als 24 Stunden alt sind, werden der dem Wasser in verschiedenen Konzentrationen zugesetzten Prüfsubstanz ausgesetzt. Die Dauer der Prüfung beträgt 21 Tage. Am Ende der Prüfung wird die gesamte Anzahl an lebenden Nachkommen, die von den am Ende der Prüfung noch lebenden Elterntieren produziert wurden, bewertet. Dies bedeutet, dass Jungtiere, die von erwachsenen Tieren, welche im Verlauf der Prüfung sterben, produziert werden, aus den Berechnungen ausgeschlossen werden. Die Reproduktionsleistung von Elterntieren kann auch auf andere Art und Weise angegeben werden (z.B. Anzahl an lebenden Nachkommen, die je Tier und Tag ab dem ersten Tag, an dem Nachkommen festgestellt wurden, produziert werden), diese Angaben sollten jedoch zusätzlich zu der Gesamtanzahl an Jungtieren, bezogen auf die am Ende der Prüfung noch lebenden Elterntiere, protokolliert werden. Die Reproduktionsleistung der Tiere, die der Prüfsubstanz ausgesetzt wurden, wird mit der Leistung der Kontrolle(n) verglichen, um die niedrigste Wirkkonzentration (LOEC) und damit auch die höchste Konzentration ohne Wirkung (NOEC) zu bestimmen. Zusätzlich sind die Daten so weit wie möglich mit Hilfe eines Regressionsmodells zu analysieren, um die Konzentration zu schätzen, die zu einer x %igen Verringerung der Reproduktionsleistung führen würde (d. h. EC50 , EC20 oder EC10 ).
Das Überleben der Elterntiere und die Zeit bis zur Produktion der ersten Brut müssen ebenfalls berichtet werden. Andere sich auf die jeweilige Substanz beziehende Wirkungen auf Parameter wie das Wachstum (z.B. die Länge) und eine mögliche immanente Wachstumsrate können ebenfalls untersucht werden.
C.20. 1.4. Angaben zur Prüfsubstanz
Ergebnisse einer akuten Toxizitätsprüfung (siehe Methode C.2, Teil I), die an Daphnia magna durchgeführt wurde, sollten zur Verfügung stehen. Das Ergebnis kann bei der Auswahl eines geeigneten Bereichs an Prüfkonzentrationen in den Reproduktionsprüfungen von Nutzen sein. Die Wasserlöslichkeit und der Dampfdruck der Prüfsubstanz sollten bekannt sein, und ein zuverlässiges analytisches Verfahren für die Quantifizierung der Prüfsubstanz in den Prüflösungen mit dokumentierter Restitutionsgüte und Nachweisgrenze sollte vorhanden sein.
Zu den Informationen über die Prüfsubstanz, die bei der Festlegung der Prüfbedingungen von Nutzen sein können, gehören die Strukturformel, die Reinheit der Substanz, die Lichtstabilität, die Stabilität unter den Versuchsbedingungen, pKa, Pow und die Ergebnisse einer Prüfung zur leichten biologischen Abbaubarkeit (siehe Methode C.4).
C.20. 1.5. Validitätskriterien
Damit die Validität einer Prüfung gegeben ist, sollten die folgenden Leistungskriterien in der/den Kontrolle(n) erfüllt werden:
C.20. 1.6. Beschreibung der Methode
C.20. 1.6.1. Prüfanordnung
Prüfgefäße und andere Geräte, die mit den Prüflösungen in Berührung kommen, sollten ganz aus Glas oder einem anderen chemisch inerten Werkstoff bestehen. Normalerweise handelt es sich bei den Prüfgefäßen um Glaskolben.
Zusätzlich werden einige oder alle der folgenden Geräte erforderlich sein:
C.20. 1.6.2. Prüforganismen
In der Prüfung soll die Art Daphnia magna Straus verwendet werden. Andere Daphnien-Arten können zum Einsatz kommen, sofern sie die Validitätskriterien, soweit zutreffend, erfüllen (die Validitätskriterien hinsichtlich der Reproduktionsleistung in den Kontrollen sollten für die Daphnien-Art relevant sein). Werden andere Daphnien-Arten verwendet, müssen diese eindeutig identifiziert werden, außerdem ist ihre Verwendung zu begründen.
Der Klon sollte möglichst durch eine Genotypbestimmung identifiziert worden sein. Untersuchungen (1) haben gezeigt, dass die Reproduktionsleistung von Klon a (der aus dem IRCHa in Frankreich stammt) (3) das Validitätskriterium eines Mittelwerts von ≥ 60 Nachkommen je überlebendem Elterntier gleichbleibend erfüllt, wenn die Kultur unter den in dieser Methode beschriebenen Bedingungen erfolgt. Andere Klone sind jedoch annehmbar, sofern nachgewiesen ist, dass die Daphnien-Kultur die Validitätskriterien für eine Prüfung erfüllt.
Zu Beginn der Prüfung sollten die Tiere weniger als 24 Stunden alt sein, und sie dürfen nicht zur ersten Nachkommenschaft einer Brut gehören. Sie sollten aus einem gesunden Bestand stammen (d. h., keine Anzeichen von Stress aufweisen, beispielsweise eine hohe Mortalität, das Vorhandensein von männlichen Tieren oder Ephippien, verzögerte Produktion der ersten Brut, verfärbte Tiere usw.). Die Zuchttiere müssen unter ähnlichen Kulturbedingungen (Licht, Temperatur, Medium, Fütterung und Tiere je Volumeinheit) gehalten werden wie die Tiere, die in der Prüfung verwendet werden. Wird bei der Prüfung ein anderes Kulturmedium für die Daphnien verwendet als bei der routinemäßigen Daphnien-Kultur, empfiehlt sich eine Eingewöhnungszeit vor der Prüfung, die im Normalfall etwa 3 Wochen dauert (d. h. eine Generation), um Stress für die Elterntiere zu vermeiden.
C.20. 1.6.3. Prüfmedium
In dieser Prüfung wird der Einsatz eines vollständig definierten Mediums empfohlen. Dadurch kann die Verwendung von Additiven (z.B. Seetang, Bodenextrakt, usw.), die sich nur schwer charakterisieren lassen, vermieden werden, und es bestehen größere Chancen auf eine Standardisierung unter den Prüfeinrichtungen. Die Medien Elendt M4 (4) und M7 (siehe Anhang 1) haben sich für diesen Zweck als geeignet erwiesen. Allerdings sind andere Medien (z.B. (5) (6)) annehmbar, sofern nachgewiesen ist, dass die Leistung der Daphnien-Kultur die Validitätskriterien für die Prüfung erfüllt.
Werden Medien verwendet, die undefinierte Additive enthalten, sollten diese Additive klar und deutlich spezifiziert werden, und es sollten in dem Prüfbericht Angaben zur Zusammensetzung enthalten sein, insbesondere im Hinblick auf den Kohlenstoffgehalt, da dies zu der gebotenen Nahrung beitragen kann. Empfohlen wird, dass der gesamte organische Kohlenstoff (TOC) und/oder der chemische Sauerstoffbedarf (COD) des Stammansatzes des organischen Additivs bestimmt und eine Schätzung des sich daraus ergebenden Beitrags zu dem TOC/COD in dem Prüfmedium vorgenommen wird. Die Empfehlung lautet, dass die TOC-Anteile in dem Medium (d. h. vor dem Zusatz von Algen) unter 2 mg/l liegen sollten (7).
Enthalten die Prüfsubstanzen Metalle, ist es wichtig, anzuerkennen, dass die Eigenschaften des Prüfmediums (z.B. Härte, Chelatbildungsvermögen) Einfluss auf die Toxizität der Prüfsubstanz haben können. Aus diesem Grunde sollte möglichst ein umfassend definiertes Prüfmedium verwendet werden. Gegenwärtig sind jedoch die einzigen umfassend definierten Medien, die bekanntermaßen für die Langzeitkultur von Daphnia magna geeignet sind, Elendt M4 und M7. Beide Medien enthalten den Chelatbildner EDTA. Untersuchungen haben gezeigt (2), dass die -scheinbare Toxizitätie von Cadmium im Allgemeinen niedriger ist, wenn die Reproduktionsprüfung in den Medien M4 und M7 durchgeführt wird, als in Medien, die kein EDTa enthalten. M4 und M7 werden aus diesem Grunde nicht für Prüfsubstanzen empfohlen, die Metalle enthalten, und andere Medien, die bekannte Chelatbildner enthalten, sollten ebenfalls vermieden werden. Bei Substanzen, die Metall enthalten, kann die Verwendung eines alternativen Mediums ratsam sein, beispielsweise rekonstituiertes hartes Süßwasser (7) nach ASTM, das kein EDTa enthält und dem Seetangextrakt zugesetzt wurde (8). Diese Kombination von rekonstituiertem hartem Süßwasser nach ASTM und Seetangextrakt ist ebenfalls für die Langzeitkultur und Prüfung von Daphnia magna (2) geeignet, auch wenn sie aufgrund der organischen Komponente in dem zugesetzten Seetangextrakt immer noch eine geringfügige chelatbildende Wirkung ausübt.
Zu Beginn und im Verlauf der Prüfung sollte die gelöste Sauerstoffkonzentration über 3 mg/l liegen. Der pHWert sollte sich im Bereich von 6 bis 9 befinden und in jedem einzelnen Test um nicht mehr als 1,5 Einheiten schwanken. Eine Härte von mehr als 140 mg/l (als CaCO3) wird empfohlen. Bei Prüfungen mit diesem und höheren Werten wurde eine Reproduktionsleistung im Einklang mit den Validitätskriterien (9) (10) nachgewiesen.
C.20. 1.6.4. Prüflösungen
Prüflösungen der gewählten Konzentrationen werden im Allgemeinen durch Verdünnung eines Stammansatzes hergestellt. Stammansätze sollten möglichst durch Auflösung der Substanz im Prüfmedium hergestellt werden.
In einigen Fällen kann zwar der Einsatz von organischen Löse- oder Dispersionsmitteln erforderlich sein, um einen Stammansatz von geeigneter Konzentration zu erzielen, jedoch sollten alle Anstrengungen unternommen werden, um die Verwendung derartiger Stoffe zu vermeiden. Beispiele für geeignete Lösemittel sind Aceton, Ethanol, Methanol, Dimethylformamid und Triethylenglycol. Beispiele für geeignete Dispersionsmittel sind Cremophor RH40, Methylcellulose 0,0 1 % und HCO-40. In jedem Fall sollte die Prüfsubstanz in den Prüflösungen die Löslichkeitsgrenze im Prüfmedium nicht überschreiten.
Lösemittel werden zur Herstellung eines Stammansatzes verwendet, der genau in Wasser dosiert werden kann.
Bei der empfohlenen Lösemittelkonzentration in dem endgültigen Prüfmedium (d. h. ≥ 0,1 ml/l) sind die obengenannten Lösemittel nicht toxisch und führen nicht zu einer höheren Wasserlöslichkeit einer Substanz. Dispersionsmittel können bei einer genauen Dosierung und Dispersion helfen. Bei der empfohlenen Konzentration in dem endgültigen Prüfmedium (≥ 0,1 ml/l) sind die obengenannten Dispersionsmittel nicht toxisch und führen nicht zu einer höheren Wasserlöslichkeit einer Substanz.
C.20. 1.7. Auslegung der Prüfung
Die Behandlungen sollten den Prüfgefäßen zugeordnet werden, und die gesamte anschließende Handhabung der Prüfgefäße sollte nach dem Zufallsprinzip erfolgen. Ist dies nicht der Fall, kann dies zu einer einseitigen Ausrichtung führen, die als Konzentrationswirkung ausgelegt werden könnte. Insbesondere wenn mit Versuchseinheiten in einer Behandlungs- oder Konzentrationsreihenfolge umgegangen wird, könnten verschiedene zeitabhängige Auswirkungen wie beispielsweise die Müdigkeit des Prüfers oder andere Fehler zu größeren Wirkungen bei den höheren Konzentrationen führen. Außerdem sollte eine Blockbildung für die Prüfung in Erwägung gezogen werden, wenn die Prüfergebnisse wahrscheinlich durch eine anfängliche oder umweltbezogene Bedingung der Prüfung wie der Position in der Prüfeinrichtung beeinflusst werden.
C.20. 1.8. Durchführung der Prüfung
C.20. 1.8.1. Expositionsbedingungen
C.20. 1.8.1.1. Dauer
Die Dauer der Prüfung beträgt 21 Tage.
C.20. 1.8.1.2. Besatz
Die Elterntiere werden jeweils einzeln in einem Prüfgefäß mit 50 bis 100 ml Prüfmedium in jedem Gefäß gehalten.
Mitunter können größere Volumina erforderlich sein, um die Anforderungen des für die Bestimmung der Prüfsubstanzkonzentration zum Einsatz kommenden analytischen Verfahrens zu erfüllen, auch wenn ein Poolen von Wiederholungen für die chemische Analyse ebenfalls zulässig ist. Werden größere Volumina als 100 ml verwendet, muss unter Umständen die den Daphnien verabreichte Ration erhöht werden, um ein entsprechendes Nahrungsangebot und die Einhaltung der Validitätskriterien sicherzustellen. Bei Durchflussprüfungen können aus technischen Gründen alternative Konzepte in Erwägung gezogen werden (z.B. vier Gruppen von jeweils zehn Tieren in einem größeren Prüfvolumen), dann sollten allerdings Änderungen an der Auslegung der Prüfung protokolliert werden.
C.20. 1.8.1.3. Anzahl an Tieren
Bei semistatischen Prüfungen werden mindestens 10 Tiere einzeln bei jeder Prüfkonzentration und mindestens 10 Tiere einzeln in den Kontrollreihen gehalten.
Bei Durchflussprüfungen haben sich 40 Tiere, die in vier Gruppen von jeweils 10 Tieren bei jeder Prüfkonzentration aufgeteilt werden, als geeignet erwiesen (1). Eine geringere Anzahl an Prüforganismen kann verwendet werden, und mindestens 20 Tiere je Konzentration, die in zwei oder mehr Wiederholungen mit einer gleichen Anzahl von Tieren aufgeteilt werden (z.B. vier Wiederholungen mit jeweils fünf Daphnien), werden empfohlen. Zu beachten ist, dass es bei Prüfungen, bei denen die Tiere in Gruppen gehalten werden, nicht möglich sein wird, die Reproduktionsleistung als Gesamtanzahl an lebenden Nachkommen pro am Ende der Prüfung noch lebendem Elterntier darzustellen, wenn Elterntiere sterben. In diesen Fällen sollte die Reproduktionsleistung als - Gesamtanzahl an lebenden Nachkommen pro zu Beginn der Prüfung vorhandenem Elterntier - angegeben werden.
C.20. 1.8.1.4. Fütterung
Bei semistatischen Prüfungen sollte die Fütterung möglichst täglich, zumindest jedoch dreimal pro Woche erfolgen (d. h. entsprechend dem Wechsel des Prüfmediums). Abweichungen hiervon (z.B. bei Durchflussprüfungen) sollten protokolliert werden.
Während der Prüfung sollte die Nahrung der Elterntiere möglichst aus lebenden Algenzellen von einer oder mehreren der folgenden Arten bestehen: Chlorella sp, Selenastrum capricornutum (jetzt Pseudokirchneriella subcapitata (11)) und Scenedesmus subspicatus. Die angebotene Nahrung sollte auf der Menge an organischem Kohlenstoff (C) beruhen, die jedem Elterntier zur Verfügung gestellt wird. Untersuchungen (12) haben gezeigt, dass bei Daphnia magna Rationen zwischen 0,1 und 0,2 mg C/Daphnie/Tag hinreichend sind, um die zur Erfüllung der Validitätskriterien der Prüfung erforderliche Anzahl an Nachkommen zu erzielen. Die Ration kann entweder aus einer gleichbleibenden Gabe während des gesamten Prüfzeitraums bestehen, oder es kann, sofern gewünscht, am Anfang eine geringere Menge dargeboten werden, die dann im Verlauf der Prüfung erhöht wird, um dem Wachstum der Elterntiere Rechnung zu tragen. In diesem Falle sollte die Ration zu allen Zeiten nach wie vor innerhalb des empfohlenen Bereichs von 0,1 bis 0,2 mg C/Daphnie/Tag bleiben.
Kommen zur Bestimmung der erforderlichen Futterration Ersatzgrößen zum Einsatz, beispielsweise die Anzahl an Algenzellen oder die Lichtextinktion (aus Gründen der Zweckmäßigkeit, weil die Messung des Kohlenstoffgehalts zeitaufwendig ist), muss jede Prüfeinrichtung ihr eigenes Nomogramm erstellen, in dem die Ersatzgröße in Bezug zum Kohlenstoffgehalt der Algenkultur gesetzt wird (Anleitung zur Erstellung von Nomogrammen siehe Anhang 2). Nomogramme sollten zumindest einmal pro Jahr oder häufiger überprüft werden, wenn sich die Bedingungen für die Algenkultur geändert haben. Dabei hat sich die Lichtextinktion als eine bessere Ersatzgröße für den Kohlenstoffgehalt als die Zellenanzahl erwiesen (13).
Den Daphnien sollte eine konzentrierte Algensuspension gefüttert werden, um das Volumen des Algenkulturmediums, das in die Prüfgefäße gelangt, auf ein Mindestmaß zu beschränken. Die Konzentration der Algen läßt sich durch Zentrifugieren mit anschließender Resuspension in destilliertem Wasser, entionsiertem Wasser oder Daphnien-Kulturmedium erreichen.
C.20. 1.8.1.5. Licht
16 Stunden Licht mit einer Stärke von nicht mehr als 15 bis 20 µE × m-2 × s-1.
C.20. 1.8.1.6. Temperatur
Die Temperatur der Prüfmedien sollte innerhalb eines Bereichs von 18 bis 22 °C liegen. Allerdings sollte die Temperatur bei jeder einzelnen Prüfung nach Möglichkeit um nicht mehr als 2 °C innerhalb dieser Grenzwerte schwanken (z.B. 18 bis 20, 19 bis 21 oder 20 bis 22 °C). Zur Überwachung der Temperatur kann die Verwendung eines zusätzlichen Prüfgefäßes angebracht sein.
C.20. 1.8.1.7. Belüftung
Die Prüfgefäße dürfen während der Prüfung nicht belüftet werden.
C.20. 1.8.2. Prüfkonzentration
Im Normalfall sollten mindestens fünf Prüfkonzentrationen verwendet werden, die in einer geometrischen Reihe angeordnet sind und sich um einen Faktor von möglichst nicht mehr als 3,2 voneinander unterscheiden, und es sollte die angemessene Anzahl an Wiederholungen für jede Prüfkonzentration eingesetzt werden (siehe 1.8.1.3). Werden weniger als fünf Konzentrationen verwendet, sollte eine Begründung dafür angegeben werden. Substanzen sollten nicht oberhalb ihrer Löslichkeitsgrenze im dem Prüfmedium getestet werden.
Bei der Festlegung des Bereichs von Konzentrationen sollte folgendes bedacht werden:
Wenn die Toxizität der Prüfsubstanz im Vorfeld bekannt ist (z.B. aus einer akuten Toxizitätsprüfung und/ oder aus Voruntersuchungen zur Ermittlung des Konzentrationsbereichs), dürfte dies bei der Auswahl geeigneter Prüfkonzentrationen helfen.
Wird ein Löse- oder Dispersionsmittel zur Herstellung der Prüflösungen verwendet (siehe Abschnitt 1.6.4), sollte dessen Endkonzentration in den Prüfgefäßen 0,1 ml/l nicht übersteigen und in allen Prüfgefäßen gleich sein.
C.20. 1.8.3. Kontrollen
Eine Kontrollreihe mit dem Prüfmedium und, sofern zutreffend, auch eine Kontrollreihe mit dem Löse- oder Dispersionsmittel sollten zusätzlich zu den Testreihen durchgeführt werden. Werden Löse- oder Dispersionsmittel verwendet, sollte deren Konzentration gleich den Konzentrationen in den Gefäßen mit der Prüfsubstanz sein. Die entsprechende Anzahl an Wiederholungen sollte zum Einsatz kommen (siehe Abschnitt 1.8.1.3).
Im Allgemeinen sollte in einer ordentlich durchgeführten Prüfung der Variationskoeffizient rund um die mittlere Anzahl an lebenden Nachkommen, die pro Elterntier in der/den Kontrolle(n) produziert werden, ≤ 25 %, sein, und dies sollte bei Prüfkonzepten mit einzeln gehaltenen Tieren protokolliert werden.
C.20. 1.8.4. Erneuerung des Prüfmediums
Die Häufigkeit, mit der das Prüfmedium erneuert wird, hängt von der Stabilität der Prüfsubstanz ab, jedoch sollte es zumindest dreimal pro Woche ausgetauscht werden. Wenn aus vorhergehenden Stabilitätsprüfungen (siehe Abschnitt 1.4) bekannt ist, dass die Konzentration der Prüfsubstanz während des maximalen Erneuerungszeitraums (d. h. 3 Tage) nicht stabil ist (d. h. außerhalb des Bereichs von 80 bis 120 % der nominalen Konzentration oder Unterschreitung von 80 % der gemessenen anfänglichen Konzentration), sollte ein häufigerer Wechsel des Prüfmediums oder der Einsatz einer Durchflussprüfung in Erwägung gezogen werden.
Wird das Medium in semistatischen Prüfungen erneuert, wird eine zweite Reihe von Prüfgefäßen vorbereitet, in die die Elterntiere beispielsweise mit einer Glaspipette von geeignetem Durchmesser umgesetzt werden.
Dabei sollte die Menge an Prüfmedium, die zusammen mit den Daphnien umgesetzt wird, so gering wie möglich sein.
C.20. 1.8.5. Beobachtungen
Die Ergebnisse der Beobachtungen während der Prüfung sollten auf Datenblättern (siehe Beispiele in Anhang 3 und 4) protokolliert werden. Sind andere Messungen erforderlich (siehe 1.3 und 1.8.8), sind gegebenenfalls weitere Beobachtungen vonnöten.
C.20. 1.8.6. Nachkommen
Die Nachkommen, die von jedem Elterntier produziert werden, sollten vom Auftreten der ersten Brut an möglichst täglich entfernt und gezählt werden, um zu verhindern, dass diese die für die erwachsenen Tiere bestimmte Nahrung verbrauchen. Für diese Methode braucht zwar nur die Anzahl an lebenden Nachkommen gezählt werden, vorhandene unreife Eier oder tote Nachkommen sollten jedoch ebenfalls festgehalten werden.
C.20. 1.8.7. Mortalität
Sterbefälle unter den Elterntieren sollten möglichst täglich protokolliert werden; sie sollten zumindest zu den gleichen Zeiten wie die Nachkommen gezählt werden.
C.20. 1.8.8. Sonstige Parameter
Auch wenn dieses Verfahren in der Hauptsache zur Bewertung der Wirkungen auf die Reproduktion dienen soll, besteht die Möglichkeit, dass auch andere Auswirkungen in hinreichendem Maße für eine statistische Auswertung quantifiziert werden können. Besonders wünschenswert sind dabei Wachstumsmessungen, denn sie liefern Informationen über mögliche subletale Wirkungen, die unter Umständen nützlicher als die Reproduktionsmessung alleine sind; empfohlen wird die Vermessung der Länge der Elterntiere (d. h. die Körperlänge ohne Afterstachel) am Ende der Prüfung. Weitere Parameter, die sich messen oder berechnen lassen, sind unter anderem die Zeit bis zur Produktion der ersten Brut (und folgender Bruten), Anzahl und Umfang der Bruten je Tier, Anzahl an unreifen Eiern, Vorhandensein von männlichen Tieren oder Ephippien und die immanente Populationswachstumsrate.
C.20. 1.8.9. Häufigkeit von analytischen Bestimmungen und Messungen
Die Sauerstoffkonzentration, die Temperatur, die Härte und pH-Werte sollten zumindest einmal pro Woche gemessen werden, und zwar in frischen und alten Medien, in der/den Kontrolle(n) und in der höchsten Konzentration der Prüfsubstanz.
Während der Prüfung werden die Konzentrationen der Prüfsubstanz in regelmäßigen Abständen bestimmt.
Bei semistatischen Prüfungen, bei denen erwartet wird, dass die Konzentration der Prüfsubstanz innerhalb von ± 20 % der Nominalkonzentration konstant bleibt (d. h. innerhalb des Bereichs von 80 bis 120 % - siehe Abschnitt 1.4 und 1.8.4), wird empfohlen, dass zumindest die höchste und die niedrigste Prüfkonzentration, frisch hergestellt und zum Zeitpunkt des Austauschs, einmal während der ersten Woche der Prüfung analysiert werden (d. h. Analysen sollten anhand einer Probe derselben Lösung erfolgen - wenn diese frisch hergestellt ist und beim Austausch). Diese Bestimmungen sollten anschließend zumindest in wöchentlichen Abständen wiederholt werden.
Bei Prüfungen, bei denen nicht damit zu rechnen ist, dass die Konzentration der Prüfsubstanz innerhalb von ± 20 % der Nominalkonzentration konstant bleibt, ist es notwendig, alle Prüfkonzentrationen, frisch hergestellt und beim Austausch, zu analysieren. Bei denjenigen Prüfungen jedoch, bei denen die gemessene Anfangskonzentration der Prüfsubstanz zwar nicht innerhalb von ± 20 % der nominalen Konzentration stabil bleibt, bei der jedoch hinreichend nachgewiesen werden kann, dass die Anfangskonzentrationen reproduzierbar und stabil sind (d. h. innerhalb des Bereichs von 80 bis 120 % der Anfangskonzentrationen), könnten die chemischen Bestimmungen in Woche 2 und 3 der Prüfung auf die höchste und die niedrigste Konzentration reduziert werden. In allen Fällen braucht die Bestimmung der Prüfsubstanzkonzentrationen vor der Erneuerung des Prüfmediums nur an einem Wiederholungsgefäß bei jeder Prüfkonzentration vorgenommen zu werden.
Bei einer Durchflussprüfung ist ein ähnliches Probenahmeverfahren wie für semistatische Prüfungen beschrieben angebracht (die Messung der "alten" Lösungen gilt in diesem Fall jedoch nicht). Es kann allerdings ratsam sein, die Anzahl an Probenahmen in der ersten Woche zu erhöhen (z.B. drei Messreihen), um sicherzugehen, dass die Prüfkonzentrationen stabil bleiben. Bei diesen Prüfarten sollte die Durchsatzrate des Verdünnungsmittels und der Prüfsubstanz täglich überprüft werden.
Ist nachgewiesen, dass die Konzentration der geprüften Substanz während der gesamten Prüfung zufriedenstellend innerhalb von ± 20 % der Nominalkonzentration oder der gemessenen Anfangskonzentration bleibt, können die Ergebnisse auf nominalen oder gemessenen Anfangswerten beruhen. Wenn die Abweichung von der nominalen oder gemessenen Anfangskonzentration größer als ± 20 % ist, sollten die Ergebnisse als zeitgewichtetes Mittel dargestellt werden (siehe Anlage 5).
C.20. 2. Daten und Berichterstattung
C.20. 2.1. Auswertung der Ergebnisse
Mit dieser Prüfung soll die Wirkung der Prüfsubstanz auf die Gesamtanzahl an lebenden Nachkommen, die pro am Ende der Prüfung noch lebendem Elterntier produziert wurden, bestimmt werden. Dabei sollte die Gesamtanzahl an Nachkommen je Elterntier für jedes Prüfgefäß (d. h. für jede Wiederholung) berechnet werden. Wenn in einer Wiederholung das Elterntier während der Prüfung stirbt oder sich als Männchen herausstellt, dann wird die Wiederholung von der Analyse ausgeschlossen. Die Analyse beruht dann auf einer verringerten Anzahl von Wiederholungen.
Zur Schätzung der LOEC und damit auch der NOEC für Wirkungen der Chemikalie auf die Reproduktionsleistung müssen die mittlere Reproduktionsleistung unter den Wiederholungen für jede Konzentration und die gepoolte Reststandardabweichung berechnet werden; dies kann durch eine Varianzanalyse (ANOVA) erfolgen. Der Mittelwert für jede Konzentration muss dann mit Hilfe einer angemessenen Mehrfachvergleichsmethode mit dem Kontrollmittelwert verglichen werden. Von Nutzen können dabei Dunnettsche oder Williamssche Tests sein (14) (15) (16) (17). Überprüft werden muss, ob die ANOVA-Voraussetzung der Homogenität der Varianz zutreffend ist. Es wird empfohlen, dies eher grafisch als durch eine formale Signifikanzprüfung zu ermitteln (18); eine geeignete Alternative besteht in der Durchführung eines Bartlettschen Tests. Gilt diese Annahme nicht, sollte überlegt werden, die Daten zur Homogenisierung von Varianzen vor der Durchführung der ANOVa zu transformieren oder eine gewichtete ANOVa durchzuführen. Der Umfang der mit der ANOVa nachweisbaren Wirkung (d. h. die geringste signifikante Differenz) sollte berechnet und protokolliert werden.
Zur Schätzung der Konzentration, die eine 50 %ige Verringerung der Reproduktionsleistung verursachen würde (d. h. die EC50 ), sollte eine geeignete Kurve wie beispielsweise die logistische Kurve an die Daten unter Einsatz eines statistischen Verfahrens wie der Methode der kleinsten Quadrate angepasst werden. Die Kurve könnte so parametriert werden, dass die EC50 und deren Standardfehler direkt abgeschätzt werden können. Dies würde die Berechnung des Vertrauensbereichs für die EC50 deutlich erleichtern. Soweit keine guten Gründe dafür vorliegen, anderen Vertrauensbereichen den Vorzug zu geben, sollte der zweiseitige 95 % Vertrauensbereich angegeben werden. Das Anpassungsverfahren sollte möglichst einen Weg bieten, um die Signifikanz der mangelnden Anpassung zu bewerten Dies kann grafisch erfolgen oder indem man die Restsumme der Quadrate in "mangelnde Anpassung" und "reine Fehlerkomponenten" unterteilt und eine Signifikanzprüfung für die mangelnde Anpassung durchführt. Da Behandlungen, die zu einer höheren Fruchtbarkeit führen, wahrscheinlich eine größere Varianz in der Anzahl an produzierten Jungtieren aufweisen als Behandlungen, die eine niedrige Fruchtbarkeit ergeben, sollte eine Gewichtung der beobachteten Werte in Erwägung gezogen werden, um den unterschiedlichen Varianzen in den verschiedenen Behandlungsgruppen Rechnung zu tragen (Hintergrundinformationen siehe Literaturhinweis 18).
Bei der Analyse der Daten aus dem endgültigen Ringversuch (2) wurde eine logistische Kurve anhand des folgenden Modells angepasst, auch wenn andere geeignete Modelle herangezogen werden können:
| c | |
| Y = | |
| 1 + (x/x0)b |
Dabei gilt:
Y: Gesamtanzahl an Jungtieren pro Elterntier, das am Ende der Prüfung noch lebt (für jedes Gefäß berechnet)
x: Konzentration der Substanz
c: Erwartete Anzahl an Jungtieren bei x = 0
x0 : EC50 in der Population
b: Steigungsparameter.
Dieses Modell kommt wahrscheinlich für eine große Anzahl von Situationen in Frage, es wird jedoch Prüfungen geben, bei denen es nicht angemessen ist. Wie oben angeregt, sollte die Validität des Modells überprüft werden. In einigen Fällen kann auch ein Hormesis-Modell, bei dem niedrige Konzentrationen zu größeren Wirkungen führen, angebracht sein (19).
Andere Wirkkonzentrationen wie die EC10 oder EC20 können ebenfalls geschätzt werden, auch wenn vielleicht besser eine andere Parametrierung für das Modell als bei der Schätzung der EC50 zu verwenden ist.
C.20. 2.2. Abschlussbericht
Der Prüfbericht muss die folgenden Angaben enthalten:
C.20. 2.2.1. Prüfsubstanz
C.20. 2.2.2. Geprüfte Daphnienart
C.20. 2.2.3. Prüfbedingungen
C.20. 2.2.4. Ergebnisse
C.20. 3. Literaturhinweise
(1) OECD Test Guideline Programme, Report of the Workshop on the Daphnia magna Pilot Ring Test, Sheffield University, UK, 20-21 March 1993.
(2) OECD Environmental Health and Safety Publications. Series on Testing and Assessment No. 6. Report of the Final Ring Test of the Daphnia magna Reproduction Test Paris. 1997.
(3) Baird D. J., Barber J., Bradley M. C., Soares A. M. V. M. and Calow P. (1991). a comparative study of genotype sensitivity to acute toxic stress using clones of Daphnia magna Strauss. Ecotoxicology and Environmental Safety, 21, pp. 257-265.
(4) Elendt B. P., (1990). Selenium deficiency in Crustacea; An ultrastructural approach to antennal damage in Daphnia magna Straus. Protoplasma, 154, pp. 25-33.
(5) EPa (1993). Methods for Measuring the Acute Toxicity of Effluents and Receiving Waters to Freshwater and Marine Organisms. (Fourth ed.). EPA/600/4-90/027F. C. I. Weber (ed), USEPA, Cincinnati, Ohio.
(6) Vigano L., (1991) Suitability of commercially available spring waters as standard medium for culturing
Daphnia magna. Bull. Environ. Contam. Toxicol., 47, pp. 775-782.
(7) ASTM (1988). Standard Guide for Conducting Acute Toxicity Tests with Fishes, Macroinvertebrates and Amphibians. E729-88a. American Society for Testing and Materials, Philadelphia P.A. 20 pp.
(8) Baird D. J., Soares A. M. V. M., Girling A., Barber J., Bradley M. C. and Calow P. (1989). The long term maintenance of Daphnia magna Straus for use in ecotoxicological tests; problems and prospects. In: Proceedings of the 1st European Conference on Ecotoxicology. Copenhagen 1988 (H.Løkke, H. Tyle & F. Bro-Rasmussen. Eds.), pp. 144-148.
(9) Parkhurst B. R., Forte J. L. and Wright G. P. (1981). Reproducibility of a life-cycle toxicity test with Daphnia magna. Bull. Environ. Contam. and Toxicol., 26, pp. 1-8.
(10) Cowgill U. M. and Milazzo D. P. (1990) The sensitivity of two cladocerans to water quality variables: salinity and hardness. Arch. Hydrobiol., 120(2), pp. 185-196.
(11) Korshikov (1990). Pseudokirchneriella subcapitata Hindak, F-1990. Biologice Prace, 36, 209.
(12) Sims I. R., Watson S. and Holmes D. (1993). Toward a standard Daphnia juvenile production test. Environmental Toxicology and Chemistry, 12, pp. 2053-2058.
(13) Sims I. (1993). Measuring the growth of phytoplankton: the relationship between total organic carbon with three commonly used parameters of algal growth. Arch. Hydrobiol., 128, pp. 459-466.
(14) Dunnett C. W., (1955). a multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statist. Assoc., 50, pp. 1096-1121.
(15) Dunnett C. W., (1964). New tables for multiple comparisons with a control. Biometrics, 20, pp. 482-491.
(16) Williams D. A. (1971). a test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, pp. 103-117.
(17) Williams D. A. (1972). The comparison of several dose levels with a zero dose control. Biometrics, 28, pp. 510-531.
(18) Draper N. R. and Smith H. (1981). Applied Regression Analysis, second edition, Wiley, N.Y.
(19) Brain P. and Cousens R. (1989). An equation to describe dose responses where there is stimulation of growth at low doses. Weed Research, 29, pp. 93-96.
(20) Wilson E. O. and Bossert, W. H. (1971). a Primer of Population Biology. Sinauer Associates Inc. Publishers.
(21) Poole R. W. (1974). An Introduction to quantitative Ecology. McGraw-Hill Series in Population Biology, New York, pp. 532.
(22) Meyer J. S., Ingersoll C. G., McDonald L. L. and Boyce M. S. (1986). Estimating uncertainty in population growth rates: Jackknife vs bootstrap techniques. Ecology, 67, pp. 1156-1166.
Herstellung der vollständig definierten Medien ELENDT M7 UND M4
Gewöhnung an die Medien Elendt M7 und M4
Einige Prüfeinrichtungen haben Schwierigkeiten, Daphnien direkt in die Medien M4 (1) und M7 umzusetzen. Erfolg wurde jedoch mit einer schrittweisen Eingewöhnung erzielt, d. h. dem Wechsel von dem eigenen Medium in 30%iges Elendt, dann in 60%iges Elendt und dann in 100%iges Elendt. Die Eingewöhnungszeiten können dabei durchaus einen Monat betragen.
Herstellung
Spurenelemente
Zunächst werden gesonderte Stammansätze (I) einzelner Spurenelemente in Wasser mit geeignetem Reinheitsgrad, z.B. entionisiertes oder destilliertes Wasser oder Wasser aus umgekehrter Osmose, hergestellt. Aus diesen unterschiedlichen Stammansätzen (I) wird ein zweiter alleiniger Stammansatz (II) hergestellt, der alle Spurenelemente enthält (kombinierte Lösung),
d. h.: Stammansätze I (einzelne Substanz)
| Stammansatz I (einzelne Substanze) |
Wasser zugesetzte Menge (mg/l) | Konzentration (in Verhältnis zum Medium M4) (xfach) | Zur Herstellung des kombinierten Stammansatzes II zu Wasser die folgende Menge an zugeben (ml/l) | |
| M 4 | M 7 | |||
| H3BO3 | 57.190 | 20.000 | 1,0 | 0,25 |
| MnCl2 ξ 4 H2O | 7210 | 20.000 | 1,0 | 0,25 |
| LiCl | 6120 | 20.000 | 1,0 | 0,25 |
| RbCl | 1420 | 20.000 | 1,0 | 0,25 |
| SrCl2 ξ 6H2O | 3040 | 20.000 | 1,0 | 0,25 |
| NaBr | 320 | 20.000 | 1,0 | 0,25 |
| Na2MoO4 ξ 2 H2O | 1260 | 20.000 | 1,0 | 0,25 |
| CuCl2 ξ 2 H2O | 335 | 20.000 | 1,0 | 0,25 |
| ZnCl2 | 260 | 20.000 | 1,0 | 1,0 |
| CoCl2 ξ 6 H2O | 200 | 20.000 | 1,0 | 1,0 |
| KI | 65 | 20.000 | 1,0 | 1,0 |
| Na2SeO3 | 43,8 | 20.000 | 1,0 | 1,0 |
| NH4VO3 | 11,5 | 20.000 | 1,0 | 1,0 |
| Na2EDTa ξ 2 H2O | 5000 | 2000 | - | - |
| FeSO4 ξ 7 H2O | 1991 | 2000 | - | - |
| Sowohl die Na2EDTA- als auch die FeSO4-Lösung werden einzeln hergestellt, zusammengegossen und sofort im Autoklaven behandelt. Dies ergibt: | ||||
| 21 Fe-EDTA-Lösung | 1000 | 20,0 | 5,0 | |
Medien M4 und M7
Die Medien M4 und M7 werden anhand des Stammansatzes II, der Makronährstoffe und Vitamine wie folgt hergestellt:
| Wasser zugesetzte Menge (mg/l) | Konzentration (in Verhältnis zum Medium M4) (xfach) | Zur Herstellung des kombinierten Stammansatzes II zu Wasser die folgende Menge an zugeben (ml/l) | |||||
| M 4 | M 7 | ||||||
| Stammansatz II kombinierte Spurenelemente | 20 | 50 | 50 | ||||
| Makronährstoff-Stammansätze (einzelne Substanz) | |||||||
| CaCl2 ξ 2 H2O | 293.800 | 1000 | 1,0 | 1,0 | |||
| MgSO4 ξ 7 H2O | 246.600 | 2000 | 0,5 | 0,5 | |||
| KCl | 58.000 | 10.000 | 0,1 | 0,1 | |||
| NaHCO3 | 64.800 | 1000 | 1,0 | 1,0 | |||
| Na2SiO3 ξ 9 H2O | 50.000 | 5000 | 0,2 | 0,2 | |||
| NaNO3 | 2740 | 10.000 | 0,1 | 0,1 | |||
| KH2PO4 | 1430 | 10.000 | 0,1 | 0,1 | |||
| K2HPO4 | 1840 | 10.000 | 0,1 | 0,1 | |||
| Kombinierter Vitaminstammansatz | - | 10.000 | 0,1 | 0,1 | |||
| Der kombinierte Vitaminstammansatz wird hergestellt, indem man die 3 Vitamine einem Liter Wasser zusetzt, wie im Folgenden angegeben: | |||||||
| Thiaminhydrochlorid | 750 | 10.000 | - | - | |||
| Cyanocobalamine | 10 | 10.000 | - | - | |||
| Biotine | 7,5 | 10.000 | - | - | |||
| Der kombinierte Vitaminstammansatz wird in kleinen Portionen tiefgefroren aufbewahrt. Vitamine werden den Medien kurz vor der Verwendung zugesetzt.
Hinweise: Um die Ausfällung von Salzen bei der Herstellung der vollständigen Medien zu vermeiden, die Portionen von Stammansätzen in etwa 500 bis 800 ml Wasser entionsiertes Wasser geben und dann auf 1 Liter auffüllen. Erstmals in einer Publikation erwähnt wird das Medium M4 bei Elendt, B.P. (1990). Selenium deficiency in crustacea; an ultrastructural approach to antennal damage in Daphnia magna Straus. Protoplasma, 154, 25-33. |
|||||||
Analyse des gesamten organischen Kohlenstoffs (TOC) und Erstellung von Nomogrammen für den TOC-Gehalt von Algenfutter
Bekanntermaßen wird der Kohlenstoffgehalt des Algenfutters normalerweise nicht direkt gemessen, sondern aus Korrelationen (d. h. Nomogrammen) mit Ersatzgrößen wie der Algenzellenzahl oder der Lichtextinktion abgeleitet.
Der TOC sollte eher durch Oxidation bei hoher Temperatur als durch UV- oder Persulfatmethoden gemessen werden (siehe hierzu auch: The Instrumental Determination of Total Organic Carbon, Total Oxygen Demand and Related Determinands 1979, HMSO 1980; 49 High Holborn, London WC1V 6HB).
Für die Erstellung von Nomogrammen sollten die Algen durch Zentrifugierung von dem Wachstumsmedium getrennt werden, gefolgt von einer Resuspension in destilliertem Wasser. Den Ersatzparameter und die TOC-Konzentration in jeder Probe in einer Dreifachwiederholung messen. Es sollten Blindproben des destillierten Wassers analysiert und die TOC-Konzentration von der TOC-Konzentration in der Algenprobe abgeleitet werden.
Nomogramme sollten über den geforderten Bereich von Kohlenstoffkonzentrationen linear verlaufen. Beispiele hierzu finden sich weiter unten.
Hinweis: Diese Beispiele sollten nicht für Umrechnungen herangezogen werden; wichtig ist, dass die Prüfeinrichtungen ihre eigenen Nomogramme erstellen.
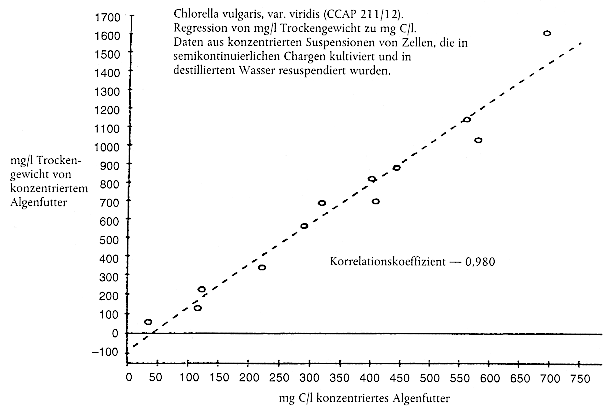
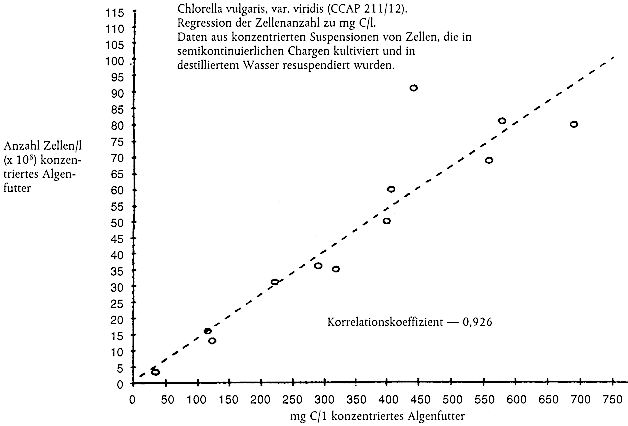
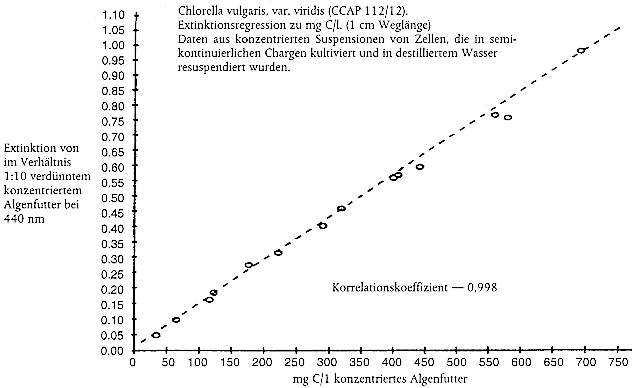
Beispieldatenblatt zur Protokollierung der Erneuerung des Prüfmediums, von physikalisch-chemischen Überwachungsdaten, der Fütterung, Daphnien-Reproduktion und Mortalität von erwachsenen Tieren
Versuch Nr. Ausgangsdaten: Klon: Medium: Futterart: Prüfsubstanz: NominaleKonz.:
| Tag | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | ||
| Mediumerneuerung (ankreuzen) | ||||||||||||||||||||||||
| pH-Wert (1) | neu | |||||||||||||||||||||||
| alt | ||||||||||||||||||||||||
| O2 mg/l (1) | neu | |||||||||||||||||||||||
| alt | ||||||||||||||||||||||||
| Temp.(°C) (1) | neu | |||||||||||||||||||||||
| alt | ||||||||||||||||||||||||
| Geb. Futter(ankreuzen) | ||||||||||||||||||||||||
| Anz. leb. Nachkommen (2) | Gesamt | |||||||||||||||||||||||
| Gefäß 1 | ||||||||||||||||||||||||
| 2 | ||||||||||||||||||||||||
| 3 | ||||||||||||||||||||||||
| 4 | ||||||||||||||||||||||||
| 5 | ||||||||||||||||||||||||
| 6 | ||||||||||||||||||||||||
| 7 | ||||||||||||||||||||||||
| 8 | ||||||||||||||||||||||||
| 9 | ||||||||||||||||||||||||
| 10 | ||||||||||||||||||||||||
| Gesamt | ||||||||||||||||||||||||
| Kumulative Mortalität bei erwachs. Tieren3 | ||||||||||||||||||||||||
| 1) Angeben, welches Gefäß für den Versuch verwendet wurde. 2) Unreife Bruten als "AB" in dem betreffenden Kästchen protokollieren. 3) Die Mortalität von erwachsenen Tieren als "M" in dem betreffenden Kästchen protokollieren.. |
||||||||||||||||||||||||
Beispieldatenblatt zur Protokollierung von Ergebnissen der chemischen Analyse
a) Gemessene Konzentrationen Nominale Konz.
| Nominale Konz. | Woche 1 Probe | Woche 2 Probe | Woche 3 Probe | |||
| Frisch | Alt | Frisch | Alt | Frisch | Alt | |
| |
||||||
b) Gemessene Konzentrationen in Prozent der Nominalkonzentrationen
| Nominale Konz. | Woche 1 Probe | Woche 2 Probe | Woche 3 Probe | |||
| Frisch | Alt | Frisch | Alt | Frisch | Alt | |
| |
||||||
Berechnung eines zeitgewichteten Mittels
Zeitgewichtetes Mittel
In Anbetracht der Tatsache, dass sich die Konzentration der Prüfsubstanz während des Zeitraums zwischen den Erneuerungen des Prüfmediums verringern kann, muss überlegt werden, welche Konzentration als für den Konzentrationsbereich, dem die Elterndaphnien ausgesetzt werden, repräsentativ ausgewählt werden sollte. Die Auswahl sollte dabei sowohl auf biologischen als auch auf statistischen Erwägungen beruhen. Wenn man beispielsweise davon ausgeht, dass die Reproduktion am stärksten durch die zur Anwendung kommende Spitzenkonzentration beeinflußt wird, dann sollte die maximale Konzentration herangezogen werden. Wenn jedoch die kumulierte oder längerfristige Wirkung der toxischen Substanz für wichtiger gehalten wird, dann hat eine Durchschnittskonzentration eine größere Relevanz. In diesem Fall besteht ein geeigneter anzusetzender Durchschnittswert aus der zeitgewichteten mittleren Konzentration, da hierbei die Streubreite der Augenblickskonzentration im Laufe der Zeit berücksichtigt wird.
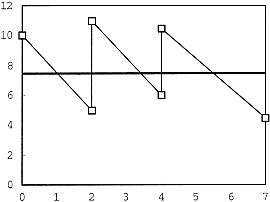
Bild 1: Beispiel für ein zeitgewichtetes Mittel
Bild 1 zeigt ein Beispiel für eine (vereinfachte) Prüfung, die 7 Tage dauert und bei der an Tag 0, 2 und 4 das Prüfmedium erneuert wird.
Das zeitgewichtete Mittel wird so berechnet, dass die Fläche unterhalb des zeitgewichteten Mittels gleich der Fläche unterhalb der Konzentrationskurve ist. Die Berechnung für das obengenannte Beispiel wird in Tabelle 1 dargestellt.
table 1: Berechnung des zeitgewichteten Mittels
| Erneuerung Nr. | Tage | Konz0 | Konz1 | Ln(Konz0) | Ln(Konz1) | Fläche |
| 1 | 2 | 10,000 | 4,493 | 2,303 | 1,503 | 13,767 |
| 2 | 2 | 11,000 | 6,037 | 2,398 | 1,789 | 16,544 |
| 3 | 3 | 10,000 | 4,066 | 2,303 | 1,403 | 19,781 |
| Gesamtanzahl Tage: 7 | Gesamtfläche | 50,091 | ||||
| Zeitgew. Mittel | 7,156 | |||||
"Tage" steht für die Anzahl von Tagen des Erneuerungszeitraums.
"Konz0" ist die gemessene Konzentration zu Beginn eines jeden Erneuerungszeitraums.
"Konz1" ist die gemessene Konzentration am Ende eines jeden Erneuerungszeitraums.
"Ln(Konz0)" ist der natürliche Logarithmus von Konz0.
"Ln(Konz1)" ist der natürliche Logarithmus von Konz1.
"Fläche" ist die Fläche unter der exponentiellen Kurve für jeden Erneuerungszeitraum. Sie wird wie folgt berechnet:
| Konz0 - Konz1 | ||
| Fläche = | × Tage | |
| Ln(Konz0) - Ln/Konz1) |
Das zeitgewichtete Mittel (zeitgew. Mittel) ist gleich der - Gesamtfläche - dividiert durch die "Gesamtanzahl Tage"
Natürlich müsste die Tabelle für die Daphnien-Reproduktionsprüfung auf einen Zeitraum von 21 Tagen erweitert werden.
Klar ist, dass, wenn Beobachtungen nur am Anfang und am Ende eines jeden Erneuerungszeitraums erfolgen, nicht bestätigt werden kann, ob der Zerfallsprozess tatsächlich exponentiell verläuft. Eine andere Kurve würde zu einer anderen Berechnung für die "Fläche" führen. Jedoch ist ein exponentieller Zerfallsprozess durchaus plausibel und wahrscheinlich die beste Kurve, die bei Fehlen anderer Informationen zu verwenden ist.
Vorsicht ist allerdings geboten, wenn in der chemischen Analyse am Ende des Erneuerungszeitraums keine Substanz gefunden wird. Sofern keine Möglichkeit besteht, abzuschätzen, wie schnell die Substanz aus der Lösung verschwunden ist, ist es unmöglich, eine realistische Fläche unter der Kurve zu erhalten, und damit auch unmöglich, ein vernünftiges zeitgewichtetes Mittel zu bestimmen.
 |
weiter . |  |
(Stand: 04.08.2022)
Alle vollständigen Texte in der aktuellen Fassung im Jahresabonnement
Nutzungsgebühr: ab 105.- € netto
(derzeit ca. 7200 Titel s.Übersicht - keine Unterteilung in Fachbereiche)
Die Zugangskennung wird kurzfristig übermittelt
? Fragen ?
Abonnentenzugang/Volltextversion