

 |
zurück |  |
| Bestimmung der Ökotoxizität
Teil V: Manometrischer Respirationstest |
Anhang V zur RL 67/548/EWG |
C.4. V.1. Prinzip der Methode
Ein definiertes Volumen des angeimpften mineralischen Mediums mit einer bekannten Konzentration der Prüfsubstanz (100 mg/l), die einem ThSB von mindestens 50-100 mg/l entsprechen als einziger nomineller Quelle organischen Kohlenstoffs, wird in einer geschlossenen Flasche bei konstanter Temperatur (± 1 °C oder genauer) bis zu 28 Tage gerührt. Der Sauerstoffverbrauch wird entweder durch Messung der (elektrolytisch erzeugten) Sauerstoffmenge bestimmt, die erforderlich ist, um in der Respirometerflasche ein konstantes Gasvolumen aufrechtzuerhalten, oder aus der Änderung des Volumens oder Drucks im Gerät (bzw. einer Kombination beider Parameter). Das entstandene Kohlendioxid wird in einer Lösung von Kaliumhydroxid oder einem anderen geeigneten Absorptionsmittel absorbiert. Die Menge des von der Prüfsubstanz aufgenommenen Sauerstoffs wird (nach Berücksichtigung des entsprechenden Wertes in dem parallel mitgeführten Inokulum-Blindversuchs) als prozentualer Anteil des ThSB oder CSB angegeben. Wahlweise, läßt sich Totalabbau durch DOC-Analyse, primärer biologischer Abbau auch aus einer ergänzenden spezifischen Analyse errechnen, die zu Beginn und am Ende der Inkubation vorgenommen wird.
C.4-D. V.2. Beschreibung der Methode
C.4-D. V.2.1. Geräte
C.4-D. V.2.2. Ansatz des mineralischen Mediums
Zubereitung der Stammlösungen siehe I.6.2.
10 ml Lösung (a) mit 800 ml Verdünnungswasser mischen, 1 ml der Lösungen (b) bis (d) hinzugeben und mit Verdünnungswasser auf 1 l auffüllen.
C.4-D. V.2.3. Ansatz und Vorbereitung des Inokulums
Das Inokulum kann aus verschiedenen Quellen gewonnen werden: aus Belebtschlamm, aus Kläranlagenablauf, aus Oberflächenwasser, aus Böden oder aus mehreren dieser Quellen zugleich.
Vgl. I.6.4., I.6.4.1., I.6.4.2. und I.6.5.
C.4-D. V.2.4. Ansatz der Flaschen
Lösungen der Prüf- und Referenzsubstanz sind aus den Stammlösungen in getrennten Ansätzen in einer Konzentration von normalerweise 100 mg/l Substanz entsprechend einem ThSB von mindestens 50-100 mg/l zuzubereiten.
Der ThSB ist auf der Grundlage der Bildung von Ammoniumsalzen zu berechnen, sofern nicht eine Nitrifikation zu erwarten ist, bei der die Berechnung auf der Grundlage einer Nitratbildung vorzunehmen ist (siehe Anhang II.2.).
Die pH-Werte sind zu bestimmen und, falls erforderlich, auf 7,4 ± 0,2 einzustellen.
Schwerlösliche Substanzen sollten zu einem späteren Zeitpunkt hinzuzugeben werden (siehe unten).
Wenn die Toxizität der Prüfsubstanz bestimmt werden soll, ist eine weitere Lösung in mineralischem Medium anzusetzen, die sowohl die Prüf- als auch die Referenzsubstanz enthält, und zwar in denselben Konzentrationen wie bei den Einzelansätzen.
Soweit die Messung der physikalisch-chemischen Sauerstoffaufnahme erforderlich ist, ist eine durch Zugabe einer geeigneten toxischen Substanz sterilisierte Lösung mit der Prüfsubstanz, entsprechend einem ThSB von normalerweise 100 mg/l, anzusetzen (vgl. I.6.6.).
Die erforderliche Menge der Lösungen der Prüf- und der Referenzsubstanz wird jeweils auf zwei Flaschen verteilt. Daneben sind weitere Flaschen nur mit dem mineralischen Medium (für die Inokulum-Kontrollen) und, falls erforderlich, mit der gemischten Prüf-/Referenzlösung und mit der sterilen Lösung anzusetzen.
Handelt es sich um eine schwerlösliche Prüfsubstanz, wird diese gewichts- oder volumenbezogen zu diesem Zeitpunkt direkt in die Gefäßes gegeben oder nach Anhang III behandelt. In die CO2-Absorptionsflaschen sind Kaliumhydroxid, Natronkalk-Pellets oder ein anderes Absorptionsmittel zu geben.
C.4-D. V.2.5. Anzahl der Flaschen in einem typischen Durchgang
Flaschen 1 und 2: Prüfsuspension
Flaschen 3 und 4: Inokulum-Blindwert
Flasche 5: Verfahrenskontrolle.
Empfohlen und falls notwendig:
Flasche 6: Sterilkontrolle
Flasche 7: Toxizitätskontrolle
Vgl. I.6.7.
C.4-D. V.2.6. Durchführung der Prüfung
Nachdem die Gefäßes die gewünschte Temperatur erreicht haben, werden sie mit vorbereitetem Belebtschlamm oder einem Inokulum anderer Herkunft in einer Konzentration von nicht mehr als 30 mg suspendierter Feststoffe pro Liter beimpft. Danach wird die Versuchsanordnung zusammengestellt, das Rührgerät angestellt, auf Luftabschluß geprüft und mit der Messung der Sauerstoffaufnahme begonnen. Bis auf die notwendigen Ablesungen sowie täglichen Kontrollen der richtigen Temperatur und des erforderlichen angemessenen Rührens ist gewöhnlich kein weiterer Aufwand notwendig.
Die Sauerstoffaufnahme ist aus den in regelmäßigen und kurzen Abständen abgelesenen Meßwerten zu berechnen; dabei sind die vom Gerätehersteller angegebenen Methoden zu verwenden. Am Ende der Inkubation, normalerweise nach 28 Tagen, sind die pH-Werte der Flascheninhalte zu messen, insbesondere wenn die Sauerstoffaufnahme niedrig ist bzw. über dem ThSBNH4 liegt (für stickstoffhaltige Verbindungen).
Falls erforderlich, sind den Respirometerflaschen am Anfang und am Ende Proben zur DOC-Analyse oder zur spezifischen Analyse zu entnehmen (vgl. Anhang II.4.). Bei der ersten Probenahme ist sicherzustellen, daß das Volumen der in der Flasche verbleibenden Prüfsuspension bekannt ist. Im Falle der Sauerstoffaufnahme einer stickstoffhaltigen Prüfsubstanz, ist die Zunahme der Nitrit- und Nitratkonzentration über einen Zeitraum von 28 Tagen zu bestimmen und der Sauerstoffverbrauch infolge Nitrifikation zu berücksichtigen (Anhang V).
C.4-D. V.3. Daten und Abschlußbericht
C.4-D. V.3.1. Auswertung der Ergebnisse
Die Sauerstoffaufnahme (mg) der Prüfsubstanz nach einer vorgegebenen Zeit (korrigiert um die Sauerstoffaufnahme der Inokulum-Blindkontrolle nach der gleichen Zeit) ist durch das Gewicht der verwendeten Prüfsubstanz zu dividieren. Dadurch erhält man den BSB, ausgedrückt als mg Sauerstoff pro mg Prüfsubstanz:
| BSB = | mg O2-Aufn. der Prüfsubst. mg O2-Aufn. der Blindkontr. | = mg O2 pro mg Prüfsubstanz |
| mg Prüfsubst. in der Flasche |
Der prozentuale biologische Abbau ist zu berechnen entweder nach:
| % biolog. Abbau = % ThSB = | BSB (mg O2/mg Substanz) | |
| x 100, | ||
| ThSB (mgO2/mg Substanz) |
oder nach:
| % CSB = | BSB (mg O2/mg Substanz) | x 100 |
| CSB (mg O2/mg Substanz) |
Dabei ist anzumerken, daß diese beiden Verfahren nicht notwendigerweise denselben Wert ergeben; vorzugsweise sollte das erstere Verfahren angewendet werden.
Bei stickstoffhaltigen Prüfsubstanzen ist, je nachdem ob eine Nitrifikation zu erwarten ist oder nicht, der entsprechende ThSB-Wert (NH4 oder NO3) zu verwenden (Anhang II.2). Bei auftretender, jedoch unvollständiger Nitrifikation, ist aus den Veränderungen der Nitrit- und Nitratkonzentration ein Korrekturfaktor für den durch die Nitrifikation verbrauchten Sauerstoff zu berechnen (Anhang V).
Wenn wahlweise Bestimmungen des organischen Kohlenstoffs und/oder einer Einzelsubstanz vorgenommen werden, ist der prozentuale Abbau entsprechend I.7. zu berechnen.
Sämtliche Ergebnisse sind auf den beigefügten Datenblättern zu protokollieren.
C.4-D. V.3.2. Gültigkeit der Ergebnisse
Die Sauerstoffaufnahme des Inokulum-Blindwertes liegt normalerweise bei 20-30 mg/l O2 und sollte nach 28 Tagen nicht größer sein als 60 mg/l. Bei Werten über 60 mg/l sollten die Daten und Versuchsdurchführung kritisch überprüft werden. Wenn der pH-Wert außerhalb des Bereichs 6-8,5 liegt und der Sauerstoffverbrauch durch die Prüfsubstanz unter 60 % beträgt, ist der Test mit einer geringeren Konzentration der Prüfsubstanz zu wiederholen.
Vgl. auch I.5.2.
C.4-D. V.3.3. Abschlußbericht
Vgl. I.8.
C.4-D. V.4. Datenblatt
Nachstehend ein Beispiel eines Datenblattes.
Manometrischer Respirationstest
Name:
Konzentration der Stammlösung: ... mg/l
Anfangskonzentration im Medium, Co: ... mg/l
Volumen in der Prüfflasche (V): ... ml
ThSB/CSB: ... mg O2/mg Prüfsubstanz (NH4, NO3)
Herkunft: ...
Vorgenommene Behandlung: ...
Vorbereitung/Konditionierung (soweit zutreffend): ...
Konzentration der suspendierten Feststoffe im Reaktionsgemisch: ... mg/l
| 0 | 7 | 14 | 21 | 28 | |||||||||
| O2, Aufn. (mg) Prüfsubstanz. | 1 | ||||||||||||
| 2 | |||||||||||||
| a, Mittelwert | |||||||||||||
| O2, Aufn. (mg) Blindwert | 1 | ||||||||||||
| 2 | |||||||||||||
| b, Mittelwert | |||||||||||||
| Korrigierter BSD (mg) | (a1-bm) | ||||||||||||
| (a2-bm) | |||||||||||||
| BSB pro mg Prüfsubstanz | (a1-b)/C0V | ||||||||||||
| (a2-b)/C0V | |||||||||||||
| % Abbau
BSB/ThSBξ 100 |
D1 (a1) | ||||||||||||
| D2 (a1) | |||||||||||||
| Mittelwert* | |||||||||||||
| V = Volumen des Mediums in der Prüfflasche * Bei erheblichen Unterschied sollten D1 und D2 nicht gemittelt werden |
|||||||||||||
Anmerkung: Für die Referenzsubstanz sowie Toxizitätskontrolle können ähnliche Formblätter verwendet werden.
| Tag | 0 | 28 | Differenz |
| (i) Nitritkonzentration (mg N/l) | (N) | ||
| (ii) Sauerstoffäquivalent (4,57 ξ N x V) (mg) | - | - | |
| (iii) Nitrikonzentration (mg N/l) | (N) | ||
| (iv) Sauerstoffäquivalent (3,43 ξ N x V) (mg) | - | - | |
| (ii + iv) Gesamtsauerstoffäquivalent | - | - |
Kohlenstoffanalysator: ...
| Zeit (Tag) |
Blindversuch (mg/l) |
Prüfsubstanz (mg/l) |
| 0 | Cb(0) | C0 |
| 28 (*) | Cb(t) | C(t) |
| *) oder am Ende der Inkubation | ||

Sb = Konzentration der Prüfsubstanz in der physikalisch-chemischen (steril-) Kontrolle nach 28 Tagen
Sa = Konzentration in der angeimpften Flasche nach 28 Tagen
% biologischer Primärabbau =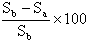
a = Sauerstoffverbrauch in sterilen Flaschen nach 28 Tagen (mg)
Sauerstoffverbrauch pro mg Prüfsubstanz = a / C0V
(vgl. Abschnitte 1 und 3)
% abiotischer Abbau = (a x 100) / (C0V ξ ThSB)
 |
weiter . |  |
(Stand: 04.08.2022)
Alle vollständigen Texte in der aktuellen Fassung im Jahresabonnement
Nutzungsgebühr: ab 105.- € netto
(derzeit ca. 7200 Titel s.Übersicht - keine Unterteilung in Fachbereiche)
Die Zugangskennung wird kurzfristig übermittelt
? Fragen ?
Abonnentenzugang/Volltextversion