

umwelt-online: Verordnung (EG) Nr. 1272/2008 über die Einstufung, Kennzeichnung und Verpackung von Stoffen und Gemischen (6)
 |
zurück |  |
3.7.2.5 Tierversuchs- und Prüfdaten
3.7.2.5.1 Es sind eine ganze Reihe international akzeptierter Versuchsmethoden verfügbar; sie umfassen Methoden für die Prüfung auf Entwicklungstoxizität (z.B. OECD-Prüfungsleitlinie ) sowie Methoden für toxikologische Untersuchungen über eine oder zwei Generationen (z.B. OECD-Leitlinien 415 und ).
3.7.2.5.2 Auch die Ergebnisse von Screeningtests (z.B. OECD-Leitlinien 421 - Screeningtest zur Prüfung der Reproduktions-/Entwicklungstoxizität und 422 - Toxizitätsstudie mit kombinierter oraler Verabreichung mit Screeningtest zur Prüfung der Reproduktions-/Entwicklungstoxizität) können zur Begründung einer Einstufung dienen, obwohl unstrittig ist, dass diese Nachweise weniger zuverlässig sind als durch umfassende Studien gewonnene Nachweise.
3.7.2.5.3 In kurz- oder langfristigen Toxizitätsstudien mit wiederholter Verabreichung festgestellte schädliche Wirkungen oder Veränderungen, die die Fortpflanzungsfunktion wahrscheinlich beeinträchtigen und die trotz Fehlens einer relevanten allgemeinen Toxizität auftreten, können als Einstufungsgrundlage dienen (so zum Beispiel histopathologische Veränderungen an den Gonaden).
3.7.2.5.4 Nachweise, die aus In-vitro-Assays oder Versuchen an anderen Tieren als Säugern und mit Hilfe der Struktur-Wirkungs-Beziehung (SAR) aus analogen Stoffen gewonnen wurden, können zur Einstufung beitragen. In allen derartigen Fällen sind die Daten von Experten im Hinblick auf ihre Aussagekraft zu beurteilen. Ungeeignete Daten dürfen keinesfalls als gewichtiges Argument für eine Einstufung dienen.
3.7.2.5.5 Bei Tierstudien sind vorzugsweise geeignete Verabreichungswege zu wählen, die sich an dem beim Menschen möglichen Expositionsweg orientieren. In der Praxis werden Studien zur Reproduktionstoxizität jedoch üblicherweise mit oraler Verabreichung durchgeführt; solche Studien eignen sich in der Regel durchaus für die Bewertung der Gefahreneigenschaften eines Stoffes in Bezug auf die Reproduktionstoxizität. Lässt sich jedoch schlüssig nachweisen, dass der/die eindeutig festgestellte Wirkungsmechanismus/-weise für den Menschen nicht relevant ist, oder wenn die toxikokinetischen Unterschiede so ausgeprägt sind, dass die Gefahreneigenschaft mit Sicherheit nicht beim Menschen zum Tragen kommt, dann braucht ein Stoff, der die Fortpflanzung bei Versuchstieren beeinträchtigt, nicht eingestuft zu werden.
3.7.2.5.6 Studien mit Verabreichungswegen wie intravenöse oder intraperitoneale Injektion, die dazu führen, dass die Fortpflanzungsorgane unrealistisch hohen Dosen des Prüfstoffes ausgesetzt werden, oder die auch in Form von Reizung lokale Schäden an den Fortpflanzungsorganen verursachen können, sind mit äußerster Vorsicht zu interpretieren und stellen in der Regel keine alleinige Grundlage für die Einstufung dar.
3.7.2.5.7 Es herrscht allgemein Einigkeit über den Begriff der Grenzdosis, oberhalb deren die Erzeugung einer schädlichen Wirkung nicht mehr als zur Einstufung führendes Kriterium betrachtet wird, nicht jedoch über die Höhe einer konkreten Dosis als Grenzdosis in die Kriterien. In manchen Leitlinien für Prüfverfahren ist aber eine Grenzdosis angegeben, in anderen wiederum ist die Grenzdosis mit dem Hinweis versehen, dass höhere Dosen erforderlich sein können, wenn die vorhergesagte Exposition beim Menschen so hoch ist, dass ein angemessener Abstand zur Expositionshöhe nicht erreicht wird. Auch kann sich die Festlegung einer bestimmten Grenzdosis aufgrund toxikokinetischer Unterschiede zwischen den Arten in jenen Fällen als ungeeignet erweisen, in denen Menschen empfindlicher sind als das Tiermodell.
3.7.2.5.8 Grundsätzlich führen Beeinträchtigungen der Fortpflanzung, die nur bei sehr hohen Dosierungen in Tierversuchen auftreten (beispielsweise bei Dosierungen, die zum Zustand höchster Erschöpfung, starker Appetitlosigkeit, erhöhter Mortalität führen), normalerweise nicht zur Einstufung, sofern nicht andere Informationen verfügbar sind, wie etwa toxikokinetische Untersuchungen, die darauf hindeuten, dass Menschen empfindlicher als Tiere reagieren, so dass eine Einstufung angebracht erscheint. Weitere Anleitungen für diesen Bereich finden sich im Abschnitt über maternale Toxizität ( 3.7.2.4).
3.7.2.5.9 Die Festlegung der tatsächlichen "Grenzdosis" wird jedoch davon abhängen, mit welchem Prüfverfahren die Prüfergebnisse erzielt wurden, z.B. wird in der OECD-Prüfungsleitlinie für Toxizitätsstudien mit wiederholter oraler Verabreichung ein oberer Dosisgrenzwert von 1000 mg/kg empfohlen, sofern die erwartete Reaktion beim Menschen nicht eine höhere Dosierung erfordert.
3.7.3 Einstufungskriterien für Gemische
3.7.3.1 Einstufung von Gemischen, wenn Daten für alle oder nur manche Bestandteile des Gemisches vorliegen
3.7.3.1.1 Das Gemisch wird als reproduktionstoxisch eingestuft, wenn mindestens ein Bestandteil als reproduktionstoxisch der Kategorie 1A, der Kategorie 1B oder der Kategorie 2 eingestuft worden ist und seine Konzentration den jeweiligen allgemeinen Konzentrationsgrenzwert für Kategorie 1A, Kategorie 1B und Kategorie 2 gemäß Tabelle 3.7.2 erreicht oder übersteigt.
3.7.3.1.2 Das Gemisch wird aufgrund seiner Wirkungen auf oder über die Laktation eingestuft, wenn mindestens ein Bestandteil aufgrund seiner Wirkungen auf oder über die Laktation eingestuft worden ist und seine Konzentration den allgemeinen Konzentrationsgrenzwert für die Zusatzkategorie der Wirkungen auf oder über die Laktation gemäß Tabelle 3.7.2 erreicht oder diesen übersteigt.
Tabelle 3.7.2: Allgemeine Konzentrationsgrenzwerte der als reproduktionstoxisch oder aufgrund ihrer Wirkungen auf oder über die Laktation eingestuften Bestandteile eines Gemisches, die zur Einstufung des Gemisches führen13
| Bestandteil eingestuft als: | Allgemeine Konzentrationsgrenzwerte, die zu folgender Einstufung eines Gemisches führen: | |||
| Kategorie 1 reproduktionstoxisch | Kategorie 2 reproduktionstoxisch | Zusatzkategorie für Wirkungen auf/über Laktation | ||
| Kategorie 1A | Kategorie 1B | |||
| Kategorie 1a reproduktionstoxisch | > 0,3 % (Hinweis 1) |
|||
| Kategorie 1B reproduktionstoxisch | > 0,3 % (Hinweis 1) |
|||
| Kategorie 2 reproduktionstoxisch | > 3,0 % (Hinweis 1) |
|||
| Zusatzkategorie für Wirkungen auf/ über Laktation | > 0,3 % (Hinweis 1) |
|||
|
||||
3.7.3.2 Einstufung von Gemischen, bei denen Daten für das komplette Gemisch vorliegen
3.7.3.2.1 Die Einstufung von Gemischen beruht auf den verfügbaren Testdaten für die einzelnen Bestandteile des Gemisches, wobei Konzentrationsgrenzwerte für die Bestandteile des Gemisches gelten. Versuchsdaten für Gemische sind im Einzelfall zur Einstufung heranzuziehen, wenn sie Wirkungen nachweisen, die eine Beurteilung der einzelnen Bestandteile nicht erkennen ließ. In solchen Fällen ist nachzuweisen, dass die Versuchsergebnisse für das Gemisch insgesamt schlüssig sind, wobei die Dosis und weitere Faktoren wie Dauer, Beobachtungen, Empfindlichkeit und statistische Analyse der Testsysteme zur Reproduktionstoxizität zu berücksichtigen sind. Es sind geeignete Unterlagen zur Begründung der Einstufung aufzubewahren und auf Verlangen zur Überprüfung vorzulegen.
3.7.3.3 Einstufung von Gemischen, bei denen keine Daten für das komplette Gemisch vorliegen: Übertragungsgrundsätze
3.7.3.3.1 Vorbehaltlich des Abschnittes 3.7.3.2.1 gilt: Wurde das Gemisch selbst nicht auf seine Reproduktionstoxizität geprüft, liegen jedoch ausreichende Daten über seine einzelnen Bestandteile und über ähnliche geprüfte Gemische vor, um die Gefahren des Gemisches angemessen zu beschreiben, dann sind diese Daten nach Maßgabe der Übertragungsgrundsätze des Abschnitts 1.1.3 zu verwenden.
3.7.4 Gefahrenkommunikation
3.7.4.1 Bei Stoffen oder Gemischen, die die Kriterien für die Einstufung in diese Gefahrenklasse erfüllen, sind die Kennzeichnungselemente gemäß Tabelle 3.7.3 zu verwenden.
Tabelle 3.7.3: Kennzeichnungselemente für Reproduktionstoxizität13
| Einstufung | Kategorie 1 (Kategorien 1A, 1B) |
Kategorie 2 | Zusatzkategorie für Wirkungen auf/über Laktation |
| GHS-Piktogramm |  |
 |
Kein Piktogramm |
| Signalwort | Gefahr | Achtung | Kein Signalwort |
| Gefahrenhinweis | H360: Kann die Fruchtbarkeit beeinträchtigen oder das Kind im Mutterleib schädigen (sofern bekannt, konkrete Wirkung angeben) (Expositionsweg angeben, sofern schlüssig belegt ist, dass diese Gefahr bei keinem anderen Expositionsweg besteht) |
H361: Kann vermutlich die Fruchtbarkeit beeinträchtigen oder das Kind im Mutterleib schädigen (sofern bekannt, konkrete Wirkung angeben) (Expositionsweg angeben, sofern schlüssig belegt ist, dass diese Gefahr bei keinem anderen Expositionsweg besteht) | H362: Kann Säuglinge über die Muttermilch schädigen |
| Sicherheitshinweise - Prävention | P201 P202 P280 |
P201 P202 P280 |
P201 P260 P263 P264 P270 |
| Sicherheitshinweise - Reaktion | P308 + P313 | P308 + P313 | P308 + P313 |
| Sicherheitshinweise - Lagerung | P405 | P405 | |
| Sicherheitshinweise - Entsorgung | P501 | P501 |
3.8 Spezifische Zielorgan-Toxizität (einmalige Exposition)
3.8.1 Begriffsbestimmungen und allgemeine Erwägungen
3.8.1.1Spezifische Zielorgan-Toxizität (einmalige Exposition): die spezifische nichtletale Zielorgan-Toxizität nach einmaliger Exposition gegenüber einem Stoff oder Gemisch. Dazu gehören alle eindeutigen Auswirkungen auf die Gesundheit, die Körperfunktionen beeinträchtigen können, unabhängig davon, ob sie reversibel oder irreversibel sind, unmittelbar und/oder verzögert auftreten, sofern sie nicht ausdrücklich in den Abschnitten 3.1 bis 3.7 und 3.10 behandelt werden (siehe dazu auch Abschnitt 3.8.1.6).
3.8.1.2 Eine Einstufung bedeutet, dass der Stoff oder das Gemisch eine spezifische Zielorgan-Toxizität besitzt und damit die Gesundheit von exponierten Personen beeinträchtigt werden kann.
3.8.1.3 Zu diesen durch einmalige Exposition verursachten schädlichen Auswirkungen auf die Gesundheit gehören konsistente und erkennbare toxische Wirkungen beim Menschen oder - für die menschliche Gesundheit relevante - toxikologisch eindeutige Veränderungen bei Versuchstieren, die die Funktion oder Morphologie eines Gewebes/Organs beeinträchtigt oder ernstzunehmende Veränderungen der Biochemie oder Hämatologie des Organismus hervorgerufen haben.
3.8.1.4 Bei der Beurteilung sind nicht nur eindeutige Veränderungen in einem einzigen Organ oder biologischen System zu berücksichtigen, sondern auch allgemeine Veränderungen geringerer Schwere in mehreren Organen.
3.8.1.5 Eine spezifische Zielorgan-Toxizität kann über sämtliche beim Menschen relevanten Expositionswege auftreten, d. h. hauptsächlich oral, dermal oder nach Inhalation.
3.8.1.6 Die Einstufung aufgrund einer spezifischen Zielorgan-Toxizität nach wiederholter Exposition erfolgt wie in Abschnitt 3.9 (Spezifische Zielorgan-Toxizität - wiederholte Exposition) beschrieben und ist daher nicht Gegenstand des Abschnitts 3.8. Weitere nachstehend aufgeführte spezifische Toxizitätswirkungen werden getrennt beurteilt und fallen daher nicht unter diesen Abschnitt:
3.8.1.7 Die Gefahrenklasse "Spezifische Zielorgan-Toxizität (einmalige Exposition)" wird wie folgt differenziert:
Siehe dazu Tabelle 3.8.1.
Tabelle 3.8.1: Kategorien der spezifischen Zielorgan-Toxizität bei einmaliger Exposition
| Kategorien | Kriterien |
| Kategorie 1 | Stoffe, die beim Menschen eindeutig toxisch wirken oder von denen auf der Grundlage von Befunden aus tierexperimentellen Studien anzunehmen ist, dass sie beim Menschen nach einmaliger Exposition eindeutig toxisch wirken können.
Als zielorgantoxisch (einmalige Exposition) der Kategorie 1 werden Stoffe auf folgender Grundlage eingestuft:
|
| Kategorie 2 | Stoffe, von denen auf der Grundlage von Befunden aus tierexperimentellen Studien angenommen werden kann, dass sie sich bei einmaliger Exposition schädlich auf die menschliche Gesundheit auswirken können.
Als zielorgantoxisch (einmalige Exposition) der Kategorie 2 werden Stoffe auf der Grundlage von Beobachtungen im Rahmen geeigneter tierexperimenteller Studien eingestuft, bei denen es zu eindeutigen toxischen Wirkungen mit Relevanz für die menschliche Gesundheit bei allgemein moderaten Expositionskonzentrationen kam. Richtwerte für Dosis/Konzentration als Hilfe für die Einstufung werden in Abschnitt 3.8.2.1.9 angegeben. In Ausnahmefällen können auch Erfahrungen beim Menschen für eine Einstufung in die Kategorie 2 verwendet werden (siehe Abschnitt 3.8.2.1.9). |
| Kategorie 3 | Reversible Wirkungen auf Zielorgane
Unter diese Kategorie fallen nur narkotisierende Wirkungen und Atemwegsreizungen. Dabei handelt es sich um Wirkungen auf Zielorgane, bei denen ein Stoff die obigen Kriterien für eine Einstufung in die Kategorien 1 oder 2 nicht erfüllt. Dieses sind Wirkungen, die die menschlichen Körperfunktionen nach der Exposition vorübergehend beeinträchtigen und von denen sich der Mensch in einem angemessenen Zeitraum erholt, ohne dass eine nennenswerte strukturelle oder funktionelle Beeinträchtigung zurückbleibt. Stoffe mit diesen Wirkungen werden gemäß Abschnitt 3.8.2.2 gesondert eingestuft. |
| Hinweis: Es ist zu versuchen, das Hauptzielorgan der toxischen Wirkung zu ermitteln und eine entsprechende Einstufung vorzunehmen, etwa als Hepatotoxin oder Neurotoxin. Die Daten sind sorgfältig zu bewerten und es sind möglichst keine Nebenwirkungen einzubeziehen (Hepatotoxine können sekundäre Wirkungen im Nerven- oder Verdauungssystem hervorrufen). | |
3.8.2 Einstufungskriterien für Stoffe
3.8.2.1 Stoffe der Kategorie 1 und der Kategorie 2
3.8.2.1.1 Stoffe werden jeweils nach ihren unmittelbaren oder verzögerten Wirkungen eingestuft, und zwar mit Hilfe des Urteils von Experten (siehe Abschnitt 1.1.1.) auf der Grundlage einer Gewichtung aller verfügbaren Nachweise, wobei auch die empfohlenen Leitwerte (siehe Abschnitt 3.8.2.1.9) herangezogen werden. Danach werden die Stoffe je nach Art und Schwere der beobachteten Wirkung/-en der Kategorie 1 oder 2 zugeordnet (siehe Tabelle 3.8.1).
3.8.2.1.2 Der/die relevante/-n Expositionsweg/-e sind zu ermitteln, über den/die der eingestufte Stoff Gesundheitsschäden hervorruft (siehe Abschnitt 3.8.1.5.).
3.8.2.1.3 Für die Einstufung ist eine Beurteilung durch Experten (siehe Abschnitt 1.1.1) auf der Grundlage einer Ermittlung der Beweiskraft aller verfügbaren Daten sowie der nachstehenden Kriterien maßgeblich.
3.8.2.1.4 Der Nachweis spezifischer zielorgantoxischer Wirkungen, die eine Einstufung erforderlich machen, erfolgt durch eine Ermittlung der Beweiskraft aller Daten (siehe Abschnitt 1.1.1), einschließlich von Fallstudien sowie epidemiologischer Daten und Tierstudien.
3.8.2.1.5 Die für die Bewertung der spezifischen Zielorgan-Toxizität erforderlichen Informationen stammen entweder von einmaligen Expositionen beim Menschen, beispielsweise häuslicher Exposition, Exposition am Arbeitsplatz oder in der Umwelt, oder aus tierexperimentellen Studien. Standardtierversuche an Ratten oder Mäusen, anhand derer sich die toxischen Wirkungen auf die Zielgewebe/-organe ermitteln lassen, sind akute Toxizitätsstudien, die klinische Beobachtungen sowie detaillierte makroskopische und mikroskopische Untersuchungen umfassen können. Auch Daten aus Studien zur akuten Toxizität an anderen Tierarten können relevante Informationen erbringen.
3.8.2.1.6 In Ausnahmefällen ist es aufgrund der Beurteilung durch Experten angezeigt, bestimmte Stoffe, bei denen es Nachweise für eine spezifische Zielorgan-Toxizität beim Menschen gibt, in die Kategorie 2 einzustufen:
Dosen/Konzentrationswerte beim Menschen sind normalerweise bei der Einstufung nicht zu berücksichtigen und alle verfügbaren Befunde aus Tierstudien müssen mit der Einstufung in die Kategorie 2 vereinbar sein. Mit anderen Worten: Sind zu dem Stoff auch Tierversuchsdaten verfügbar, die eine Einstufung in die Kategorie 1 rechtfertigen, ist der Stoff in die Kategorie 1 einzustufen.
3.8.2.1.7 Wirkungen, die als Argument für eine Einstufung in die Kategorien 1 und 2 gelten
3.8.2.1.7.1 Für eine Einstufung sprechen Befunde, die eine einmalige Exposition gegenüber dem Stoff mit einer übereinstimmenden und identifizierbaren toxischen Wirkung in Zusammenhang bringen.
3.8.2.1.7.2 Erfahrungen beim Menschen sowie zum Beispiel Fallstudien beschränken sich üblicherweise auf Berichte über gesundheitsschädliche Wirkungen mit häufig unklaren Expositionsbedingungen und bieten unter Umständen nicht die wissenschaftlichen Einzelheiten, die aus ordnungsgemäß durchgeführten Tierstudien erschlossen werden können.
3.8.2.1.7.3 Befunde aus geeigneten Tierstudien können in Form klinischer Beobachtungen sowie makroskopischer und mikroskopischer pathologischer Untersuchungen weitaus mehr Details erbringen, so dass häufig Gefahren erkennbar werden, die zwar nicht lebensbedrohlich sind, jedoch auf eine funktionelle Störung hindeuten. Daher müssen sämtliche verfügbaren Befunde und ihre Relevanz für die menschliche Gesundheit im Einstufungsprozess berücksichtigt werden; dazu gehören unter anderem folgende Wirkungen bei Mensch und/oder Tier:
3.8.2.1.8 Wirkungen, die nicht als Argument für eine Einstufung in die Kategorien 1 und 2 gelten
Es ist zu erwähnen, dass auch Wirkungen auftreten können, die eine Einstufung nicht rechtfertigen. Dabei handelt es sich unter anderem um folgende Wirkungen bei Mensch und/oder Tier:
3.8.2.1.9 Richtwerte als Einstufungshilfe bei Kategorie 1 und 2 auf der Grundlage von Befunden aus tierexperimentellen Studien
3.8.2.1.9.1 Als Hilfe bei der Entscheidung, ob und nach welchem Schweregrad (Kategorie 1 oder Kategorie 2) ein Stoff einzustufen ist, werden Dosis-/Konzentrations-"Richtwerte" zur Berücksichtigung der Dosis/Konzentration festgelegt, bei der eindeutige Auswirkungen auf die Gesundheit festgestellt wurden. Hauptargument für solche Richtwerte ist, dass alle Stoffe potenziell toxisch sind und dass es eine bestimmte Dosis/Konzentration geben muss, oberhalb derer eine gewisse toxische Wirkung unstrittig ist.
3.8.2.1.9.2 Werden also bei Tierstudien eindeutige toxische Wirkungen beobachtet, die zu einer Einstufung führen, dann ergibt ein Vergleich der Dosis/Konzentration, bei der diese Wirkungen auftraten, mit den vorgeschlagenen Richtwerten, nützliche Informationen, die dabei helfen können zu beurteilen, ob eine Einstufung erforderlich ist (da die toxischen Wirkungen eine Folge der gefährlichen Eigenschaft/-en und der Dosis/Konzentration sind).
3.8.2.1.9.3 Die Richtwertbereiche (C) für die Einzeldosis-Exposition mit eindeutiger nichtletaler toxischer Wirkung entsprechen denjenigen für Prüfungen zur akuten Toxizität (siehe Tabelle 3.8.2).
Tabelle 3.8.2: Richtwertbereiche nach Einzeldosis-Exposition
|
Leitwertbereiche für: |
||||
| Expositionsweg | Maßeinheiten | Kategorie 1 | Kategorie 2 | Kategorie 3 |
| oral (Ratte) | mg/kg Körpergewicht | C< 300 | 2.000> C > 300 |
Es gelten keine Richtwerteb |
| dermal (Ratte oder Kaninchen) | mg/kg Körpergewicht | C< 1.000 | 2.000> C > 1.000 | |
| inhalativ (Ratte) Gas | ppmV/4h | C< 2.500 | 20.000> C > 2.500 | |
| inhalativ (Ratte) Dampf | mg/l/4h | C< 10 | 20> C > 10 | |
| inhalativ (Ratte) Staub/ Nebel/ Rauch | mg/l/4h | C< 1,0 | 5,0> C >1,0 | |
Hinweis:
|
||||
3.8.2.1.10 Sonstige Erwägungen
3.8.2.1.10.1 Ist ein Stoff lediglich anhand tierexperimenteller Daten charakterisiert (dies ist typisch für neue Stoffe, gilt jedoch auch für zahlreiche Altstoffe), werden im Einstufungsverfahren zur Ermittlung der Beweiskraft unter anderem die Richtwerte für die Dosis/Konzentration herangezogen.
3.8.2.1.10.2 Stehen fundierte Erfahrungen beim Menschen zur Verfügung, die eine spezifische Zielorgan-Toxizitätswirkung belegen, welche zuverlässig einer einmaligen Exposition gegenüber einem Stoff zugeschrieben werden kann, ist der Stoff in der Regel einzustufen. Positive Erfahrungen beim Menschen, unabhängig von der wahrscheinlichen Dosis, sind gegenüber tierexperimentellen Daten höherrangig. Wird ein Stoff nicht eingestuft, weil die beobachtete spezifische Zielorgan-Toxizität als beim Menschen nicht relevant oder eindeutig angesehen wurde, so ist dieser Stoff in der Regel dann doch einzustufen, falls zu einem späteren Zeitpunkt Daten über Fallstudien verfügbar werden, die eine spezifische Zielorgan-Toxizität zeigen.
3.8.2.1.10.3 Ein Stoff, der nicht auf seine spezifische Zielorgan-Toxizität geprüft wurde, kann gegebenenfalls anhand folgender Elemente eingestuft werden: Daten aus einer gesicherten Struktur-Wirkungs-Betrachtung und einer auf der Beurteilung durch Experten basierenden Extrapolation zu einem strukturell verwandten, bereits eingestuften Analogon sowie unter Berücksichtigung weiterer wichtiger Faktoren wie der Bildung gemeinsamer bedeutsamer Metaboliten.
3.8.2.1.10.4 Die Sättigungsdampfkonzentration ist, wenn dies angezeigt ist, als zusätzliches Element zum Gesundheitsschutz heranzuziehen.
3.8.2.2 Stoffe der Kategorie 3: reversible Wirkungen auf Zielorgane
3.8.2.2.1 Kriterien für die Reizung der Atemwege
Für die Einstufung von Stoffen in die Kategorie 3 aufgrund einer Reizung der Atemwege sind folgende Kriterien maßgeblich:
3.8.2.2.2 Kriterien für narkotisierende Wirkungen
Für die Einstufung von Stoffen in die Kategorie 3 aufgrund ihrer narkotisierenden Wirkung sind folgende Kriterien maßgeblich:
3.8.3 Einstufungskriterien für Gemische
3.8.3.1 Gemische werden entweder anhand der Kriterien für Stoffe eingestuft oder wie nachstehend beschrieben. Wie Stoffe sind auch Gemische aufgrund ihrer spezifischen Zielorgan-Toxizität nach einmaliger Exposition einzustufen.
3.8.3.2 Einstufung von Gemischen, bei denen Daten für das komplette Gemisch vorliegen
3.8.3.2.1 Liegen für das Gemisch zuverlässige und gesicherte Befunde aus Erfahrungen beim Menschen oder aus geeigneten Tierstudien vor, wie bei den Kriterien für Stoffe beschrieben, dann ist das Gemisch mit Hilfe einer Ermittlung der Beweiskraft dieser Daten einzustufen (siehe Abschnitt 1.1.1.4.). Bei der Bewertung von Daten zu Gemischen ist sicherzustellen, dass die Ergebnisse nicht aufgrund von Dosis, Dauer, Beobachtung oder Analyse ihre Schlüssigkeit verlieren.
3.8.3.3 Einstufung von Gemischen, bei denen keine Daten für das komplette Gemisch vorliegen: Übertragungsgrundsätze
3.8.3.3.1 Wurde das Gemisch selbst nicht auf seine spezifische Zielorgan-Toxizität geprüft, liegen jedoch ausreichende Daten über seine einzelnen Bestandteile und über ähnliche geprüfte Gemische vor, um die Gefahren des Gemisches angemessen zu beschreiben, dann sind diese Daten nach Maßgabe der Übertragungsgrundsätze des Abschnitts 1.1.3 zu verwenden.
3.8.3.4 Einstufung von Gemischen, wenn Daten für alle oder nur manche Bestandteile des Gemisches vorliegen
3.8.3.4.1 Gibt es keine zuverlässigen Nachweise oder Prüfdaten für das spezifische Gemisch selbst und können die Übertragungsgrundsätze nicht für seine Einstufung verwendet werden, dann beruht die Einstufung des Gemisches auf der Einstufung seiner Bestandteile. In diesem Fall ist das Gemisch als spezifisch zielorgantoxisch (unter Angabe des Organs) nach einmaliger Exposition, einzustufen, wenn mindestens ein Bestandteil als spezifisch zielorgantoxisch der Kategorie 1 oder der Kategorie 2 eingestuft wurde und den entsprechenden allgemeinen Konzentrationsgrenzwert für die Kategorie 1 bzw. die Kategorie 2 gemäß Tabelle 3.8.3 erreicht oder übersteigt.
3.8.3.4.2 Diese allgemeinen Konzentrationsgrenzwerte und anschließenden Einstufungen sind entsprechend auf bei einmaliger Verabreichung spezifisch zielorgantoxische Stoffe anzuwenden.
3.8.3.4.3 Gemische sind jeweils aufgrund ihrer Toxizität bei einmaliger Verabreichung und/oder bei wiederholter Verabreichung einzustufen.
Tabelle 3.8.3: Allgemeine Konzentrationsgrenzwerte von als spezifisch zielorgantoxisch eingestuften Bestandteilen eines Gemisches, die zu einer Einstufung des Gemisches in Kategorie 1 oder Kategorie 2 führen
| Bestandteil eingestuft als: |
Allgemeine Konzentrationsgrenzwerte, die zu einer Einstufung des Gemisches in folgende Kategorie führen: |
|
| Kategorie 1 | Kategorie 2 | |
| Kategorie 1 spezifisch zielorgantoxisch |
Konzentration> 10 % | 1,0 %< Konzentration < 10 % |
| Kategorie 2 spezifisch zielorgantoxisch |
Konzentration> 10 % [(Hinweis 1)] | |
| Hinweis 1: Enthält das Gemisch einen Bestandteil, der als spezifisch zielorgantoxisch der Kategorie 2 eingestuft wurde, in einer Konzentration von> 1,0 %, so wird auf Anforderung ein Sicherheitsdatenblatt für das Gemisch vorgelegt. |
||
3.8.3.4.4 Wenn Giftstoffe, die mehr als ein Organsystem angreifen, kombiniert werden, ist darauf zu achten, dass eine Potenzierung oder Synergismen berücksichtigt werden, denn manche Stoffe können bereits bei einer Konzentration von < 1 % eine Zielorgan-Toxizität bewirken, wenn von anderen Bestandteilen des Gemisches bekannt ist, dass sie seine toxische Wirkung potenzieren.
3.8.3.4.5 Bei der Extrapolierung der Toxizität eines Gemisches, das einen oder mehrere Bestandteile der Kategorie 3 enthält, ist Vorsicht geboten. Hier ist ein allgemeiner Konzentrationsgrenzwert von 20 % zweckmäßig; trotzdem ist zu bedenken, dass dieser Konzentrationsgrenzwert höher oder niedriger sein kann, je nachdem welche/-r Bestandteil/-e der Kategorie 3 enthalten ist/sind, und dass manche Wirkungen, wie die Atemwegsreizung, unterhalb einer bestimmten Konzentration ausbleiben können, während wiederum andere, wie narkotisierende Wirkungen, auch unterhalb dieses 20 %-Werts auftreten können. Hier ist eine Beurteilung durch Experten anzustellen. Atemwegsreizungen und narkotisierende Wirkungen sind getrennt anhand der Kriterien in Abschnitt 3.8.2.2 zu bewerten. Werden Einstufungen aufgrund dieser Gefahren vorgenommen, sollte der Anteil jedes Bestandteils als kumulativ behandelt werden, sofern keine Nachweise dafür vorliegen, dass deren Wirkungen nicht kumulativ sind.
3.8.4 Gefahrenkommunikation
3.8.4.1 Bei Stoffen oder Gemischen, die die Kriterien für die Einstufung in diese Gefahrenklasse erfüllen, sind die Kennzeichnungselemente gemäß Tabelle 3.8.4 zu verwenden.
Tabelle 3.8.4: Kennzeichnungselemente für die spezifische Zielorgan-Toxizität bei einmaliger Exposition13
| Einstufung | Kategorie 1 | Kategorie 2 | Kategorie 3 |
| GHS-Piktogramm |  |
 |
 |
| Signalwort | Gefahr | Achtung | Achtung |
| Gefahrenhinweis | H370: Schädigt die Organe (oder alle betroffenen Organe nennen, sofern bekannt) (Expositionsweg angeben, sofern schlüssig belegt ist, dass diese Gefahr bei keinem anderen Expositionsweg besteht) |
H371: Kann die Organe schädigen (oder alle betroffenen Organe nennen, sofern bekannt) (Expositionsweg angeben, sofern schlüssig belegt ist, dass diese Gefahr bei keinem anderen Expositionsweg besteht) | H335: Kann die Atemwege reizen oder H336: Kann Schläfrigkeit und Benommenheit verursachen |
| Sicherheitshinweise - Prävention | P260 P264 P270 |
P260 P264 P270 |
P261 P271 |
| Sicherheitshinweise - Reaktion | P308 + P311 P321 |
P308 + P311 | P304 + P340 P312 |
| Sicherheitshinweise - Lagerung | P405 | P405 | P403 + P233 P405 |
| Sicherheitshinweise - Entsorgung | P501 | P501 | P501 |
3.9 Spezifische Zielorgan-Toxizität (wiederholte Exposition)
3.9.1 Begriffsbestimmungen und allgemeine Erwägungen
3.9.1.1 Zielorgan-Toxizität (wiederholte Exposition): die spezifische Zielorgan-Toxizität nach wiederholter Exposition gegenüber einem Stoff oder einem Gemisch. Dazu gehören alle eindeutigen Auswirkungen auf die Gesundheit, die Körperfunktionen beeinträchtigen können, unabhängig davon, ob sie reversibel oder irreversibel sind, unmittelbar und/oder verzögert auftreten. Nicht eingeschlossen sind jedoch andere spezifische toxische Wirkungen, die eigens in den Abschnitten 3.1 bis 3.8 und 3.10 behandelt werden.
3.9.1.2 Eine Einstufung aufgrund der Zielorgan-Toxizität (wiederholte Exposition) bedeutet, dass ein Stoff oder Gemisch toxisch auf ein spezifisches Zielorgan wirkt und damit die Gesundheit von exponierten Personen beeinträchtigen kann.
3.9.1.3 Zu diesen schädlichen Auswirkungen auf die Gesundheit gehören konsistente und erkennbare toxische Wirkungen beim Menschen oder - für die menschliche Gesundheit relevante - toxikologisch eindeutige Veränderungen bei Versuchstieren, die die Funktion oder Morphologie eines Gewebes/Organs beeinträchtigt oder ernstzunehmende Veränderungen der Biochemie oder Hämatologie des Organismus hervorgerufen haben.
3.9.1.4 Bei der Beurteilung sind nicht nur eindeutige Veränderungen in einem einzigen Organ oder biologischen System zu berücksichtigen, sondern auch generalisierte Veränderungen geringerer Schwere in mehreren Organen.
3.9.1.5 Eine spezifische Zielorgan-Toxizität kann über sämtliche beim Menschen relevanten Expositionswege auftreten, d. h. hauptsächlich oral, dermal oder durch Inhalation.
3.9.1.6 Nichtletale toxische Wirkungen, die nach einer einmaligen Exposition beobachtet werden, werden eingestuft wie in Abschnitt 3.8 (Spezifische Zielorgan-Toxizität - einmalige Exposition) beschrieben und daher in Abschnitt 3.9 nicht behandelt.
3.9.2 Einstufungskriterien für Stoffe
3.9.2.1 Die Einstufung von Stoffen als spezifisch zielorgantoxisch nach wiederholter Exposition erfolgt mit Hilfe der Beurteilung durch Experten auf der Grundlage der Ermittlung der Beweiskraft aller verfügbaren Daten, einschließlich der Verwendung empfohlener Richtwerte, die die Expositionsdauer und die Dosis/ Konzentration berücksichtigen, die der/den Wirkung/-en zugrunde liegen (siehe Abschnitt 3.9.2.9); derartige Stoffe werden je nach Art und Schwere der beobachteten Wirkung/-en einer von zwei Kategorien zugeordnet (Tabelle 3.9.1).
Tabelle 3.9.1: Kategorien für die spezifische Zielorgan-Toxizität bei wiederholter Exposition
| Kategorien | Kriterien |
| Kategorie 1 | Stoffe, die beim Menschen eindeutig toxisch wirken oder von denen auf der Grundlage von Befunden aus tierexperimentellen Studien anzunehmen ist, dass sie beim Menschen nach wiederholter Exposition eindeutig toxisch wirken können.
Als zielorgantoxisch (wiederholte Exposition) der Kategorie 1 werden Stoffe auf folgender Grundlage eingestuft:
|
| Kategorie 2 | Stoffe, von denen auf der Grundlage von Befunden aus tierexperimentellen Studien angenommen werden kann, dass sie sich bei wiederholter Exposition schädlich auf die menschliche Gesundheit auswirken können.
Als zielorgantoxisch (wiederholte Exposition) der Kategorie 2 werden Stoffe auf der Grundlage von Beobachtungen im Rahmen geeigneter tierexperimenteller Studien eingestuft, bei denen es zu eindeutigen toxischen Wirkungen mit Relevanz für die menschliche Gesundheit bei allgemein moderaten Expositionskonzentrationen kam. Leitwerte für Dosis/ Konzentration als Hilfe für die Einstufung werden in Abschnitt 3.9.2.9 angegeben. In Ausnahmefällen können auch Erfahrungen beim Menschen für eine Einstufung in die Kategorie 2 verwendet werden (siehe Abschnitt 3.9.2.6). |
3.9.2.2 Der/die relevante/-n Expositionsweg/-e ist/sind zu ermitteln, über den/die der eingestufte Stoff Gesundheitsschäden hervorruft.
3.9.2.3 Für die Einstufung ist eine Beurteilung durch Experten (siehe Abschnitt 1.1.1) auf der Grundlage einer Ermittlung der Beweiskraft aller verfügbaren Daten einschließlich der nachstehenden Richtlinien maßgeblich.
3.9.2.4 Eine Ermittlung der Beweiskraft aller Daten (siehe Abschnitt 1.1.1), einschließlich von "Fallstudien" epidemiologischen und tierexperimentellen Studien, ist anzuwenden, um spezifisch zielorgantoxische Wirkungen, die eine Einstufung erfordern, zu begründen. Auf diese Weise wird der beträchtliche Bestand an Toxizitätsdaten aus industrieller Exposition genutzt, die im Laufe der Zeit erarbeitet wurde. Die Bewertung hat auf der Grundlage aller verfügbaren Daten zu erfolgen, einschließlich von Experten begutachtete veröffentlichte Studien und auf zusätzlichen anerkannten Daten.
3.9.2.5 Die für die Bewertung der spezifischen Zielorgan-Toxizität erforderlichen Informationen stammen entweder von wiederholter Exposition beim Menschen, beispielsweise häuslicher Exposition, Exposition am Arbeitsplatz oder in der Umwelt, oder aus tierexperimentellen Studien. Standardtierversuche an Ratten oder Mäusen, anhand derer sich die toxischen Wirkungen auf die Zielgewebe/-organe ermitteln lassen, sind 28-Tage-, 90-Tage- oder chronische Studien (bis zu 2 Jahren), die hämatologische, klinisch-chemische und detaillierte makroskopische und mikroskopische Untersuchungen umfassen. Falls verfügbar, sind auch Daten aus Studien mit wiederholter Verabreichung an anderen Tierarten zu verwenden wie beispielsweise Untersuchungen zur karzinogenen Wirkung, zur Neurotoxizität oder Reproduktionstoxizität, können ebenfalls Nachweise für die spezifische Zielorgan-Toxizität erbringen, die bei der Beurteilung der Einstufung verwendet werden könnten.
3.9.2.6 In Ausnahmefällen ist es aufgrund der Beurteilung durch Experten angezeigt, bestimmte Stoffe, bei denen es Nachweise auf eine spezifische Zielorgan-Toxizität beim Menschen gibt, in die Kategorie 2 einzustufen:
Dosen/Konzentrationswerte beim Menschen sind bei der Einstufung nicht zu berücksichtigen und alle verfügbaren Befunde aus Tierstudien müssen mit der Einstufung in die Kategorie 2 vereinbar sein. Mit anderen Worten: Sind zu dem Stoff auch Tierversuchsdaten verfügbar, die eine Einstufung in die Kategorie 1 rechtfertigen, ist der Stoff in die Kategorie 1 einzustufen.
3.9.2.7 Wirkungen, die als Argument für eine Einstufung aufgrund der spezifischen Zielorgan-Toxizität nach wiederholter Exposition gelten
3.9.2.7.1 Für eine Einstufung sprechen zuverlässige Befunde, die eine wiederholte Exposition gegenüber dem Stoff mit einer übereinstimmenden und identifizierbaren toxischen Wirkung in Zusammenhang bringen.
3.9.2.7.2 Erfahrungen beim Menschen wie Fallstudien beschränken sich üblicherweise auf Berichte über gesundheitsschädliche Wirkungen mit häufig unklaren Expositionsbedingungen und bieten unter Umständen nicht die wissenschaftlichen Einzelheiten, die aus ordnungsgemäß durchgeführten tierexperimentellen Studien erhalten werden.
3.9.2.7.3 Befunde aus geeigneten tierexperimentellen Studien können in Form klinischer Beobachtungen und hämatologischer, klinisch-chemischer sowie makroskopischer und mikroskopischer pathologischer Untersuchungen weitaus mehr Details erbringen, so dass häufig Gefahren erkennbar werden, die zwar nicht lebensbedrohlich sind, jedoch auf eine funktionelle Störung hindeuten. Daher werden sämtliche verfügbaren Befunde mit Relevanz für die menschliche Gesundheit im Einstufungsprozess berücksichtigt; dazu gehören unter anderem folgende toxische Wirkungen bei Mensch und/oder Tier:
3.9.2.8 Wirkungen, die nicht als Argument für eine Einstufung aufgrund der spezifischen Zielorgan-Toxizität nach wiederholter Exposition gelten
3.9.2.8.1 Es ist zu erwähnen, dass bei Mensch und/oder Tier auch Wirkungen festgestellt werden können, die eine Einstufung nicht rechtfertigen. Dabei handelt es sich unter anderem um folgende Wirkungen:
3.9.2.9 Richtwerte als Einstufungshilfe auf der Grundlage von Befunden aus tierexperimentellen Studien
3.9.2.9.1 Steht bei tierexperimentellen Studien allein die Beobachtung von Wirkungen im Mittelpunkt, ohne dass die Dauer der experimentellen Exposition und die Dosis/Konzentration angegeben werden, wird ein wesentlicher Grundsatz der Toxikologie außer Acht gelassen, nämlich dass alle Stoffe potenziell toxisch sind und dass die Toxizität eine Funktion von Dosis/Konzentration und Expositionsdauer ist. Bei den meisten Tierstudien wird in den Prüfleitlinien ein oberer Dosisgrenzwert verwendet.
3.9.2.9.2 Als Hilfe bei der Entscheidung, ob und nach welchem Schweregrad (Kategorie 1 oder Kategorie 2) ein Stoff einzustufen ist, werden Dosis-/Konzentrations-"Richtwerte" zur Berücksichtigung der Dosis/Konzentration bestimmt, bei der eindeutige Auswirkungen auf die Gesundheit festgestellt wurden. Hauptargument für die Festlegung solcher Richtwerte ist, dass alle Stoffe potenziell toxisch sind und dass es eine bestimmte Dosis/ Konzentration geben muss, oberhalb derer eine gewisse toxische Wirkung unstrittig ist. Außerdem sind tierexperimentelle Studien mit wiederholter Exposition auf eine Toxizitätswirkung bei der höchsten verwendeten Dosis ausgelegt, um das Prüfziel zu optimieren, weshalb die meisten Studien zumindest bei dieser Höchstdosierung toxische Wirkungen zeigen Daher sind nicht nur die verursachten Wirkungen zu bewerten, sondern auch, bei welcher Dosis/Konzentration sie erzeugt wurden und wie relevant sie für den Menschen sind.
3.9.2.9.3 Werden also bei Tierstudien eindeutige toxische Wirkungen beobachtet, die zu einer Einstufung führen, dann kann ein Vergleich der Expositionsdauer im Experiment und der Dosis/Konzentration, bei der diese Wirkungen auftraten, mit den vorgeschlagenen Richtwerten nützliche Informationen ergeben, die dabei helfen können zu beurteilen, ob eine Einstufung erforderlich ist (da die toxischen Wirkungen eine Folge der gefährlichen Eigenschaft/-en und auch der Expositionsdauer und der Dosis/Konzentration sind).
3.9.2.9.4 Die Entscheidung, ob ein Stoff überhaupt eingestuft wird, kann durch die Bezugnahme auf die Dosis-/ Konzentrations-Richtwerte, bei denen oder unterhalb deren eine eindeutige toxische Wirkung beobachtet wurde, beeinflusst werden.
3.9.2.9.5 Die Richtwerte beziehen sich auf Wirkungen, die bei einer herkömmlichen 90tägigen Toxizitätsstudie an Ratten festgestellt wurden. Sie können als Grundlage für die Extrapolation gleichwertiger Richtwerte für Toxizitätsstudien von längerer oder kürzerer Dauer verwendet werden, wobei eine der Haberschen Regel für Inhalation vergleichbare Extrapolation von Dosis/Expositionsdauer angewandt wird, die im Wesentlichen aussagt, dass sich die wirksame Dosis direkt proportional zur Expositionskonzentration und zur Expositionsdauer verhält. Die Beurteilung hat von Fall zu Fall zu erfolgen, beispielsweise für eine 28tägige Studie würden die nachstehenden Werte um den Faktor 3 erhöht.
3.9.2.9.6 Eine Einstufung in die Kategorie 1 findet somit dann statt, wenn im Rahmen einer 90tägigen tierexperimentellen Studie mit wiederholter Exposition bei den oder unterhalb der Richtwerte (C) gemäß Tabelle 3.9.2 eindeutige toxische Wirkungen festgestellt werden.
Tabelle 3.9.2: Richtwerte als Hilfe für die Einstufung in die Kategorie 1
| Expositionsweg | Maßeinheiten | Richtwerte (Dosis/Konzentration) |
| oral (Ratte) | mg/kg Körpergewicht/Tag | C< 10 |
| dermal (Ratte oder Kaninchen) | mg/kg Körpergewicht/Tag | C< 20 |
| inhalativ (Ratte) Gas | ppmV/6h/Tag | C< 50 |
| inhalativ (Ratte) Dampf | mg/Liter/6h/Tag | C< 0,2 |
| inhalativ (Ratte) Staub/Nebel/Rauch | mg/Liter/6h/Tag | C< 0,02 |
3.9.2.9.7 Eine Einstufung in die Kategorie 2 findet dann statt, wenn im Rahmen einer 90tägigen tierexperimentellen Studie mit wiederholter Exposition in den oder unterhalb der Richtwertbereiche gemäß Tabelle 3.9.3: eindeutige toxische Wirkungen festgestellt werden.
Tabelle 3.9.3: Richtwerte als Hilfe für die Einstufung in die Kategorie 2
| Expositionsweg | Maßeinheiten | Richtwertbereiche: (Dosis/Konzentration) |
| oral (Ratte) | mg/kg Körpergewicht/Tag | 10 < C< 100 |
| dermal (Ratte oder Kaninchen) | mg/kg Körpergewicht/Tag | 20 < C< 200 |
| inhalativ (Ratte) Gas | ppmV/6h/Tag | 50 < C< 250 |
| inhalativ (Ratte) Dampf | mg/Liter/6h/Tag | 0,2 < C< 1,0 |
| inhalativ (Ratte) Staub/Nebel/Rauch | mg/Liter/6h/Tag | 0,02 < C< 0,2 |
3.9.2.9.8 Die in den Abschnitten 3.9.2.9.6 und 3.9.2.9.7 genannten Richtwerte und -bereiche sind lediglich Anhaltspunkte, d. h. sie sind für die Ermittlung der Beweiskraft zu verwenden und dienen als Entscheidungshilfe bei der Einstufung. Sie sind nicht als strenge Grenzwerte gedacht.
3.9.2.9.913 Es ist also durchaus möglich, dass ein spezifisches Toxizitätsprofil in Tierstudien mit wiederholter Verabreichung bei einer Dosis/Konzentration unterhalb des Richtwertes auftritt (beispielsweise < 100 mg/kg Körpergewicht/Tag auf dem oralen Expositionsweg), aufgrund der Art der Wirkung (beispielsweise Nephrotoxizität, nur bei männlichen Ratten eines bestimmten Stamms mit bekannter Empfänglichkeit für diese Wirkung festzustellen) jedoch entschieden wird, keine Einstufung vorzunehmen. Umgekehrt kann ein spezifisches in tierexperimentellen Studien festgestelltes Toxizitätsprofil bei Erreichen oder Überschreiten eines Richtwertes (beispielsweise> 100 mg/kg Körpergewicht/Tag auf oralem Weg) zusammen mit ergänzenden Informationen aus anderen Quellen (beispielsweise andere Studien mit Langzeitverabreichung oder Erfahrungswerte beim Menschen) in Anbetracht der ermittelten Beweiskraft die Schlussfolgerung nahelegen, dass eine Einstufung aus Gründen der Vorsicht angezeigt ist.
3.9.2.10 Sonstige Erwägungen
3.9.2.10.1 Ist ein Stoff lediglich anhand tierexperimenteller Daten beschrieben (dies ist typisch für neue Stoffe, gilt jedoch auch für zahlreiche Altstoffe), werden im Einstufungsverfahren zur Ermittlung der Beweiskraft unter anderem die Richtwerte für die Dosis/Konzentration herangezogen.
3.9.2.10.2 Stehen fundierte Erfahrungen beim Menschen zur Verfügung, die eine spezifische Zielorgan-Toxizität belegen, welche zuverlässig einer wiederholten oder längeren Exposition gegenüber einem Stoff zugeschrieben werden kann, ist der Stoff in der Regel einzustufen. Positive Erfahrungen beim Menschen, unabhängig von der wahrscheinlichen Dosis, haben vor tierexperimentellen Daten Vorrang. Wird ein Stoff nicht eingestuft, weil bei oder unterhalb dem Dosis-/Konzentrations-Richtwert für Tierversuche keine spezifische Zielorgan-Toxizität festgestellt wurde, so ist dieser Stoff in der Regel dann einzustufen, falls zu einem späteren Zeitpunkt Fallstudien verfügbar werden, die eine spezifische Zielorgan-Toxizität zeigen.
3.9.2.10.3 Ein Stoff, der nicht auf seine spezifische Zielorgan-Toxizität geprüft wurde, kann gegebenenfalls anhand folgender Elemente eingestuft werden: Daten aus einer gesicherten Struktur-Wirkungs-Betrachtung und einer auf der Beurteilung durch Experten basierenden Extrapolation zu einem strukturell verwandten, bereits eingestuften Analogon sowie unter Berücksichtigung weiterer wichtiger Faktoren wie der Bildung gemeinsamer relevanter Metaboliten.
3.9.2.10.4 Die Sättigungsdampfkonzentration ist, wenn dies angezeigt ist, als zusätzliches Element zum besonderen Schutz von Gesundheit und Sicherheit heranzuziehen.
3.9.3 Einstufungskriterien für Gemische
3.9.3.1 Gemische werden entweder anhand der Kriterien für Stoffe eingestuft oder wie nachstehend beschrieben. Wie Stoffe sind auch Gemische aufgrund ihrer spezifischen Zielorgan-Toxizität nach wiederholter Exposition einzustufen.
3.9.3.2 Einstufung von Gemischen, bei denen Daten für das komplette Gemisch vorliegen
3.9.3.2.1 Liegen für das Gemisch zuverlässige und gesicherte Befunde aus Erfahrungen beim Menschen oder aus geeigneten tierexperimentellen Studien vor(siehe Abschnitt 1.1.1.4.), wie bei den Kriterien für Stoffe beschrieben, dann ist das Gemisch mit Hilfe einer Ermittlung der Beweiskraft dieser Daten einzustufen. Bei der Bewertung von Daten zu Gemischen muss man sich sorgfältig vergewissern, dass die Ergebnisse nicht aufgrund von Dosis, Dauer, Beobachtung oder Analyse ihre Beweiskraft verlieren.
3.9.3.3 Einstufung von Gemischen, bei denen keine Daten für das komplette Gemisch vorliegen: Übertragungsgrundsätze
3.9.3.3.1 Wurde das Gemisch selbst nicht auf seine spezifische Zielorgan-Toxizität geprüft, liegen jedoch ausreichende Daten über seine einzelnen Bestandteile und über ähnliche geprüfte Gemische vor, um die Gefahren des Gemisches angemessen zu beschreiben, dann sind diese Daten nach Maßgabe der Übertragungsgrundsätze des Abschnitts 1.1.3 zu verwenden.
3.9.3.4 Einstufung von Gemischen, wenn Daten für alle oder nur manche Bestandteile des Gemisches vorliegen
3.9.3.4.1 Gibt es keine zuverlässigen Nachweise oder Prüfdaten für das spezifische Gemisch selbst und können die Übertragungsgrundsätze nicht für seine Einstufung verwendet werden, dann beruht die Einstufung des Gemisches auf der Einstufung seiner Bestandteile. In diesem Fall ist das Gemisch als spezifisch zielorgantoxisch (unter Angabe des Organs) nach einmaliger Exposition, wiederholter Exposition oder beidem einzustufen, wenn mindestens ein Bestandteil als spezifisch zielorgantoxisch der Kategorie 1 oder der Kategorie 2 eingestuft wurde und den entsprechenden allgemeinen Konzentrationsgrenzwert für die Kategorie 1 bzw. die Kategorie 2 gemäß Tabelle 3.9.4 erreicht oder übersteigt.
Tabelle 3.9.4: Allgemeine Konzentrationsgrenzwerte von als spezifisch zielorgantoxisch eingestuften Bestandteilen eines Gemisches, die zu einer Einstufung des Gemisches führen
| Bestandteil eingestuft als: | Allgemeine Konzentrationsgrenzwerte, die zu einer Einstufung des Gemisches in folgende Kategorie führen: | |
| Kategorie 1 | Kategorie 2 | |
| Kategorie 1 spezifisch zielorgantoxisch |
Konzentration> 10 % | 1,0 %< Konzentration < 10 % |
| Kategorie 2 spezifisch zielorgantoxisch |
Konzentration> 10 % [(Hinweis 1)] | |
| Hinweis 1 Enthält das Gemisch einen Bestandteil, der als spezifisch zielorgantoxisch der Kategorie 2 eingestuft wurde, in einer Konzentration von> über 1,0 %, so wird auf Anforderung ein Sicherheitsdatenblatt für das Gemisch vorgelegt. |
||
3.9.3.4.2 Diese allgemeinen Konzentrationsgrenzwerte zur Einstufung gelten für zielorgantoxische Stoffe bei wiederholter Exposition.
3.9.3.4.3 Gemische sind jeweils aufgrund ihrer Toxizität bei einmaliger Verabreichung und/oder bei wiederholter Verabreichung einzustufen.
3.9.3.4.4 Wenn Giftstoffe, die mehr als ein Organsystem angreifen, kombiniert werden, ist darauf zu achten, dass eine Potenzierung oder Synergismen berücksichtigt werden, denn manche Stoffe können bereits bei einer Konzentration von < 1 % eine Zielorgan-Toxizität bewirken, wenn von anderen Bestandteilen des Gemisches bekannt ist, dass sie seine toxische Wirkung potenzieren.
3.9.4 Gefahrenkommunikation
3.9.4.1 Bei Stoffen oder Gemischen, die die Kriterien für die Einstufung in diese Gefahrenklasse erfüllen, sind die Kennzeichnungsbestandteile gemäß Tabelle 3.9.5 zu verwenden.
Tabelle 3.9.5: Kennzeichnungselemente für die spezifische Zielorgan-Toxizität bei wiederholter Exposition
| Einstufung | Kategorie 1 | Kategorie 2 |
| GHS-Piktogramm |  |
 |
| Signalwort | Gefahr | Achtung |
| Gefahrenhinweis | H372: Schädigt die Organe (alle betroffenen Organe nennen, sofern bekannt) bei längerer oder wiederholter Exposition (Expositionsweg angeben, sofern schlüssig belegt ist, dass diese Gefahr bei keinem anderen Expositionsweg besteht) | H373: Kann die Organe schädigen (alle betroffenen Organe nennen, sofern bekannt) bei längerer oder wiederholter Exposition (Expositionsweg angeben, sofern schlüssig belegt ist, dass diese Gefahr bei keinem anderen Expositionsweg besteht) |
| Sicherheitshinweise - Prävention | P260 P264 P270 |
P260 |
| Sicherheitshinweise - Reaktion | P314 | P314 |
| Sicherheitshinweise - Lagerung | ||
| Sicherheitshinweise - Entsorgung | P501 | P501 |
3.10 Aspirationsgefahr
3.10.1 Begriffsbestimmungen und allgemeine Erwägungen
3.10.1.1 Diese Kriterien beschreiben die Einstufung von Stoffen oder Gemischen, die beim Menschen aspirationstoxisch wirken können.
3.10.1.2Aspiration: das Eindringen eines flüssigen oder festen Stoffes oder Gemisches direkt über die Mund- oder Nasenhöhle oder indirekt durch Erbrechen in die Luftröhre und den unteren Atemtrakt.
3.10.1.3 Die Aspirationstoxizität führt zu schwerwiegenden akuten Wirkungen, etwa durch Chemikalien hervorgerufene Pneumonie, Lungenschädigungen unterschiedlicher Schwere oder Tod durch Aspiration.
3.10.1.4 Die Aspiration setzt mit dem Einatmen während eines Atemzugs ein, wobei sich der Fremdkörper oder -stoff an der Schnittstelle des oberen Atemtrakts und des Verdauungstrakts im Rachen-Kehlkopf-Raum befindet.
3.10.1.5 Die Aspiration eines Stoffes oder Gemisches kann bei Erbrechen nach Aufnahme durch Verschlucken erfolgen. Dies wirkt sich auf die Kennzeichnung aus, insbesondere wenn aufgrund akuter Toxizität ein Sicherheitshinweis empfohlen wird, nach Verschlucken Erbrechen herbeizuführen. Stellt der Stoff/das Gemisch jedoch auch eine Gefahr durch Aspiration dar, muss von der Empfehlung, Erbrechen herbeizuführen, abgesehen werden.
3.10.1.6 Besondere Erwägungen
3.10.1.6.1 Bei Auswertung der medizinischen Fachliteratur zur Aspiration von Chemikalien ergab sich, dass einige Kohlenwasserstoffe (Erdöl-Destillationsprodukte) und bestimmte chlorierte Kohlenwasserstoffe erwiesenermaßen eine Aspirationsgefahr für den Menschen darstellen.
3.10.1.6.2 Die Einstufungskriterien beziehen sich auf die kinematische Viskosität. Die Umrechnung von dynamischer in kinematische Viskosität ist wie folgt anzustellen:
| dynamische Viskosität (mPa s) | |
| = Kinematische Viskosität (mm2/s) | |
| Dichte (g/cm3) |
3.10.1.6.2a. Obwohl die Definition der Aspiration in Abschnitt 3.10.1.2 auch das Eindringen von festen Stoffen in den Atemtrakt einschließt, ist die Einstufung in Kategorie 1 nach Tabelle 3.10.1 Buchstabe b nur für flüssige Stoffe und Gemische bestimmt.
3.10.1.6.3 Einstufung von Aerosolen/Nebeln
Stoffe oder Gemische (Produkte) in Form von Aerosolen und Nebeln werden in der Regel in Druckbehältern, Sprühpistolen oder Sprühpumpen abgegeben. Ausschlaggebend für die Einstufung dieser Produkte ist, ob sich die Produktpartikel im Mund aneinanderlagern und dann aspiriert werden können. Ist der Nebel oder das Aerosol aus einem Druckbehälter fein, kommt es nicht zu einer Aneinanderlagerung der Partikel. Wird das Produkt jedoch in einem Strahl aus einem Druckbehälter abgegeben, können sich die Partikel aneinanderlagern und dann aspiriert werden. Normalerweise sind die Partikel des durch Sprühpistolen und Sprühpumpen erzeugten Nebels groß, so dass eine Aneinanderlagerung und anschließende Aspiration möglich ist. Lässt sich der Pumpmechanismus entfernen und kann der Inhalt verschluckt werden so ist eine Einstufung des in dem Produkt enthaltenen Stoffes oder Gemisches in Betracht zu ziehen.
3.10.2 Einstufungskriterien für Stoffe
Tabelle 3.10.1: Gefahrenkategorie der Aspirationsgefahr
| Kategorien | Kriterien |
| Kategorie 1 | Stoffe, die bekanntlich eine Aspirationsgefahr für den Menschen darstellen oder als solche anzusehen sind.
Ein Stoff wird in die Kategorie 1 eingestuft:
|
3.10.3 Einstufungskriterien für Gemische
3.10.3.1 Einstufung von Gemischen, bei denen Daten für das komplette Gemisch vorliegen
In die Kategorie 1 wird ein Gemisch auf der Grundlage zuverlässiger und hochwertiger Erfahrungen beim Menschen eingestuft.
3.10.3.2 Einstufung von Gemischen, bei denen keine Daten für das komplette Gemisch vorliegen: Übertragungsgrundsätze
3.10.3.2.1 Wurde das Gemisch selbst nicht auf seine Aspirationsgefahr geprüft, liegen jedoch ausreichende Daten über seine einzelnen Bestandteile und über ähnliche geprüfte Gemische vor, um die Gefahren des Gemisches angemessen zu beschreiben, dann sind diese Daten nach Maßgabe der Übertragungsgrundsätze des Abschnitts 1.1.3 zu verwenden. Wird der für das Verdünnungsprinzip geltende Übertragungsgrundsatz angewandt, muss die Konzentration des/der aspirationstoxischen Stoffe/-s mindestens10 % betragen.
3.10.3.3 Einstufung von Gemischen, wenn Daten für alle oder nur für manche Bestandteile des Gemisches vorliegen
3.10.3.3.1 Kategorie 1
3.10.3.3.1.1 Ein Gemisch, das insgesamt mindestens 10 % eines Stoffes oder von Stoffen enthält, der/die in die Kategorie 1 eingestuft wurde/-n, und das eine bei 40 °C gemessene kinematische Viskosität von maximal 20,5 mm2/s aufweist, ist in die Kategorie 1 einzustufen.
3.10.3.3.1.2 Im Fall eines Gemisches, das aus zwei oder mehr nicht vermischten Schichten besteht, von denen eine aus mindestens 10 % eines Stoffes oder von Stoffen besteht, der/die in die Kategorie 1 eingestuft wurde/-n, und eine bei 40 °C gemessene kinematische Viskosität von maximal 20,5 mm2/s aufweist, wird das gesamte Gemisch in die Kategorie 1 eingestuft.
3.10.4 Gefahrenkommunikation
3.10.4.1 Bei Stoffen oder Gemischen, die die Kriterien für die Einstufung in diese Gefahrenklasse erfüllen, sind die Kennzeichnungselemente gemäß Tabelle 3.10.2 zu verwenden.
Tabelle 3.10.2: Kennzeichnungselemente für Aspirationsgefahr
| Einstufung | Kategorie 1 |
| GHS-Piktogramm |  |
| Signalwort | Gefahr |
| Gefahrenhinweis | H304: Kann bei Verschlucken und Eindringen in die Atemwege tödlich sein |
| Sicherheitshinweise - Prävention | |
| Sicherheitshinweise - Reaktion | P301 + P310 P331 |
| Sicherheitshinweise - Lagerung | P405 |
| Sicherheitshinweise - Entsorgung | P501 |
4. Teil 4
Umweltgefahren11
4.1 Gewässergefährdend
4.1.1 Begriffsbestimmungen und allgemeine Erwägungen
4.1.1.1 Begriffsbestimmungen16
4.1.1.2 Grundelemente
4.1.1.2.0 Gewässergefährdend ist wie folgt differenziert:
4.1.1.2.1 Folgende Grundelemente werden für die Einstufung aufgrund von Gefahren für die aquatische Umwelt verwendet:
4.1.1.2.2 Daten sind vorzugsweise unter Anwendung der in Artikel 8 Absatz 3 bezeichneten standardisierten Prüfmethoden zu gewinnen. In der Praxis sind jedoch auch aus anderen standardisierten Prüfverfahren wie nationalen Methoden hervorgegangene Daten zu verwenden, wenn diese als gleichwertig gelten. Liegen valide Daten aus nicht standardisierten Prüfverfahren und Informationen, die nicht aus Labortests hervorgegangen sind, vor, sind diese bei der Einstufung zu berücksichtigen, sofern sie die Anforderungen gemäß Anhang XI Abschnitt 1 der Verordnung (EG) Nr. 1907/2006 erfüllen. Generell werden Toxizitätsdaten sowohl von Süßwasserarten als auch von Salzwasserarten als für die Verwendung zur Einstufung geeignet betrachtet, sofern die verwendeten Verfahren für die Prüfung gleichwertig sind. Liegen keine derartigen Daten vor, erfolgt die Einstufung auf der Grundlage der besten verfügbaren Daten. Siehe dazu auch Anhang I Teil 1 der Verordnung (EG) Nr. 1272/2008.
4.1.1.3 Sonstige Erwägungen
4.1.1.3.116 Für die Einstufung von Stoffen und Gemischen aufgrund ihrer Umweltgefahren müssen ihre Gefahren für die aquatische Umwelt ermittelt werden. Als aquatische Umwelt sind die aquatischen Organismen, die im Wasser leben, und das aquatische Ökosystem, zu dem sie gehören, zu betrachten. Die Basis für die Ermittlung der kurzfristigen (akuten) und der langfristigen (chronischen) Gefahren ist daher die aquatische Toxizität des Stoffs oder Gemischs, auch wenn diese unter Berücksichtigung weiterer Informationen über das Abbau- und das Bioakkumulationsverhalten geändert werden soll, falls dies angezeigt ist.
4.1.1.3.2 Das Einstufungssystem gilt zwar für alle Stoffe und Gemische, für Sonderfälle werden jedoch die von der Europäischen Chemikalienagentur herausgegebenen Leitlinien anerkannt.
4.1.2 Einstufungskriterien für Stoffe
4.1.2.1 Im Rahmen des Einstufungssystems gilt sowohl die kurzfristige (akute) als auch die langfristige (chronische) Gefahr für aquatische Organismen als intrinsische Gefahr eines Stoffes. Für die langfristige (chronische) Gefahr werden getrennte Gefahrenkategorien festgelegt, die eine Abstufung des ermittelten Gefahrengrades darstellen. Zur Festlegung der geeigneten Gefahrenkategorie/-n dient normalerweise der niedrigste verfügbare Toxizitätswert aller trophischen Ebenen sowie innerhalb der einzelnen trophischen Ebenen (Fische, Krebstiere, Algen/Wasserpflanzen). Unter gewissen Umständen ist es jedoch angezeigt, den Ansatz der Ermittlung der Beweiskraft anzuwenden.
4.1.2.2 Im Kern besteht das Einstufungssystem für Stoffe aus einer Einstufungskategorie für die kurzfristige (akute) Gefahr und drei Einstufungskategorien für langfristige (chronische) Gefahren. Die Einstufungskategorien "kurzfristig (akut) gewässergefährdend" und "langfristig (chronisch) gewässergefährdend" werden unabhängig voneinander verwendet.
4.1.2.3 Als Kriterium für die Einstufung eines Stoffs in die Kategorie Akut 1 dienen ausschließlich Daten über die akute aquatische Toxizität (EC50 oder LC50). Die Kriterien für die Einstufung eines Stoffs in die Kategorien Chronisch 1 bis 3 folgen einem Stufenkonzept, wobei in der ersten Stufe geprüft wird, ob die vorliegenden Informationen über die chronische Toxizität eine Einstufung aufgrund einer langfristigen (chronischen) Gefahr rechtfertigen. Sind keine geeigneten Daten über die chronische Toxizität verfügbar, besteht der nächste Schritt darin, zwei Arten von Informationen, nämlich die Daten über die akute aquatische Toxizität und die Daten über Verbleib und Verhalten in der Umwelt (Abbaubarkeits- und Bioakkumulationsdaten), miteinander zu verbinden (siehe Abbildung 4.1.1).
Abbildung 4.1.1: Kategorien für langfristig (chronisch) gewässergefährdende Stoffe16
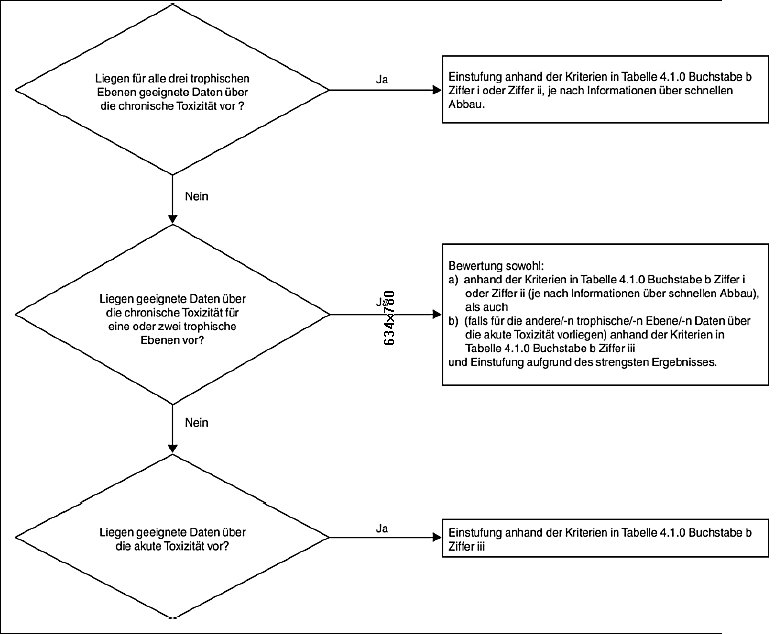
4.1.2.4 Mit dem System wird außerdem eine Einstufung eingeführt, die die Funktion eines , Sicherheitsnetzes" erfüllt (bezeichnet als Chronisch 4); sie wird verwendet, wenn die verfügbaren Daten eine Einstufung nach formalen Kriterien als Akut 1 oder Chronisch 1 bis 3 nicht erlauben, trotzdem aber Anlass zu Besorgnis besteht (siehe Beispiel in Tabelle 4.1.0).
4.1.2.5 Stoffe, die unter 1 mg/l akut toxisch wirken oder unter 0,1 mg/l (falls nicht schnell abbaubar) bzw. unter 0,01 mg/l (falls schnell abbaubar) chronisch toxisch wirken, tragen als Bestandteile eines Gemisches bereits bei niedriger Konzentration zu der Toxizität des Gemisches bei; sie werden normalerweise bei der Einstufung durch die Anwendung der Summierungsmethode stärker gewichtet (siehe Hinweis 1 zu Tabelle 4.1.0 und Abschnitt 4.1.3.5.5).
4.1.2.6 Die Kriterien für die Einstufung von Stoffen als gewässergefährdend und die Zuordnung zu den Kategorien sind in Tabelle 4.1.0 zusammengefasst.
Tabelle 4.1.0 Kategorien für die Einstufung von Stoffen als gewässergefährdend
| a) | Gewässergefährdend, kurzfristige (akute) Wirkung | |||
| Kategorie Akut 1: | (Hinweis 1) | |||
| 96 h LC50 (für Fische) | < 1 mg/l und/oder | |||
| 48 h EC50 (für Krebstiere) | < 1 mg/l und/oder | |||
| 72 oder 96 h ErC50 (für Algen oder andere Wasserpflanzen) | < 1 mg/l. | (Hinweis 2) | ||
| b) | Gewässergefährdend, langfristige (chronische) Wirkung | |||
| i) | nicht schnell abbaubare Stoffe (Hinweis 3), über die geeignete Daten zur chronischen Toxizität vorliegen | |||
| Kategorie Chronisch 1: | (Hinweis 1) | |||
| chronischer NOEC oder ECx (für Fische) | < 0,1 mg/l und/oder | |||
| chronischer NOEC oder ECx (für Krebstiere) | < 0,1 mg/l und/oder | |||
| chronischer NOEC oder ECx (für Algen oder andere Wasserpflanzen) | < 0, 1 mg/l. | |||
| Kategorie Chronisch 2: | ||||
| chronischer NOEC oder ECx (für Fische) | < 1 mg/l und/oder | |||
| chronischer NOEC oder ECx (für Krebstiere) | < 1 mg/l und/oder | |||
| chronischer NOEC oder ECx (für Algen oder andere Wasserpflanzen) | < 1 mg/l. | |||
| ii) | Schnell abbaubare Stoffe (Hinweis 3), über die geeignete Daten zur chronischen Toxizität vorliegen | |||
| Kategorie Chronisch 1: | (Hinweis 1) | |||
| chronischer NOEC oder ECx (für Fische) | < 0,01 mg/l und/oder | |||
| chronischer NOEC oder ECx (für Krebstiere) | < 0,01 mg/l und/oder | |||
| chronischer NOEC oder ECx (für Algen oder andere Wasserpflanzen) | < 0,01 mg/l. | |||
| Kategorie Chronisch 2: | ||||
| chronischer NOEC oder ECx (für Fische) | < 0,1 mg/l und/oder | |||
| chronischer NOEC oder ECx (für Krebstiere) | < 0,1 mg/l und/oder | |||
| chronischer NOEC oder ECx (für Algen oder andere Wasserpflanzen) | < 0,1 mg/l. | |||
| Kategorie Chronisch 3: | ||||
| chronischer NOEC oder ECx (für Fische) | < 1 mg/l und/oder | |||
| chronischer NOEC oder ECx (für Krebstiere) | < 1 mg/l und/oder | |||
| chronischer NOEC oder ECx (für Algen oder andere Wasserpflanzen) | < 1 mg/l. | |||
| iii) | Stoffe, über die keine geeigneten Daten zur chronischen Toxizität vorliegen | |||
| Kategorie Chronisch 1: | (Hinweis 1) | |||
| 96 h LC50 (für Fische) | < 1 mg/l und/oder | |||
| 48 h EC50 (für Krebstiere) | < 1 mg/l und/oder | |||
| 72 oder 96 h ErC50 (für Algen oder andere Wasserpflanzen) | < 1 mg/l. | (Hinweis 2) | ||
| und der Stoff ist nicht schnell abbaubar und/oder der experimentell bestimmte BCF beträgt> 500 | ||||
| (oder wenn nicht vorhanden log Kow> 4). | (Hinweis 3) | |||
| Kategorie Chronisch 2: | ||||
| 96 h LC50 (für Fische) | > 1 bis< 10 mg/l und/oder | |||
| 48 h EC50 (für Krebstiere) | > 1 bis< 10 mg/l und/oder | |||
| 72 oder 96 h ErC50 (für Algen oder andere Wasserpflanzen) | > 1 bis d< 10 mg/l | (Hinweis 2) | ||
| und der Stoff ist nicht schnell abbaubar und/oder der experimentell bestimmte BCF beträgt> 500 | ||||
| (oder wenn nicht vorhanden log Kow> 4). | (Hinweis 3) | |||
| Kategorie Chronisch 3: | ||||
| 96 h LC50 (für Fische) | > 10 bis< 100 mg/l und/oder | |||
| 48 h EC50 (für Krebstiere) | > 10 bis< 100 mg/l und/oder | |||
| 72 oder 96 h ErC50 (für Algen oder andere Wasserpflanzen) | > 10 bis< 100 mg/l | (Hinweis 2) | ||
| und der Stoff ist nicht schnell abbaubar und/oder der experimentell bestimmte BCF beträgt> 500 | ||||
| (oder wenn nicht vorhanden log Kow> 4). | (Hinweis 3) | |||
| Einstufung wegen wahrscheinlicher Gefahr ("Sicherheitsnetz")
Kategorie Chronisch 4: Fälle, in denen die verfügbaren Daten eine Einstufung nach den vorgenannten Kriterien nicht erlauben, aber trotzdem Anlass zu Besorgnis besteht. Dazu gehören beispielsweise schwer lösliche Stoffe, die in Bereichen bis zur Wasserlöslichkeit keine akute Toxizität zeigen (Hinweis 4), die gemäß Abschnitt 4.1.2.9.5 nicht schnell abbaubar sind und einen experimentell bestimmten BCF von> 500 (oder wenn nicht vorhanden einen log Kow von> 4) aufweisen, was auf ein Bioakkumulationspotenzial hindeutet; sie werden in diese Kategorie eingestuft, sofern sonstige wissenschaftliche Erkenntnisse eine Einstufung nicht als unnötig belegen. Solche Erkenntnisse sind beispielsweise NOEC-Werte für chronische Toxizität > Wasserlöslichkeit oder > 1 mg/l oder auch andere Nachweise über einen schnellen Abbau in der Umwelt, die nicht durch eines der in Abschnitt 4.1.2.9.5 aufgeführten Verfahren erbracht werden. |
||||
4.1.2.7 Aquatische Toxizität
4.1.2.7.1 Zur Bestimmung der akuten aquatischen Toxizität werden in der Regel die Prüfungen 96 h LC50 (Fisch), 48 h EC50 (Krebstier) und/oder 72 h bzw. 96 h EC50 (Alge) durchgeführt. Diese Spezies decken eine Reihe von trophischen Ebenen und Taxa ab und werden stellvertretend für alle Wasserorganismen betrachtet; Daten über andere Spezies (beispielsweise Lemna spp.) sind bei geeigneter Testmethodik ebenfalls zu berücksichtigen. Die Prüfungen auf Hemmung des Wasserpflanzenwachstums werden normalerweise als chronische Prüfungen betrachtet, die EC50 werden jedoch für Einstufungszwecke als akute Toxizitätswerte behandelt (siehe Hinweis 2).
4.1.2.7.2 Zur Bestimmung der chronischen aquatischen Toxizität sind zu Einstufungszwecken Daten zu akzeptieren, die nach den in Artikel 8 Absatz 3 bezeichneten standardisierten Prüfverfahren gewonnen wurden, sowie Ergebnisse aus anderen validierten und international anerkannten Prüfverfahren. Es sind die NOEC-Werte oder gleichwertige ECx-Werte (beispielsweise EC10) zu verwenden.
4.1.2.8 Bioakkumulation
4.1.2.8.1 Die Bioakkumulation von Stoffen in Wasserorganismen kann über längere Zeiträume toxische Wirkungen verursachen, auch wenn die tatsächlichen Konzentrationswerte im Wasser niedrig sind. Das Bioakkumulationspotenzial organischer Stoffe ist in der Regel unter Verwendung des Oktanol/Wasser-Verteilungskoeffizienten zu ermitteln, der üblicherweise als log Kow-Wert bestimmt wird. Die Beziehung zwischen dem log Kow eines organischen Stoffes und seiner Biokonzentration, gemessen anhand des Biokonzentrationsfaktors (BCF) beim Fisch, wird in der wissenschaftlichen Literatur eindeutig nachgewiesen. Die Verwendung eines Berücksichtigungsgrenzwertes von log Kow> 4 dient dazu, nur diejenigen Stoffe zu identifizieren, die über ein echtes Biokonzentrationspotenzial verfügen. Dies stellt dann zwar ein Bioakkumulationspotenzial dar, ein experimentell bestimmter BCF eignet sich jedoch besser als Maßzahl und ist, falls verfügbar, vorzuziehen. Ein BCF bei Fischen von> 500 ist zu Einstufungszwecken ein Indiz für das Biokonzentrationspotenzial. Es lassen sich bestimmte Zusammenhänge zwischen der chronischen Toxizität und dem Bioakkumulationspotenzial beobachten, da die Toxizität mit der Körperbelastung in Verbindung steht.
 |
weiter . |  |
(Stand: 04.08.2021)
Alle vollständigen Texte in der aktuellen Fassung im Jahresabonnement
Nutzungsgebühr: 90.- € netto (Grundlizenz)
(derzeit ca. 7200 Titel s.Übersicht - keine Unterteilung in Fachbereiche)
Die Zugangskennung wird kurzfristig übermittelt
? Fragen ?
Abonnentenzugang/Volltextversion