 Für einen individuellen Ausdruck passen Sie bitte die
Für einen individuellen Ausdruck passen Sie bitte dieEinstellungen in der Druckvorschau Ihres Browsers an. Regelwerk, EU 2021, Wirtschaft - EU Bund

 Für einen individuellen Ausdruck passen Sie bitte die Für einen individuellen Ausdruck passen Sie bitte dieEinstellungen in der Druckvorschau Ihres Browsers an. Regelwerk, EU 2021, Wirtschaft - EU Bund |
 |
Durchführungsverordnung (EU) 2021/442 der Kommission vom 11. März 2021 über die Einführung der Verpflichtung zur Vorlage einer Ausfuhrgenehmigung bei der Ausfuhr bestimmter Waren
(ABl. L 85 vom 12.03.2021 S. 190 A;
VO (EU) 2021/1071 - ABl. L 230 vom 30.06.2021 S. 28 Inkrafttreten A;
VO (EU) 2021/1728 - ABl. L 345 vom 30.09.2021 S. 34 Inkrafttreten
aufgehoben)
aufgehoben gem. Art. 4
Die Europäische Kommission -
gestützt auf den Vertrag über die Arbeitsweise der Europäischen Union,
gestützt auf die Verordnung (EU) 2015/479 des Europäischen Parlaments und des Rates vom 11. März 2015 über eine gemeinsame Ausfuhrregelung 1, insbesondere auf Artikel 6,
in Erwägung nachstehender Gründe:
(1) Am 30. Januar 2021 verabschiedete die Kommission die Durchführungsverordnung (EU) 2021/111 der Kommission 2, mit der die Verpflichtung zur Vorlage einer Ausfuhrgenehmigung gemäß Artikel 5 der Verordnung (EU) 2015/479 bei der Ausfuhr von COVID-19-Impfstoffen sowie von Wirkstoffen, die für die Herstellung solcher Impfstoffe verwendet werden, einschließlich Master- und Arbeitszellbanken, eingeführt wurde. Die Durchführungsverordnung (EU) 2021/111 gilt für einen Zeitraum von höchstens sechs Wochen.
(2) Die Produktionskapazität für COVID-19-Impfstoffe befindet sich noch in der Aufbauphase und liegt für bestimmte Impfstoffhersteller nach wie vor unter den zugesagten Mengen, die auf der Grundlage der mit der Union ausgehandelten Abnahmegarantien für die Union bestimmt sind.
(3) Angesichts der kritischen Lage im Hinblick auf COVID-19-Impfstoffe in der Union und insbesondere des Risikos, dass in der Union hergestellte oder verpackte Impfstoffe unter potenziellen Verstößen gegen die vertraglichen Verpflichtungen der Pharmaindustrie insbesondere in nicht gefährdete Länder ausgeführt werden, sind kontinuierliche Schutzmaßnahmen geboten, um Engpässe und verzögerte Lieferungen solcher Impfstoffe zu verhindern. Es liegt daher im Interesse der Union, für einen begrenzten Zeitraum einen Mechanismus aufrechtzuerhalten, mit dem sichergestellt werden kann, dass Ausfuhren von COVID-19-Impfstoffen, die unter die Vereinbarungen mit der Union über Abnahmegarantien fallen, einer vorherigen Genehmigung unterliegen, damit in der Union eine angemessene Versorgung zur Deckung der lebenswichtigen Nachfrage gewährleistet ist, ohne dass dies jedoch Auswirkungen auf die diesbezüglichen internationalen Verpflichtungen der Union hat.
(4) Die Mitgliedstaaten, in denen die unter diese Verordnung fallenden Waren hergestellt werden, sollten Ausfuhrgenehmigungen erteilen, sofern die betreffenden Ausfuhren aufgrund ihrer Menge oder anderer relevanter Umstände die kontinuierliche Versorgung mit Impfstoffen zur Erfüllung der Vereinbarungen über Abnahmegarantien zwischen der Union und den Impfstoffherstellern nicht gefährden. Um ein koordiniertes Vorgehen auf Unionsebene zu gewährleisten, sollten die Mitgliedstaaten vorab die Stellungnahme der Kommission einholen und im Einklang mit dieser Stellungnahme entscheiden.
(5) Die Verwaltungsmodalitäten für diese Ausfuhrgenehmigungen sollten während des Bestehens dieses befristet geltenden Mechanismus im Ermessen der Mitgliedstaaten liegen.
(6) Eine Ausfuhrgenehmigung kann für mehrere Ausfuhrsendungen von Impfstoffen und Proben erteilt werden. Um das Verwaltungsverfahren zu erleichtern und gleichzeitig Transparenz zu gewährleisten, sollte das Formblatt für die Ausfuhrgenehmigung vereinfacht werden, sodass ein einziges Formblatt für Antragstellung und Genehmigung eine Ladung mit Sendungen an mehrere Endempfänger innerhalb desselben Bestimmungslandes abdecken kann, wenn diese von derselben Ausfuhrzollstelle überlassen werden. Für Zollkontrollzwecke sollte die Ausfuhrzollstelle in der Genehmigung angegeben werden.
(7) Um sicherzustellen, dass die Lage in regelmäßigen Abständen bewertet wird, und um Transparenz und Kohärenz zu gewährleisten, sollten die Mitgliedstaaten der Kommission Angaben über beantragte Ausfuhrgenehmigungen und ihre Entscheidungen über solche Anträge übermitteln. Die Kommission sollte diese Angaben unter gebührender Berücksichtigung ihres vertraulichen Charakters regelmäßig öffentlich zugänglich machen.
(8) Der Markt für Arzneimittel ist über die Grenzen der Union hinaus stark integriert, ebenso wie seine Lieferketten und Vertriebsnetze. Dies gilt insbesondere für die Nachbarländer und die benachbarten Wirtschaftsräume, die Mitgliedstaaten der Europäischen Freihandelszone und die Länder des westlichen Balkans, die den Prozess der Integration in die Union durchlaufen. Wenn die Ausfuhr von COVID-19-Impfstoffen in diese Länder einer Ausfuhrgenehmigungspflicht unterworfen würde, wäre dies kontraproduktiv wegen ihrer Nähe und wegen ihrer Abhängigkeit von der Versorgung durch die Union mit Impfstoffen (die meisten von ihnen verfügen über keine eigene Produktionskapazität für die betreffenden Impfstoffe in ausreichender Menge) und da Impfstoffe unerlässlich sind, um eine weitere Ausbreitung der Pandemie zu verhindern. Solche Länder sollten daher vom Anwendungsbereich dieser Verordnung ausgenommen werden.
(9) Ebenso sollten die in Anhang II des Vertrags aufgeführten überseeischen Länder und Hoheitsgebiete, die Färöer, Andorra, San Marino und die Vatikanstadt sowie die ausdrücklich aus dem Zollgebiet ausgeschlossenen Gebiete, d. h. Büsingen, Helgoland, Livigno, Ceuta und Melilla, von der Genehmigungspflicht für Ausfuhren ausgenommen werden, da sie in besonderem Maße von den Lieferketten der Mitgliedstaaten, die ihre Mutterländer sind, bzw. von den Lieferketten benachbarter Mitgliedstaaten abhängig sind. Ebenso sollten Ausfuhren zu Orten auf dem Festlandsockel eines Mitgliedstaats oder in die ausschließliche Wirtschaftszone, die von einem Mitgliedstaat gemäß dem Seerechtsübereinkommen der Vereinten Nationen (SRÜ) ausgewiesen wurde, von der Anwendung dieser Verordnung ausgenommen werden.
(10) Da nur Ausfuhren aus dem Zollgebiet der Union betroffen sind, müssen Länder, die Teil dieses Zollgebiets sind, nicht befreit werden, um uneingeschränkte Lieferungen aus dem Gebiet der Union zu erhalten. Dies gilt insbesondere für das Fürstentum Monaco 3.
(11) Entsprechend dem Grundsatz der internationalen Solidarität sollten Ausfuhren im Zusammenhang mit Lieferungen der humanitären Soforthilfe, Ausfuhren an die COVAX-Fazilität, insbesondere in Länder mit niedrigem und mittlerem Einkommen, die besonders hilfsbedürftig sind und nur begrenzten Zugang zu Impfstoffen haben, Ausfuhren von COVID-19-Impfstoffen, die über COVAX, Unicef und PAHO gekauft oder in ein anderes an COVAX teilnehmendes Land geliefert werden, sowie Ausfuhren von COVID-19-Impfstoffen, die von Mitgliedstaaten im Rahmen der Abnahmegarantien der Union gekauft und an ein Drittland gespendet oder weiterverkauft werden, von der Erfordernis einer Ausfuhrgenehmigung ausgenommen werden.
(12) Erfordernisse einer vorherigen Genehmigung stellen Ausnahmen dar, die zielgerichtet und befristet sein sollten. Angesichts der anhaltenden Einschränkungen bei der Herstellung von Impfstoffen und der Gefahr von Verzögerungen bei der Lieferung von COVID-19-Impfstoffen in der Union (vgl. Erwägungsgründe 2 und 3) sollte der Mechanismus für Ausfuhrgenehmigungen für einen begrenzten Zeitraum weiterhin gelten.
(13) Aufgrund der begrenzten Geltungsdauer der in der Durchführungsverordnung (EU) 2021/111 vorgesehenen Maßnahmen sollte die vorliegende Verordnung so bald wie möglich in Kraft treten.
(14) Die in dieser Verordnung vorgesehenen Maßnahmen stehen im Einklang mit der Stellungnahme des nach Artikel 3 Absatz 1 der Verordnung (EU) 2015/479 eingesetzten Ausschusses
- hat folgende Verordnung erlassen:
Artikel 1 Ausfuhrgenehmigung
(1) Für die Ausfuhr folgender Waren ist eine nach dem Formblatt in Anhang I erteilte Ausfuhrgenehmigung erforderlich:
(2) Für die Zwecke dieser Verordnung gelten als Ausfuhr
(3) Die Ausfuhrgenehmigung ist bei der Anmeldung der Waren zur Ausfuhr, spätestens bei ihrer Überlassung, vorzulegen.
(4) Die Ausfuhrgenehmigung wird schriftlich oder in elektronischer Form von den zuständigen Behörden des Mitgliedstaats ausgestellt, in dem die unter diese Verordnung fallenden Waren hergestellt werden. Für die Zwecke dieser Verordnung umfasst die Herstellung auch die Abfüllung und Verpackung von Impfstoffen. Werden die unter diese Verordnung fallenden Waren außerhalb der Union hergestellt, so wird die Ausfuhrgenehmigung von den zuständigen Behörden des Mitgliedstaats erteilt, in dem der Ausführer niedergelassen ist.
(5) In der Anmeldung zur Ausfuhr oder Wiederausfuhr ist die Anzahl der Dosen anzugeben (bei Mehrdosisbehältern die Anzahl der Dosen für Erwachsene).
(6) Wird keine gültige Ausfuhrgenehmigung vorgelegt, ist die Ausfuhr der unter diese Verordnung fallenden Waren untersagt.
(7) Die zuständige Behörde erteilt eine Ausfuhrgenehmigung, es sei denn, die Erfüllung der von der Union mit Impfstoffherstellern geschlossenen Vereinbarungen über Abnahmegarantien ist aufgrund des Ausfuhrvolumens oder anderer relevanter Umstände gefährdet.
(8) Eine Ausfuhrgenehmigung kann sich auf einen einzigen Transport mit mehr als einer Sendung von in Absatz 1 genannten Waren erstrecken, sofern alle diese Sendungen dasselbe Bestimmungsland haben und von derselben Ausfuhrzollstelle überlassen werden.
(9) Die folgenden Ausfuhren unterliegen nicht der Ausfuhrgenehmigung nach diesem Artikel:
Bei den in Unterabsatz 1 Buchstabe f genannten Ausfuhren muss die Ausfuhrerklärung unter Verwendung des entsprechenden zusätzlichen Referenzcodes gemäß dem Datenelement 2/3 in Anhang B Titel II Nummer 2 der Durchführungsverordnung (EU) 2015/2447 der Kommission 6 die Angaben zum Festlandsockel oder zur ausschließlichen Wirtschaftszone des Mitgliedstaats enthalten, auf den bzw. in die die unter diese Verordnung fallenden Waren verbracht werden sollen.
Artikel 2 Verfahren
(1) Der Antrag auf Erteilung einer Ausfuhrgenehmigung muss die in Anhang I aufgeführten Angaben und die anwendbaren TARIC-Zusatzcodes in Anhang II enthalten. Darüber hinaus muss er Angaben über die Anzahl der Impfstoffdosen der unter diese Verordnung fallenden Waren, die seit dem 1. Dezember 2020 in der Union verteilt wurden, aufgeschlüsselt nach Mitgliedstaaten enthalten, sowie Angaben zur Anzahl der Impfstoffdosen der unter diese Verordnung fallenden Waren, die seit Inkrafttreten der Durchführungsverordnung (EU) 2021/111 in Nordirland verteilt wurden.
(2) Die zuständigen Behörden der Mitgliedstaaten bearbeiten die Anträge auf Ausfuhrgenehmigungen so bald wie möglich und fertigen spätestens zwei Arbeitstage nach Übermittlung aller erforderlichen Angaben durch den Antragsteller an die zuständigen Behörden einen Entscheidungsentwurf aus. In Ausnahmefällen und aus hinreichend gerechtfertigten Gründen kann diese Frist um weitere zwei Arbeitstage verlängert werden.
(3) Die zuständigen Behörden der Mitgliedstaaten übermitteln der Kommission den Antrag und den Entscheidungsentwurf unverzüglich an folgende E-Mail-Adresse: SANTE-PHARMACEUTICALS-B4@ec.europa.euSANTE-PHARMACEUTICALS-B4@ec.europa.eu
(4) Ist die Kommission mit dem Entscheidungsentwurf eines Mitgliedstaats nicht einverstanden, übermittelt sie der zuständigen Behörde innerhalb eines Arbeitstags nach Eingang der Mitteilung eine Stellungnahme. Ist der Antrag unvollständig oder unrichtig, so beginnt diese Frist an dem Tag, an dem die zuständige Behörde des notifizierenden Mitgliedstaats auf Ersuchen der Kommission die erforderlichen Angaben übermittelt. Die Kommission bewertet die Auswirkungen der Ausfuhren, für die eine Genehmigung beantragt wird, auf die Durchführung der einschlägigen Vereinbarungen mit der Union über Abnahmegarantien. Der Mitgliedstaat entscheidet zügig über den Genehmigungsantrag im Einklang mit der Stellungnahme der Kommission.
(5) Die Impfstoffhersteller, die mit der Union Vereinbarungen über Abnahmegarantien geschlossen haben, übermitteln die einschlägigen Daten über ihre Ausfuhren seit dem 30. Oktober 2020 zusammen mit dem ersten Antrag auf Genehmigung gemäß dieser Verordnung oder gemäß der Durchführungsverordnung (EU) 2021/111 an die Kommission (an folgende E-Mail-Adresse: SANTE-PHARMACEUTICALS-B4@ec.europa.euSANTE-PHARMACEUTICALS-B4@ec.europa.eu
(6) Die zuständigen Behörden der Mitgliedstaaten können beschließen, Anträge auf Erteilung einer Ausfuhrgenehmigung anhand von elektronischen Dokumenten zu bearbeiten.
(7) Die zuständigen Behörden der Mitgliedstaaten können die gemäß Absatz 6 vorgelegten Angaben auch nach Erteilung der Genehmigung in den Räumlichkeiten des Antragstellers überprüfen.
Artikel 3 Mitteilungen
(1) Die Mitgliedstaaten unterrichten die Kommission unverzüglich über die erteilten oder versagten Ausfuhrgenehmigungen.
(2) Diese Mitteilungen müssen folgende Angaben enthalten:
Die Mitteilung ist an folgende E-Mail-Adresse zu übermitteln: SANTE-PHARMACEUTICALS-B4@ec.europa.eu
(3) Die Kommission macht die Angaben über die erteilten und versagten Ausfuhrgenehmigungen unter gebührender Berücksichtigung der Vertraulichkeit der übermittelten Daten öffentlich zugänglich.
Artikel 4 Inkrafttreten und Anwendung 21 21a
Diese Verordnung tritt am 13. März 2021 in Kraft.
Sie gilt bis zum 31. Dezember 2021.
Ausfuhrgenehmigungen, die gemäß Anhang I der Durchführungsverordnung (EU) 2021/111 erteilt wurden, bleiben auch nach Inkrafttreten dieser Verordnung gültig.
Diese Verordnung ist in allen ihren Teilen verbindlich und gilt unmittelbar in jedem Mitgliedstaat.
Brüssel, den 11. März 2021
2) Durchführungsverordnung (EU) 2021/111 der Kommission vom 29. Januar 2021 über die Einführung der Verpflichtung zur Vorlage einer Ausfuhrgenehmigung bei der Ausfuhr bestimmter Produkte (ABl. L 31 I vom 30.01.2021 S. 1).
3) Siehe Artikel 4 Absatz 2 Buchstabe a der Verordnung (EU) Nr. 952/2013 des Europäischen Parlaments und des Rates vom 9. Oktober 2013 zur Festlegung des Zollkodex der Union (ABl. L 269 vom 10.10.2013 S. 1).
4) Verordnung (EU) Nr. 952/2013 des Europäischen Parlaments und des Rates vom 9. Oktober 2013 zur Festlegung des Zollkodex der Union (ABl. L 269 vom 10.10.2013 S. 1).
*) Diese Bezeichnung berührt nicht die Standpunkte zum Status und steht im Einklang mit der Resolution 1244/1999 des VN-Sicherheitsrates und dem Gutachten des Internationalen Gerichtshofs zur Unabhängigkeitserklärung des Kosovos.
**) Diese Bezeichnung ist nicht als Anerkennung eines Staates Palästina auszulegen und lässt die Standpunkte der einzelnen Mitgliedstaaten zu dieser Frage unberührt.
5) https://www.gavi.org/news/media-room/92-low-middle-income-economies-eligible-access-covid-19-vaccines-gavi-covax-amc
6) Durchführungsverordnung (EU) 2015/2447 der Kommission vom 24. November 2015 mit Einzelheiten zur Umsetzung von Bestimmungen der Verordnung (EU) Nr. 952/2013 des Europäischen Parlaments und des Rates zur Festlegung des Zollkodex der Union (ABl. L 343 vom 29.12.2015 S. 558).
| Muster des Formblatts für die Ausfuhrgenehmigung nach Artikel 1 | Anhang I |
Die Mitgliedstaaten stellen sicher, dass auf dem ausgegebenen Formblatt klar erkennbar ist, um welche Art von Genehmigung es sich handelt. Die Ausfuhrgenehmigung gilt in allen Mitgliedstaaten der Europäischen Union bis zum Erreichen des Ablaufdatums.
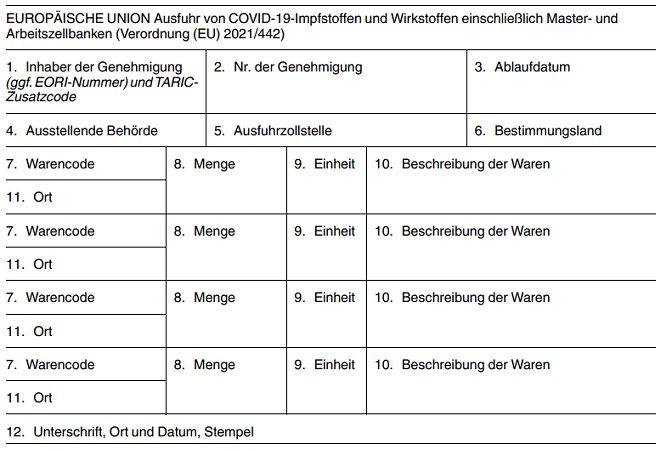
Erläuterungen zum Formblatt für die Ausfuhrgenehmigung
Das Ausfüllen aller Felder ist obligatorisch, sofern nicht anders angegeben.
Die Felder 6 bis 10 sind viermal aufgeführt, damit eine Genehmigung für 4 verschiedene Produkte beantragt werden kann.
| Feld 1 | Inhaber der Genehmigung | Vollständiger Name und vollständige Anschrift des Unternehmens, für das die Genehmigung erteilt wird, + gegebenenfalls EORI-Nummer. TARIC-Zusatzcode gemäß Anhang II. |
| Feld 2 | Nr. der Genehmigung | Die Nummer der Genehmigung wird von der Behörde, die die Ausfuhrgenehmigung erteilt, ausgefüllt und hat folgendes Format: XXyyyy999999, dabei ist XX der 2-Buchstaben-Geonomenklatur-Code 1 des ausstellenden Mitgliedstaats, yyyy das 4-stellige Jahr der Ausstellung der Genehmigung und 999999 eine 6-stellige, innerhalb von XXyyyy einmalige und von der ausstellenden Behörde zugeteilte Nummer. |
| Feld 3 | Ablaufdatum | Die ausstellende Behörde kann ein Ablaufdatum für die Genehmigung festlegen. Das Ablaufdatum darf nicht nach dem 30. Juni 2021 liegen. Wird von der ausstellenden Behörde kein Ablaufdatum festgelegt, erlischt die Genehmigung spätestens am 30. Juni 2021. |
| Feld 4 | Ausstellende Behörde | Vollständiger Name und vollständige Anschrift der Behörde des Mitgliedstaats, die die Ausfuhrgenehmigung erteilt hat. |
| Feld 5 | Ausfuhrzollstelle | Vollständiger Name und Unionscode der Zollstelle, bei der die Ausfuhranmeldung abgegeben wird. |
| Feld 6 | Bestimmungsland | 2-Buchstaben-Geonomenklatur-Code des Bestimmungslandes der Waren, für die die Genehmigung erteilt wird. |
| Feld 7 | Warencode | Der numerische Code des Harmonisierten Systems oder der Kombinierten Nomenklatur 2, in den die zur Ausfuhr bestimmten Waren bei Erteilung der Genehmigung eingereiht werden. |
| Feld 8 | Menge | Die in der in Feld 9 angegebenen Einheit gemessene Warenmenge. |
| Feld 9 | Einheit | Die Maßeinheit, in der die in Feld 8 angegebene Menge ausgedrückt wird. Die zu verwendenden Einheiten sind die Anzahl der Impfstoffdosen. |
| Feld 10 | Beschreibung der Waren | Leicht verständliche Beschreibung, die ausreichend genau ist, um die Identifizierung der Waren zu ermöglichen. |
| Feld 11 | Ort | Geonomenklatur-Code des Mitgliedstaats, in dem sich die Waren befinden. Befinden sich die Waren im Mitgliedstaat der ausstellenden Behörde, so ist dieses Feld leer zu lassen. |
| Feld 12 | Unterschrift, Stempel, Ort und Datum | Unterschrift und Stempel der ausstellenden Behörde. Ort und Datum der Ausstellung der Genehmigung. |
1) Durchführungsverordnung (EU) 2020/1470 der Kommission vom 12. Oktober 2020 über das Verzeichnis der Länder und Gebiete für die europäischen Statistiken über den internationalen Warenverkehr und die geografische Aufgliederung für sonstige Unternehmensstatistiken (ABl. L 334 vom 13.10.2020 S. 2).
2) Verordnung (EWG) Nr. 2658/87 des Rates vom 23. Juli 1987 über die zolltarifliche und statistische Nomenklatur sowie den Gemeinsamen Zolltarif (ABl. L 256 vom 07.09.1987 S. 1).
| TARIC-Zusatzcodes | Anhang II |
| Unternehmen | TARIC-Zusatzcode für Impfstoffe gegen SARS-assoziierte Coronaviren (SARS-CoV-Arten) |
TARIC-Zusatzcode für Wirkstoffe1 |
| AstraZeneca AB | 4500 | 4520 |
| Pfizer/BioNTech | 4501 | 4521 |
| Moderna Switzerland/Moderna Inc | 4502 | 4522 |
| Janssen Pharmaceutica NV | 4503 | 4523 |
| CureVac AG | 4504 | 4524 |
| Sanofi Pasteur/GlaxoSmithKline Biologicals S.A | 4505 | 4525 |
| Novavax | 4506 | 4526 |
| Andere Hersteller | 4999 | 4999 |
| 1) Wirkstoffe einschließlich Master- und Arbeitszellbanken, die zur Herstellung von Impfstoffen gegen SARS-assoziierte Coronaviren (SARS-CoV-Arten) verwendet werden. | ||
| Unternehmen | TARIC-Zusatzcode für andere Stoffe1 |
| Alle Hersteller | 4599 |
| 1) "Andere Stoffe" sind Waren oder Stoffe, die nicht zur Herstellung von Impfstoffen gegen SARS-assoziierte Coronaviren (SARS-CoV-Arten) verwendet werden, aber unter denselben KN-Codes eingereiht werden wie die Wirkstoffe. | |
 |
ENDE |  |
(Stand: 30.07.2024)
Alle vollständigen Texte in der aktuellen Fassung im Jahresabonnement
Nutzungsgebühr: ab 105.- € netto
(derzeit ca. 7200 Titel s.Übersicht - keine Unterteilung in Fachbereiche)
Die Zugangskennung wird kurzfristig übermittelt
? Fragen ?
Abonnentenzugang/Volltextversion